Лекции Лаборант школы (химия). 1 посуда лабораторная
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
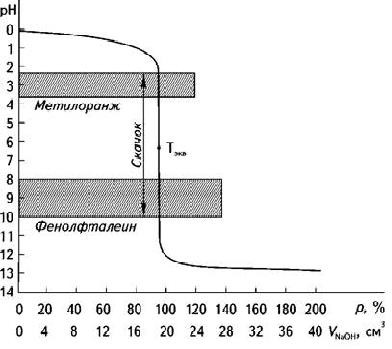
ТитрованиеТитриметрические(объѐмные) методы анализа основаны на опреде- лении массы реагента, израсходованного на реакцию с определяемым ве- ществом. Реагент (титрант) добавляют к анализируему раствору, либо в твѐрдом виде. либо в виде раствора с известной концентрацией реагента. Можно измерять массу израсходованного реагента, взвешивая сосуд с ис- следуемым раствором и добавляемым реагентом или измерять объѐм реа- гента, пошедшего на титрование. В последнем случае массу реагента вы- ражают через его объѐм по формуле: m = V∙ T , где T – титр раствора реагента, T = г/см3, т.е. количе- ство вещества в граммах, содержащихся в 1 см3 раствора. C V Э m н 1000 , где: Сн– нормальная концентрация раствора реагента (моль/дм3) Э– эквивалент реагента. Титрант добавляют к точно отмеренному объѐму анализируемого раствора небольшими порциями. После добавления каждой новой порции титранта в системе, описанной уравнением химической реакции: nA+mB AnBmустанавливается равновесие. А– анализируемое вещество, В– титрант, nи m- стехиометрические коэффициенты реакции. По мере протекания реакции концентрации определяемого вещества и титранта уменьшаются, а концентрации продуктов реакции увеличива- ются. Когда будет израсходовано количество титранта эквивалентное ко- личеству титруемого вещества, реакция закончится. Этому состоянию в системе соответствует точкаэквивалентности. 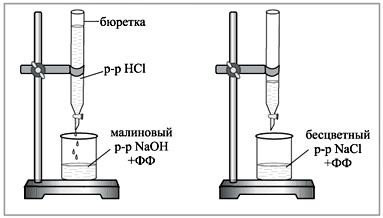 Рис. 32. Кислотно-основное титрование На практике фиксируют точку конца реакции, которая в какой-то степени приближена к точке эквивалентности. В химических методах ана- лиза точку эквивалентности фиксируют визуально (изменение цвета рас- твора, выпадение осадка). В физико-химических методах точка эквива- лентности определяется по резкому изменению физических параметров (рН, потенциал, электропроводность). В титриметрических методах анализа для измерения объѐмов рас- творов необходимо тщательно изучить правила работы с мерной посудой и правила взвешивания, необходимо правильно приготовить стандартные (титрованные) растворы с точной концентрацией. Способы приготовления титрованных растворовПоточнойнавескеисходноговещества; В качестве исходного вещества можно применять только химически чистые, устойчивые соединения, состав которых строго соответствует хи- мической формуле. По навеске с последующим определением концентрации по пер-вичномустандарту; Необходимо использовать первичный стандарт – химически чистые соединения точно известного состава, отвечающие следующими требова- ниям: содержание основного вещества в стандарте должно составлять 99,8-99,9 %; растворы стандарта должны быть устойчивы на воздухе, не долж- ны изменять титра при хранении; должны обладать большой молекулярной массой, чтобы ошибки взвешивания были минимальными; должны обладать хорошей растворимостью; должна быстро протекать реакция с веществом, концентрацию ко- торого определяют. Разбавлениемзаранееприготовленногорастворасизвестнойконцентрацией; Изфиксанала. Фиксанал – точно отвешенное количество вещества в сухом виде или в виде раствора, запаянное в стеклянную ампулу, необходимое для приго- товления 1 л. раствора определѐнной нормальной концентрации. Содер- жимое ампулы количественно переносят в мерную колбу и после раство- рения доводят объѐм водой до метки. |