Лекции Лаборант школы (химия). 1 посуда лабораторная
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
Общие приѐмы титрованияТитрование обычно ведут в плоскодонных конических колбах емко- стью 100 или 250 мл. В колбу помещают отмеренную пипеткой порцию анализируемого раствора, добавляют, если нужно, индикатор и ведут тит- рование, спуская из бюретки рабочий раствор. После прибавления каждой порции раствора жидкость в колбе перемешивают круговыми движениями. Обычно при первом титровании устанавливают приблизительный расход рабочего раствора на титрование. При повторном титровании быстро при- ливают примерно 90% рабочего раствора, а затем спускают по капле, что- бы точно установить момент конца титрования – точку эквивалентности. Затем делают по бюретке точный отсчет объема израсходованного раство- ра. При этом глаз аналитика должен быть на уровне мениска. Отсчет обычно ведут по нижнему мениску (для окрашенных растворов – по верх- нему). Каждый раствор титруют не менее трех раз и берут для расчета среднее значение. В титриметрическом анализе используют различные приемы титро- вания. Наиболее распространено прямое титрование, когда анализиру- емое вещество достаточно быстро реагирует с реактивом. Тогда исследуе- мый раствор титруют рабочим раствором непосредственно. Результаты анализа рассчитывают по расходу рабочего раствора. Так, например, тит- руют кислоту щелочью. Иногда используют прием обратноготитрования(его называют иногда титрованием по остатку). К нему приходится прибегать в тех слу- чаях, когда анализируемое вещество очень медленно взаимодействует с реактивом или вообще с ним не взаимодействует. Тогда используют тре- тий реагент, который хорошо взаимодействует и с анализируемым веще- ством, и с реактивом рабочего раствора. К анализируемому раствору при- бавляют точный объем третьего реагента, взятый заведомо в избытке, и за- тем этот избыток оттитровывают рабочим раствором. По расходу раствора третьего реагента и рабочего раствора вычисляют результаты анализа. Прием обратного титрования используют, например, при анализе окисли- телей с применением перманганата по реакции окисления – восстановле- ния. Когда определяемое вещество не взаимодействует с рабочим раство- ром или взаимодействует в нестехиометрическом соотношении, использу- ют титрование методом замещения (косвенное). В этом случае анализи- руемое вещество переводят в химическое соединение, которое можно тит- ровать рабочим раствором. Этот прием используют; например, при иодо- метрическом анализе окислителей. Расчеты в титриметрических определенияхУкажем основные термины и понятия, которые применяют при рас- четах в количественном анализе. Наряду с общехимическими способами выражения концентрации (массовая и объемная доли, молярность) в аналитической химии, особенно в титриметрии, используются специфические способы, такие как нормаль-ностьи титр. Объемная доля – отношение объема растворенного вещества к объему раствора. Так же, как и массовая доля, обычно выражается в про- центах: Молярная концентрация (молярность) – количество раство- ренного вещества в единице объема раствора 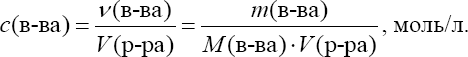 Молярная концентрация эквивалента ("эквивалентная кон-центрация", или нормальность) – количество эквивалентов веще- ства в единице объема раствора 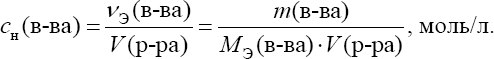 Формально, понятия "молярная концентрация" и "молярная концен- трация эквивалента" близки между собой. Однако следует знать, что мо-лярная концентрация эквивалента не всегда является однозначной харак- теристикой раствора, так как фактор эквивалентности определяется в зави- симости от конкретной реакции с участием данного вещества. Между молярностью и нормальностью существует простая взаимо- связь: 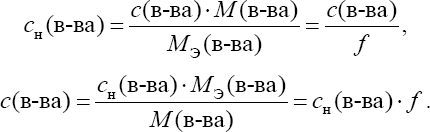 Существует опасность спутать эти два способа выражения концен- трации из-за совпадения единиц измерения и сходных обозначений. По- этому на практике для них используют различную форму записи. Вместо единицы измерения к величине концентрации добавляют ''М'' для моляр- ности и ''н.'' для нормальности. Например: 1 М H2SO4 – одномолярный раствор серной кислоты (молярная кон- центрация 1 моль/л); 0,1 М H2SO4 – децимолярный раствор серной кислоты; 0,01 М H2SO4 – сантимолярный раствор серной кислоты; 0,001 М H2SO4– миллимолярныйраствор серной кислоты. 1 н. H2SO4 – однонормальныйраствор серной кислоты (молярная концентрация эквивалента 1 моль/л); 0,1 н. H2SO4 – децинормальный раствор серной кислоты; 0,01 н. H2SO4 – сантинормальный раствор серной кислоты; 0,001 н. H2SO4 – миллинормальныйраствор серной кислоты. Титр и нормальность связаны между собой соотношениями: 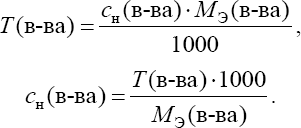 Титрпоопределяемомувеществу– масса определяемого веще- ства, соответствующая одному миллилитру раствора титранта Титр по определяемому веществу используют при проведении боль- шого числа однотипных определений (массовых анализов), что позволяет сократить число операций при расчете результатов анализа. |
