Лекции Лаборант школы (химия). 1 посуда лабораторная
 Скачать 1.87 Mb. Скачать 1.87 Mb.
|
Расчет результатов анализаГлавноесоотношение, используемое в титриметрическом анализе, следует из закона эквивалентов. В точкеэквивалентностиколичества вещества эквивалентов израс- ходованного титранта и аналита равны между собой, то есть νЭ1=νЭ2. νЭ(в-ва) = сн(в-ва)·V(р-ра), 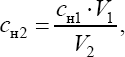 где индексы 1 и 2 соответствуют растворам титранта и аналита. Чаще всего вычисляют массу определяемого вещества или, с использованием титра, Погрешностьтитриметрическогоанализавключает в себя: погрешность определения концентрациистандартногорас-твора; погрешность измерения объематитрантапо бюретке; погрешность измерения объемааликвотыопределяемого рас- твора мерной пипеткой. Кроме того, величина погрешности может зависеть от используемых объемов и концентраций титранта и аналита. Для повышения надежности результата выполняют несколько по- вторных определений, вычисляют среднееарифметическоеиз сходящихся данных и рассчитывают вероятнуюпогрешностьсреднегос использова- нием t-критерия Стьюдента. Типичная величина относительной погрешности результатов титрования составляет 0,1…0,3%.Метод нейтрализации Этот метод титриметрического анализа включает все аналитические определения, в основе которых лежит реакция между ионом водорода и гидроксид-ионом: н+ + он- = н2о Методом нейтрализации проводят количественное определение кис- лот (титруя их основаниями), оснований (титруя их кислотами), солей, имеющих в растворе кислую или щелочную реакцию, и ряда других со- единений. Различают ацидиметрическое титрование (от acidium– кислота), в котором в качестве титранта используют растворы серной или соляной кислоты, и алкалиметрическое титрование (от alcalis– щелочь), где тит- рантом служат растворы гидроксида натрия или калия. В ходе титрования изменяется концентрация водородных и гид- роксидных ионов в растворе. В точке эквивалентности концентрации во- дородных и гидроксидных ионов должны быть равны: [Н+] = [ОН-] Однако, это возможно только при взаимодействии сильной кислоты и сильного основания. Если в реакции участвует слабое основание или слабая кислота, в точке эквивалентности наблюдается некоторый избыток водородных или гидроксидных ионов, то точка эквивалентности не совпа- дает полностью с точкой нейтрализации. Точку эквивалентности при кислотно-основном титровании опре- деляют с помощью химических индикаторов или физико-химическими методами. Большая часть кислотно-основных индикаторов существует в двух формах, имеющих различную окраску, причем переход из одной формы в другую связан с изменением концентрации ионов водорода, т. е. рН среды. Интервал значений рН, в котором изменяется окраска индикатора, называют интерваломпереходаиндикатора. Каждый индикатор имеет свой интервал перехода, который зависит от особенностей его структуры. Другая характеристика индикатора – показатель титрования рТ. Это зна- чение рН, при котором половина молекул индикатора перешла в другую форму. Для метилового оранжевого рТ = 4, т. е. при рН = 4 половина мо- лекул индикатора находится в азоформе, а половина – в хиноидной форме. Некоторые кислотно-основные индикаторы представлены в табл.4. Таблица 4 Характеристика важнейших кислотно-основных индикаторов
|
