Практика Хирургия. 1 Заболевания и повреждения органов грудной клетки Плевральные пункции (асс.)
 Скачать 10.28 Mb. Скачать 10.28 Mb.
|
|
Панкреатогенный (ферментативный, абактериальный) перитонит является показанием к лапароскопической санации и дренированию брюшной полости. Важно особо отметить, что факт инфицирования некротических тканей является важным, но не единственным показанием к операции. В тех ситуациях, когда заболевание манифестирует развитием стойкой системной воспалительной реакции, дыхательной, миокардиальной и почечной недостаточности, сопровождается развитием шока, особенно в ранние сроки заболевания, а данные клинических, лабораторных и инструментальных методов исследования свидетельствуют в пользу развития распространенного некроза в ПЖ, ЗК и БП и не представляют убедительной информации об инфицировании, промедление с оперативным лечением считаем неоправданным. Такая тактика обоснована теми фактами, что распространенные формы стерильного ланкреонекроза при отсутствии их инфицирования, являются мощным генератором неконтролируемого синтеза про- и антивоспалительных медиаторов воспаления, инициирующих и поддерживающих выраженную воспалительную реакцию, панкреатогенный шок и полиорганную недостаточность. Безусловно, что при развитии гиподинамической фазы шока, прогрессирующей почечной недостаточности абсолютных показаний к широкой лапаротомии нет. В такой ситуации преимущество должны получить методы лапароскопического дренирования брюшной полости, транскутанных вмешательств под контролем ультрасонографии, лапаротомии из мини-доступов в сочетании с активными средствами детоксикации. Абсолютный отказ от представленных методик хирургического лечения в этих наблюдениях в угоду общеизвестным представлениям, что большинство больных со стерильным панкреонекрозом успешно выздоравливают при проведении только консервативных мероприятий, по нашему мнению, является необоснованным заблуждением. Важную роль в объективизации показаний к операции играет использование интегральных шкал оценки тяжести состояния больного с деструктивным панкреатитом. Использование этих систем-шкал позволяет еще раз убедить себя и коллег в правильности принятого решения, а предполагаемую операцию выполнить в соответствии со степенью тяжести состояния больного. Основной задачей первой операции является мобилизация всех очагов некротической деструкции в забрюшинном пространстве (декомпрессия), полноценная некр- или секвестрэктомия, отграничение (компартаментализация) всех некротических зон от свободной брюшной полости, обеспечение адекватного оттока экссудата (дренирование) с планированием последующего вмешательства в определенные сроки. Нам представляется, что настойчивое стремление удалить одномоментно, на одной операции все некротические ткани, даже прибегая к резекции ПЖ, не имеет ни теоретического, ни практического обоснования. Об этом четко свидетельствует исторический опыт, когда при выполнении геми- и панкреатэктомий летальность превышала 50%. Большая по объему операция может быть выполнена спустя несколько суток (24—48—72 ч) после первой операции, когда степень тяжести состояния больного будет сколько-нибудь сопоставима с тяжестью внутрибрюшного воспалительно-некротического процесса. Хирургические доступы представлены классическими вариантами: срединная или двухподреберная лапаротомия. Срединная лапаротомия может быть дополнена синхронной люмботомией, что определяется локализацией и характером поражения ЗК. Необходимо отметить что, несмотря на травматичность двухподреберного доступа, его основным преимуществом является техническое «удобство» мобилизации флангов ободочной кишки и «свобода» манипуляций в таких менее доступных областях ЗК, как парапанкреатическая клетчатка в зоне хвоста ПЖ, параколон слева у больных с ожирением, выраженным парезом ободочной кишки. Техническое решение этапа некрсеквестрэктомии однотипно и предполагает ее выполнение в максимально возможном объеме с сохранением естественных отграничивающих структур — брюшины мезентериального синуса и брыжейки ободочной кишки. Особое значение необходимо придавать мобилизации соответствующих сегментов ободочной кишки по латеральному контуру и выбору метода дренирующих операций в забрюшинном пространстве, т.к. избранный уже на первой операции метод дренирования существенно определяет выбор режима оперативной тактики. В настоящее время используют три основных метода дренирующих операций при панкреонекрозе, которые обеспечивают различные условия для дренирования ЗК и БП в зависимости от распространенности, глубины и характера поражения ПЖ, ЗК и БП. Предлагаемые методы дренирующих операций включают определенные технические способы наружного дренирования различных отделов забрюшинной клетчатки и брюшной полости, что обязательно предполагает выбор определенных тактических режимов повторных вмешательств: • программируемых ревизий и санаций всех зон некротической деструкции и инфицирования в различных отделах забрюшинного пространства («по программе»), проводимых в соответствии с интраоперационными находками и тяжестью состояния больного в разном объеме и временном интервале; • неотложных и вынужденных повторных вмешательств («по требованию») вследствие имеющихся и/или развившихся осложнений (продолжающаяся секвестрация, неадекватное дренирование, кровотечение и т.д.) в динамике патоморфологической трансформации зон некроза/инфекции в ЗК и БП. Методы дренирующих операций забрюшинного пространства при панкреонекрозе классифицируют следующим образом: 1) «закрытый»; 2) «открытый»; 3) «полуоткрытый». Основным критерием выбора метода дренирующих операций является четкая и своевременная верификация распространенности и факта инфицирования некротических тканей в ПЖ, ЗК и БП. «Закрытый» метод дренирующих операций, получивший свое развитие и утверждение в 1980—1990 гг. прошедшего столетия, включает активное дренирование ЗК и БП в условиях анатомической целостности полости сальниковой сумки и брюшной полости. Техническое решение этого метода обеспечено имплантацией нескольких многоканальных силиконовых дренажных конструкций для введения антисептических растворов фракционно или капельно в очаг некротической деструкции (инфекции) с постоянной активной аспирацией. «Закрытый» метод дренирования предполагает выполнение повторных вмешательств только «по требованию», в которых нуждается 30— 40% больных панкреонекрозом. Контроль за очагом деструкции/инфекции и функцией дренажей осуществляется по результатам клинико-лабораторных, ультразвуковых, КТ-данных, «жесткой» и «мягкой» видеооптической техники, фистулографии. Современная модификация «закрытого» метода дренирования предполагает применение вариантов лапароскопической «закрытой» оментобурсоскопии и санации полости сальниковой сумки и различных отделов забрюшинной клетчатки. С использованием лапароскопической техники выполняют лапароскопию, декомпрессию желчного пузыря, санацию и «закрытое» дренирование брюшной полости. В последующем с использованием специально разработанного инструментария из минилапаротомного доступа осуществляют осмотр ПЖ, парапанкреатической клетчатки, некр- или секвестрэктомию в полном объеме и формируют панкреатооменто-бурсостостому. Начиная с 3—5-го дня после предыдущей операции с интервалом 1—3 сут, выполняют программируемую этапную санацию. В межоперативном периоде проводят «закрытый» лаваж полости сальниковой сумки и забрюшинной клетчатки. Технический прогресс позволяет применять методы эндоскопического дренирования и санации забрюшинного пространства через поясничный внебрюшинный доступы. Все большее распространение получают малоинвазивные хирургические методы транскутанного пункционного дренирования различных отделов ЗК, желчного пузыря под контролем ультрасонографии и КТ. Апробированные в клинической практике малоинвазивные вмешательства легко выполнимы, малотравматичны и эффективны при обоснованном показании и соблюдении методологии. При неэффективности вышеперечисленных методов дренирования при панкреонекрозе показана лапаротомия. Методы «открытого/полуоткрытого» хирургического лечения получили свое развитие в начале 1980-х годов и в течение последующих десятилетий постоянно совершенствовались. Основными показаниями к «открытому/полуоткрытому» методу дренирования забрюшинного пространства являются: • распространенные, крупномасштабные формы панкреонекроза в сочетании с поражением раз-личных отделов забрюшинной клетчатки; • инфицированный панкреонекроз и/или панкреатогенный абсцесс в сочетании с крупноочаговыми формами инфицированного панкреонекроза, предполагающими продолжительную во времени и по масштабу секвестрацию. «Открытый» метод дренирующих операций при панкреонекрозе предполагает выполнение программируемых ревизий и санаций забрюшинного пространства и имеет два основных варианта технических решений, определяемых преимущественным масштабом и характером поражения ЗК и БП: • панкреатооментобурсостомия + люмботомия; • панкреатооментобурсостомия + лапаростомия. Показанием к панкреатооментобурсостомии + люмботомии является инфицированный и стерильный распространенный панкреонекроз в сочетании с некротическим поражением парапанкреатической, параколической и тазовой клетчатки. Панкреатооментобурсостома может включать фиксацию фрагментов желудочно-ободочной связки к париетальной брюшине в верхней трети лапаротомной раны по типу марсупиализации и дренирование всех зон некроза/инфекции дренажами Пенроза в комбинации с многопросветными трубчатыми конструкциями. Дренаж Пенроза, именуемый в отечественной литературе как «резиново-марлевый тампон», пропитывают антисептиками и мазями на водорастворимой основе. Такое техническое решение хирургического вмешательства обеспечивает в последующем беспрепятственный доступ к этим зонам и выполнение этапных некр- или секвестрэктомий в программируемом режиме с интервалом 48—72 ч в зависимости от интраоперационных данных и интегральной тяжести состояния больного. Этапная замена дренажей Пенроза позволяет устранить их существенный недостаток, связанныи с кратковременной дренажной функцией и экзогенным (ре)инфицированием. По мере очищения ЗК от некрозов, секвестров и детрита, уменьшения очага деструкции до минимальных размеров, при появлении грануляционной ткани показан переход к «закрытому» методу дренирования. При развитии распространенного гнойного перитонита и крайней степени тяжести состояния больного, при распространенном инфицированном панкреонекрозе в сочетании с обширным поражением ЗК, тяжелым сепсисом, септическим шоком показана лапаростомия с последующим проведением программируемых некр- и секвестрэктомий и санаций забрюшинной клетчатки, брюшной полости через 12—48 ч. «Полуоткрытый» метод дренирования, известный с 1960-х годов, при панкреонекрозе предполагает установку трубчатых многопросветных дренажных конструкций в комбинации с дренажем Пенроза. В этих условиях лапаротомную рану ушивают послойно, а комбинированную конструкцию дренажей выводят через широкую контрапертуру в пояснично-боковых отделах живота (люмботомия). Такого рода операции получили название «традиционных», когда смена дренажных конструкций, как правило, отсрочена на 5—7 суток. При крупномасштабном некрозе и секвестрации, сложной топографии формируемых каналов зачастую создаются условия для неадекватного дренирования очагов некроза/инфекции и повторные операции у 30—40% больных выполняют с опозданием во времени в режиме «по требованию». Поэтому для предупреждения этих осложнений потенциал дренирования забрюшинной клетчатки можно повысить, если производить адекватную замену дренажей в режиме «по программе», не реже чем через 48—72 ч, пропитывать дренаж Пенроза антисептическими растворами, совмещать с сорбентами или мазями на водорастворимой основе. Уже в 1980—1990 гг. реализация адекватной хирургической тактики в условиях «полуоткрытого» метода наружного дренирования при панкреонекрозе была достигнута при использовании только программируемого режима оперативных вмешательств с использованием преимуществ малоинвазивных эндоскопических вмешательств. Режим «по требованию» в этой ситуации признан неэффективным, не имеющим ни теоретического, ни практического обоснования. Эти рекомендации подтверждаются данными систематизированного литературного анализа, показавшего, что в условиях применения «традиционных» методов хирургического лечения инфицированных форм панкреонекроза летальность максимальная и превышает 40%. Вместе с тем при «открытом» методе дренирования летальность снижена в два раза и существенно не отличается от таковой при использовании «закрытых» дренирующих операций при инфицированных формах панкреонекроза. Успех хирургического лечения панкреонекроза во многом определяется адекватностью этапа(ов) некр- и секвестрэктомий и последующего устранения резидуальных и реккурентных очагов некроза и инфицирования, что практически зависит от технического решения и обеспечения определенного метода дренирующей операции в забрюшинном пространстве. Так при «открытом» дренировании забрюшинной клетчатки адекватность вмешательства гарантирована планомерными ревизиями и некр- или секвестрэктомиями. При «закрытых» дренирующих операциях их эффективность достигается активным лаважем-санацией ЗК, привлечением методов точной и ранней инструментальной диагностики (ультрасонография, КТ, видеолапароскопия, фистулография) резидуальных очагов деструкции и инфицирования, а также своевременным выполнением релапаротомий, повторных дренирований различных отделов забрюшинной клетчатки «по требованию». Не случайно средние сроки госпитализации (60 сут.) и длительности пребывания в отделении интенсивной терапии (30 сут.) эквивалентны при различных тактических подходах. Таким образом, представленные методы хирургического лечения панкреонекроза не являются конкурирующими, так как при обоснованных показаниях и соблюдении методологии призваны обеспечить адекватную санацию всех зон некротической деструкции и панкреатогенной инфекции. Перспективным направлением научно-практических исследований является сравнительная оценка эффективности различных методов хирургического лечения, в том числе и с использованием малоинвазивных технологий, которая должна быть построена на принципах доказательной медицины. В заключение отметим, что составляющие «хирургического успеха» ведения больных панкреонекрозом должны включать и такой немаловажный фактор, как лечение в специализированных хирургических центрах, имеющих определенный опыт, квалифицированных специалистов и соответствующее оснащение. XI. Заболевания щитовидной железы 1. Пальпация щитовидной железы Пальпация щитовидной железы остается самым доступным и простым способом обследования пациента – тем не менее, использовать этот метод диагностики должен только квалифицированный специалист. Кроме того, для диагностики важно подтвердить сведения, полученные при пальпации, другими методами инструментального и лабораторного исследования. Увеличина ли щитовидная железа?  Щитовидная железа состоит из двух долей примерно одинакового размера, соединенных соединительнотканным перешейком. Доли расположены по обеим сторонам трахеи, а перешеек примыкает к передней ее стенке, срастаясь с тканями, ее окружающими, очень тесно (подробнее смотрите в здесь). Щитовидная железа состоит из двух долей примерно одинакового размера, соединенных соединительнотканным перешейком. Доли расположены по обеим сторонам трахеи, а перешеек примыкает к передней ее стенке, срастаясь с тканями, ее окружающими, очень тесно (подробнее смотрите в здесь).Вес щитовидной железы в норме расположен в пределах от 20 до 60 г, а размер каждой доли должен составлять от 5*2*1 до 8*4*3 см. При половом созревании наблюдается некоторое увеличение массы железы, а во время старения она наоборот, снижается. Размеры щитовидки у женщин, как правило, превышают размеры мужской железы, а во время беременности происходит ее увеличение, которое, как правило, возвращается в норму в течение полугода после родов. Говорить об увеличении щитовидной железы (при относительно небольшой величине органа, что чаще встречается на начальной стадии заболеваний) можно только в том случае, когда гиперплазия органа превышает 10% возрастной нормы. Именно поэтому важно своевременное обращение за медицинской помощью при появлении любых признаков неблагополучия – врач знает правила пальпации щитовидной железы и может прочувствовать минимальные степени увеличения органа. Стоит помнить и о том, что нормальные размеры щитовидки не гарантируют отсутствия патологических изменений в органе – более, чем у 50% пациентов пальпаторные изменения в этой железе внутренней секреции выявить не удается. Немного теории о работе щитовидной железы Как вы наверняка знаете, щитовидной называется железа внутренней секреции, которая продуцирует гормоны, важные для поддержания гомеостаза. Щитовидка является органом, который имеет максимальное кровоснабжение с хорошо развитой артериальной и венозной системой. Кровоснабжение осуществляется по четырем тиреоидным артериям (двум верхним и двум нижним), которые создают анастомозы. Щитовидная железа отвечает за секрецию двух йодсодержащих гормонов – тироксина и трийодитронина (Т4 и Т3 соответственно) и одногогормона пептидной природы– кальцитонина. Тиреоидные гормоны участвуют в синтезе белков во многих органах и тканях в организме человека. Если концентрация гормонов выше нормы, то наблюдается снижение энергичности, появляется резкая утомляемость, сонливость. С чего начинают обследование пациента? Чтобы своевременно выявить причину заболевания и начать лечение, эндокринологи направляют на различные лабораторные и клинические исследования (анализы на гормоны, ультразвуковое исследование и т.д.). Данные процедуры определяют активность и функциональность щитовидной железы, от чего зависит возможность лечения без хирургического вмешательства или необходимость проведения операции. 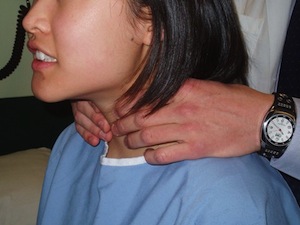 Первичным способом исследования щитовидной железы считается пальпация. Она проводится эндокринологом во время обращения больного. Пальпация дает возможность на ощупь определить реальную величину железы, ее консистенцию, наличие узловых образований на щитовидке. Первичным способом исследования щитовидной железы считается пальпация. Она проводится эндокринологом во время обращения больного. Пальпация дает возможность на ощупь определить реальную величину железы, ее консистенцию, наличие узловых образований на щитовидке.При проведении процедуры пациент должен лежать в расслабленном состоянии, чтобы сохранялось ровное и спокойное дыхание. Реакции больного на надавливания и поглаживания, за которыми внимательно следит врач, помогают визуально определить наличие множества заболеваний, вызванных нарушениями функционирования железы. Любая патология щитовидной железы — следствие неправильной секреции тиреоидных гормонов, иногда переизбытком кальцитонина и простагландинов. Нормальной считается ситуация, при которой пропальпировать этот орган не удается. В медицинской практике известно пять степеней увеличения данного органа. Именно степень увеличения железы свидетельствует о наличии какого-либо заболевания. |
