итог физиология. ИТОГ физа. 2 блок Гипоксия типовой патологический процесс, характеризующийся недостаточностью биологического окисления, причина которого заключается в неадекватности снабжения тканей кислородом или нарушении его использования тканями. Гипоксия
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
Химические канцерогены a) Органические канцерогены · полициклические углеводороды (ПАУ) - наиболее важные из них, «сильные» канцерогены, бенз(а)пирен (содержится в сигаретах, в почве, в выбросах вулканов) и диметилбенз(а)антрацен; становятся конечными канцерогенами в организме, превращаясь в соответствующие эпоксиды; · ароматические амины и амиды - нафтиламин, бензидин вызывают профессиональный рак мочевого пузыря; · аминоазосоединения - ортоаминоазотолуол, диметиламиноазобензол; · нитрозосоединения - диметилнитрозамин, диэтилнитрозамин, этил- и диэтилнитрозомочевина; могут синтезироваться в организме из нитритов (нитратов) и вторичных аминов, содержащихся в пище; кроме того, вторичные амины могут образовываться в толстой кишке при участии бактериальной флоры, которая в то же время способна переводить нитраты в нитриты · афлатоксины - вещества, образуемые плесенью Aspergilus flavus, поражающей пищевые продукты (особенно арахис); · другие органические канцерогенные вещества, относящиеся к различным классам соединений - уретан, этионин, четыреххлористый углерод, хлорэтиламины, эпоксиды, лактоны, винилхлорид, пластмассы, липидные перекиси и др. b) Неорганические канцерогены: хром, мышьяк (примесь его в сигаретах в 15 раз превышает его максимально допустимое количество), кобальт, никель (содержится в табачном дыме), бериллий, свинец, кадмий и др. c) Лекарственные канцерогены · Рентгеноконтрастный препарат торотраст (включавший окись тория) применялся в 1930-1945 годах для диагностических целей при заболеваниях печени и селезенка и способствовал спустя 15–20 лет возникновению злокачественных опухолей. Отлагаясь в костях близ кроветворных тканей, природный торий-232 становится источником гораздо более опасных для организма изотопов - мезотория, тория-228, торона. · Противоопухолевые лекарства - некоторые лекарства, используемые для лечения опухолей (алкилирующие агенты, типа циклофосфамида, хлорамбуцила, бисульфана и тиотефа) воздействуют на синтез нуклеиновых кислот и в опухолевых клетках, и в нормальных клетках и могут вызывать онкогенные мутации (например, лейкемия - наиболее частое неопластическое осложнение химиотерапии рака). · Эстрогены– вызывают гиперплазию эндометрия, которая сопровождается сначала цитологической дисплазией, переходящей затем в рак эндометрия. Предполагаемый механизм образования ДНК-повреждающих реактивных метаболитов в процессе обмена эстрогенов (J.Liehr, 1990) заключается в том, что благодаря ферментативным реакциям в тканях-мишенях (молочная железа, эндометрий и др.) из классических эстрогенов типа эстрадиола или эстрона образуются катехолэстрогены, в ходе метаболического восстановительного цикла возникают свободные радикалы, в частности семихиноны и их производные, которые в свою очередь индуцируют образование других свободных радикалов, включая супероксидный анион и перекиси липидов, которые могут повреждать белки и ДНК. · Стероидные гормоны – использование оральных контрацептивов и анаболических стероидов иногда связывают с возникновением доброкачественных печеночноклеточных аденом, описано несколько случаев возникновения печеночноклеточного рака. · Препараты различных групп, вызывающие гинекомастию (некоторые с известным стероидным эффектом, механизм действия других неясен), которая является предраковым заболеванием (рак молочной железы у мужчин): изониазид, ранитидин, метронидазол, метилдофа, эналаприл, амиодарон. Общие закономерности действия химических канцерогенных веществ. Все химические канцерогенные соединения обладают рядом общих черт действия независимо от их структуры и физикохимических свойств. Прежде всего для канцерогенов характерен длительный латентный период действия. Опухолевая трансформация начинается не сразу после контакта канцерогена с клеткой: вначале канцерогенное вещество подвергается биотрансформации, в результате образуются канцерогенные метаболиты, которые внедряются в клетку, изменяют ее генетический аппарат, обусловливая малигнизацию. Проявление онкогенной активности канцерогена зависит от генетических особенностей, пола, возраста, коканцерогенных модифицирующих влияний. Канцерогенная активность вещества определяется скоростью и интенсивностью метаболических превращений и соответственно количеством образующихся конечных канцерогенных метаболитов, а также дозой вводимого канцерогена. III. Полиэтиологическая теорияобъединяет две выше упомянутые теории. IV. Генотоксическая (современная) теория Превращение нормальной клетки в опухолевую является результатом стойких изменений в геноме клетки. Т.е. все канцерогены генотоксичны, поскольку вызывают повреждение ДНК. С открытием молекулярных механизмов канцерогенеза появился новый взгляд на этиологию – генотоксическая теория. Вирусы, физические факторы и химические вещества - это только виды канцерогенов. Молекулярные механизмы опухолевого роста У делящейся клетки с поврежденной ДНК есть выбор: либо приостановка деления до полной репарации повреждений, либо самоуничтожение путем апоптоза. Гибель одной клетки не может иметь никаких отрицательных последствий, а ее сохранение таит смертельную угрозу возникновения клона дефектных (потенциально опухолевых) клеток. Можно предполагать, что опухолевый рост возможен лишь потому, что дефектные клетки способны каким-то образом избегать апоптоза. Существует несколько механизмов, повреждение которых может способствовать опухолевому росту: промитогенные факторы (протоонкогены и протоонкобелки); антимитогенные факторы (супрессоры); механизмы защиты (репарация ДНК и апоптоз). На периферии клетки существуют рецепторы ростовых факторов, воспринимаемые рецепторами внешние сигналы в виде каскадов реакций фосфорилирования передаются внутрь клетки. Перенос митогенного сигнала от периферии клетки к ее генетическому аппарату осуществляется в виде каскада реакций фосфорилирования посредством протеинкиназ (ферментов, фосфорилирующих белки). Волна митогенной импульсации в упрощенном виде сводится к передаче фосфатной группы, наподобие эстафетной палочки, от одной протеинкиназы к другой. В конечном итоге она достигает ядерных регуляторных белков (транскрипционных факторов), активирует их (тоже посредством фосфорилирования) и тем самым индуцирует перепрограммирование генома. После обработки сигнала в клеточном ядре поток молекул мРНК индуцирует митотическую активность. 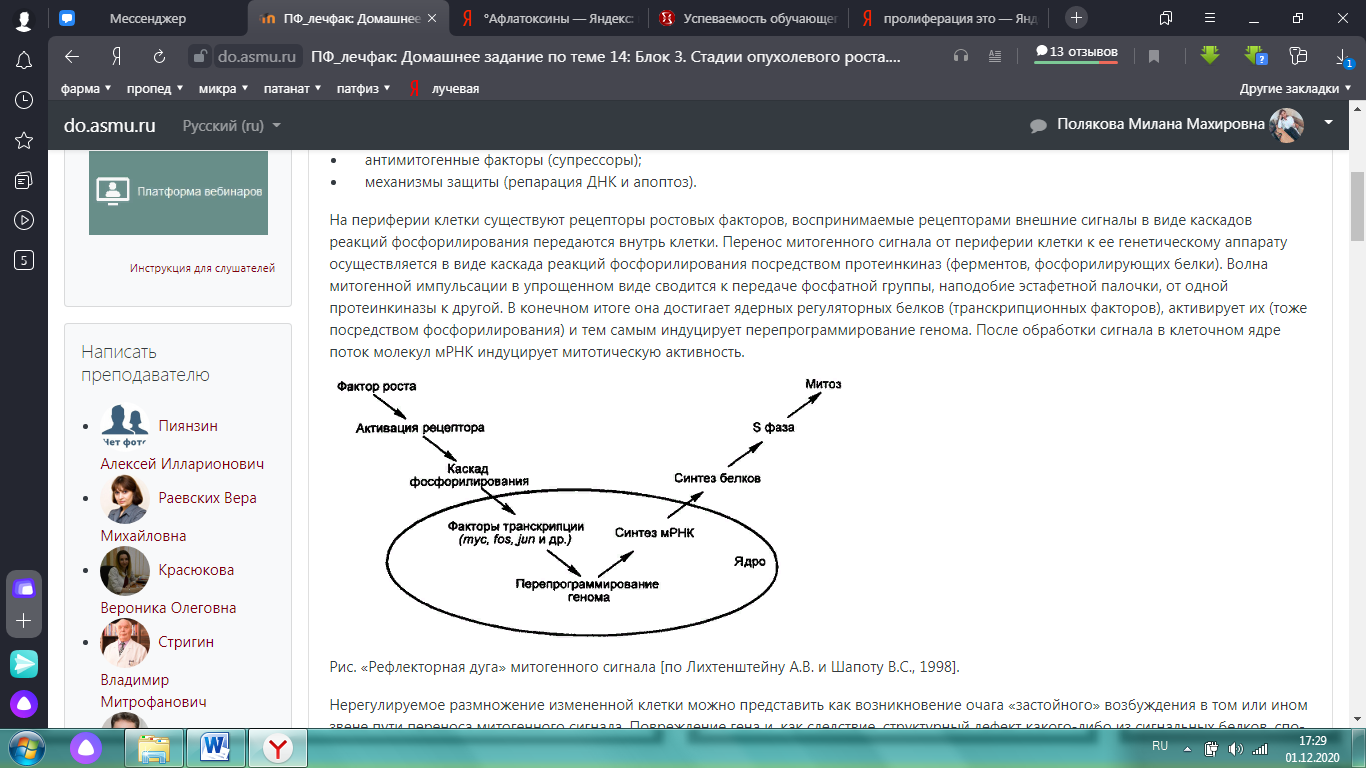 Рис. «Рефлекторная дуга» митогенного сигнала [по Лихтенштейну А.В. и Шапоту В.С., 1998]. Нерегулируемое размножение измененной клетки можно представить как возникновение очага «застойного» возбуждения в том или ином звене пути переноса митогенного сигнала. Повреждение гена и, как следствие, структурный дефект какого-либо из сигнальных белков, способный зафиксировать его в постоянно активном состоянии (т.е. сделать независимым от «вышестоящих» регуляторных инстанций) – один из главных механизмов канцерогенеза. Нормальные гены, участвующие в переносе митогенного сигнала и потенциально способные на такое превращение, называются протоонкогенами. Под влиянием мутаций протоонкогены претерпевают так называемую активацию, что способствует их превращению в онкогены, экспрессия которых вызывает возникновение и прогрессию опухолей. Протоонкоген может превратиться в онкоген при замене в нем даже одного из 5000 нуклеотидов. В настоящее время известно около сотни протоонкогенов. Так, все ключевые белки, участвующие в переносе митогенного сигнала, кодируются протоонкогенами. Например, рецептор эпидермального фактора роста кодируется протоонкогеном erbB, тирозиновая протеинкиназа на внутренней поверхности плазматической мембраны клетки - протоонкогеном src, G-белки – протоонкогеном семейства ras, ядерные транскрипционные факторы являются продуктами протоонкогенов fos, jun, myc. Протоонкогены являются акселераторами клеточного деления и в случае превращения в онкогены проявляют себя как доминантный признак. В нормальных клетках присутствуют факторы, тормозящие клеточное деление, блокирующие каждый своим способом разные этапы митогенной стимуляции, это гены-супрессоры, или антионкогены. Одним из таких генов является ген р53, продукт этого гена является регулятором транскрипции, его называют «главным хранителем генома». Деятельность р53 проявляется в момент вхождения клетки в фазу синтеза ДНК (граница фаз G1/S, когда проверяется целостность ДНК), в случае неудовлетворительной целостности ДНК запускается апоптоз. Полная трансформация клетки, таким образом, является следствием нескольких генетических событий: активации онкогена(ов) и инактивации гена(ов), осуществляющих супрессорные функции. Два типа генов управляют размножением клеток: протоонкогены, которые играют роль акселераторов деления, и гены-супрессоры, выполняющие функцию тормозов. Заклиньте акселератор или уберите тормоза - и клетка, будто спущенная с цепи, начнет безостановочно делиться (J.M. Bishop, лауреат Нобелевской премии 1989 г.). Стадии канцерогенеза 1. Индукция (инициация) заключается в мутации одного из генов, регулирующих клеточное размножение (протоонкоген превращается в онкоген) → клетка становится потенциально способной к неограниченному делению; инициирующими факторами являются различные канцерогены. 2. Промоция (ускорение) - стимуляция клеточного деления промоторами, благодаря которой создается критическая масса инициированных клеток. Промоторы – это химические вещества, не вызывающие повреждения ДНК, не являющиеся канцерогенами. Свою деятельность начинают онкогены → синтезируются онкобелки → количество инициированных клеток увеличивается. 3. Прогрессия - наряду с увеличением массы опухоли она постоянно приобретает новые свойства, «озлокачествляется» - все большую автономность от регулирующих воздействий организма, деструктивный рост, инвазивность, способность к образованию метастазов (обычно отсутствующую на ранних этапах) и, наконец, приспособляемость к меняющимся условиям. Опухоль представляет собой потомство (клон) одной первичной клетки, которая в результате многостадийного процесса приобрела способность нерегулируемого роста. Первичная трансформированная клетка передает свои свойства только своим потомкам, т.е. «вертикально». При этом окружающие опухоль нормальные клетки в процесс перерождения не вовлекаются. Это представление получило название положения о клональном происхождении опухоли. Клональная гетерогенность опухоли развивается из-за генетической нестабильности опухолевой клетки. В клетках опухоли могут происходить сотни тысяч мутаций, но только несколько из них способствуют росту, генетическому разнообразию и развитию опухоли. Они называются драйверными (driver). Остальные мутации, «пассажирские» (passanger), сами по себе не делают клетку злокачественной. Это приводит к появлению новых клонов, различающихся генотипически и фенотипически. В результате селекции отбираются и выживают самые злокачественные клоны. После химиотерапии остается всего 0,1% клеток опухоли, но так как клеточный цикл равен 24 часам, то опухоль может восстанавливаться через 10 суток и быть резистентной к прежней химиотерапии. Драйверные мутации, изменения в количестве или структуре белков опухолевых клеток используют в качестве биомаркеров – мишеней, по которым подбирают лечение. Чем больше мишеней известно, тем более точным может быть выбор из потенциально эффективных схем лечения. Высокоэффективные противоопухолевые лекарственные препараты имеют таргетную (от англ. Target – цель) природу. То есть они специфически «нацелены» на строго определённые белковые молекулы, которые играют важную роль в функционировании опухолевых клеток. Атипизм (от а + греч. typicos - образцовый, типичный) - совокупность признаков, отличающих опухолевую ткань от нормальной, и составляющих биологические особенности опухолевого роста. Анаплазия или катаплазия (от ana - обратное, противоположное, kata - вниз + греч. plasis - формирование) - изменение структуры и биологических свойств опухоли, делающее их похожими на недифференцированные ткани. Биологические особенности, характерные для доброкачественных и злокачественных опухолей 1. Атипизм размножения - бесконтрольное деление опухолевых клеток. · нерегулируемое размножение клеток (например, ослабление свойств опухолевых клеток тормозить митотический цикл и передвижение при контакте друг с другом, т.е. отсутствие контактного торможения); · утрата верхнего «лимита» числа делений клетки (так называемого лимита Хайфлика): нормальные клетки делятся до определенного максимального предела (у млекопитающих в условиях клеточной культуры до 30-50 делений), после чего они погибают, а опухолевые клетки приобретают способность к бесконечному делению (иммортализация - «бессмертие»данного вида клеток). 2. Атипизм регуляции роста и дифференцировки (дедифференцировка) - частичное или полное подавление процесса созревания клеток. Опухоль приобретает сходство с эмбриональными клетками, (мало митохондрий, рецепторов, особые белки-фетопротеины), при этом созревание остановлено, нет специализации, обучения клеток. Этот атипизм резко выражен у злокачественных опухолей и слабо - у доброкачественных. Причинами его являются утрата опухолью факторов, стимулирующих дифференцировку ее клеток, или пониженная чувствительность клеток к ним. Процессы роста, дифференцировки и деления в норме находятся под контролем центральной эндокринной регуляции, которая осуществляется соматотропным гормоном, гормонами щитовидной железы, инсулином. Кроме этих общих факторов, в каждой ткани существуют свои факторы роста и дифференцировки (фактор роста эпидермиса, тромбоцитарный фактор, интерлейкины). Индукция роста и дифференцировки начинается с взаимодействия фактора роста с рецептором фактора роста на клеточной мембране (в опухолевой клетке этот этап может быть нарушен). На следующем этапе образуются вторичные посредники - циклические аденозин- и гуанозинмонофосфат, причем для нормального роста и дифференцировки характерно преобладание цАМФ. Образование цГМФ сочетается с усилением пролиферации. В опухолевых клетках это типичный признак. 3. Биохимический атипизм новообразований включает: · интенсивный синтез онкобелков («опухолеродных» или «опухолевых» белков). Эти белки обусловливают появление у клеток обязательных опухолевых особенностей (бесконтрольное деление, утрата лимита деления, иммортализация и др.). · уменьшение синтеза и содержания белков-супрессоров синтеза ДНК. Дефицит гистонов способствует активации синтеза ДНК- и РНК-матриц, что в свою очередь приводит соответственно к удвоению генов, хромосом, белковой массы и к делению клеток. · образование несвойственных здоровым клеткам белков (например, α-фетопротеина) и других веществ, называемых онкомаркерами (позволяют обнаружить рецидив, или метастазы опухоли на 3,5 месяца раньше появления клиники). α-фетопротеин (АФП) синтезируется в норме в антенатальном периоде гепатоцитами плода (от лат. fetus - плод), но почти не образуется постнатальными, «зрелыми» гепатоцитами. · изменение способа ресинтеза АТФ заключается в увеличении доли АТФ, образуемой в ходе гликолиза (анаэробного и аэробного) и уменьшения, соответственно, доли АТФ, ресинтезируемой в процессе тканевого дыхания (аэробного окисления). В нормальных клетках и тканях в анаэробных условиях усиливается гликолиз. В присутствии кислорода он ингибируется (положительный эффект Пастера). Напротив, в опухолевых клетках интенсивный анаэробный гликолиз при смене анаэробных условий на аэробные не снижается, а сохраняется (отрицательный эффект Пастера). Усиление гликолиза в опухолевых клетках обусловливает их высокую выживаемость в условиях гипоксии. Преобладание гликолиза приводит к повышению концентрации молочной кислоты в клетках опухоли, характерен ацидоз, приводящий к нарушению жизнедеятельности самой клетки (зона некроза расположена обычно в центре опухоли). · феномен субстратных «ловушек» заключается в усиленном захвате и использовании субстратов для энергообразования (глюкозы), для построения цитоплазмы (аминокислот - отсюда «ловушка азота»), мембран клеток (холестерина), для защиты от свободных радикалов и стабилизации мембран (например, антиоксиданта - токоферола). Эта особенность повышает выживаемость опухолевых клеток при контакте их с нормальными клетками в условиях инвазивного роста и метаста-зирования. · снижение содержания в клетках опухолей цАМФ, оказывающего, как правило, тормозное влияние на их деление иувеличение цГМФ, стимулирующего пролиферацию клеток. 4. Физико-химический атипизмпроявляется увеличением содержания в опухолевых клетках воды, ионов калия и уменьшением в них кальция и магния. · увеличение содержания воды облегчает диффузию субстратов метаболизма внутрь клеток и его продуктов наружу. · снижение содержания Са2+ уменьшает межклеточную адгезию, а это в свою очередь облегчает «отшнуровывание» клеток от ткани опухоли и движение их в окружающие нормальные ткани при инвазивном росте. · увеличение содержания К+ препятствует в определенной мере развитию внутриклеточного ацидоза в связи с усилением гликолиза и накоплением молочной кислоты. · повышается величина отрицательного заряда поверхности опухолевых клеток, что способствует увеличению их взаимоотталкивания и проникновению по межклеточным щелям в нормальные ткани. Увеличение отрицательного заряда поверхности клеток происходит вследствие накопления на ней анионов нейраминовой кислоты. · повышается электропроводность и снижается вязкость клеточных коллоидов. · опухолевые клетки излучают в большом количестве митогенетические лучи Гурвича (ультрафиолетовые лучи с длиной волны 190-325 нм, способные стимулировать деление соседних клеток). 5. Функциональный атипизм проявляется нарушением функций клеток: · снижение секреции желудочного сока при раке желудка, образования желчи при раке печени и т.д. · неадекватное, нецелесообразное усиление функций, например повышение синтеза инсулина инсулиномой - опухолью из клеток островков Лангерганса поджелудочной железы вызывает гипогликемическое состояние, а в ряде случаев - гипогликемическую кому. · «извращение» функций, например синтез опухолевыми клетками при раке молочной железы гормона щитовидной железы кальцитонина; синтез клетками при раке легких некоторых гормонов передней доли гипофиза - АДГ, АКТГ и др. 6. Антигенный атипизм состоит в разнонаправленных изменениях антигенного состава опухолевых клеток (антигенном упрощении или появлении новых антигенов). · антигенное упрощение - утрата опухолевыми клетками антигенов, имеющихся в исходных нормальных клетках (например, утрата раковыми гепатоцитами органоспецифического печеночного антигена, h-антигена). · появление новых антигенов, отсутствовавших в нормальных (например, эмбрионального антигена α-фетопротеина в раковых гепатоцитах). Утрата клетками новообразований органоспецифического антигена и появление в них эмбриональных антигенов (к которым не образуются антитела, так как они воспринимаются иммунной системой как свои) способствуют антигенной «маскировке» опухолевых клеток и «неузнаваемости» их иммунной системой. 7. Морфологический атипизм делят на тканевый и клеточный. · Тканевый атипизм заключается в нарушении нормального соотношения тканевых структур. · Клеточный атипизм проявляется полиморфизмом - разной формой и размерами клеток (клеточный полиморфизм) и ядер (ядерный полиморфизм); увеличением ядерно-цитоплазматического отношения; гиперхромией ядер; изменением числа, формы и размеров хромосом (хромосомные аберрации); увеличением количества свободнолежащих в цитоплазме рибосом, участвующих в синтезе белков, увеличением размеров и числа ядрышек в ядрах, увеличением числа митоза, появлением различных по величине и форме митохондрий. 8. Атипизм «взаимодействия» клеток опухоли с организмом. 1) Опухоль – «ловушка» питательных веществ, таких как глюкоза, азот, витамины. Характерно развитие гипогликемии, анемии. 2) Изменение иммунного надзора (см. ниже). 3) Опухоль - источник биологически активных веществ: ростовые и ангиогенные факторы, эктопические гормоны (АКТГ при раке легкого), гиперпродукция или угнетение синтеза гормонов при опухолях эндокринных желез. 4) Паранеопластический синдром – проявление генерализованного воздействия опухоли на организм. Его формы разнообразны: состояние иммунодепрессии, гиперкоагуляция, сердечно-сосудистая недостаточность, мышечная дистрофия, пониженная толерантность к глюкозе, острая гипогликемия при опухолях больших размеров и др. Одним из проявлений паранеопластического синдрома являетсяраковая кахексия, которая возникает в периоде, близком к терминальному. Она характеризуется потерей массы тела в основном из-за усиленного распада белков скелетных мышц (частично миокарда), а также истощения жировых депо. В развитие раковой кахексии вносят вклад ряд явлений, развивающихся в организме опухоленосителя: · нарушение нервно-эндокринной регуляции обмена веществ; · усиление образования АТФ за счет гликолиза, что повышает расход субстратов энергообразования; · ингибирование липопротеинлипазы, катализирующей накопление липидов в организме; · снижение синтеза РНК, обеспечивающих синтез белков и дифференцировку адипоцитов; · образование фактора некроза опухолей, он же - кахектин - цитотоксический полипептидный гормон, известный также как TNF (tumor necrosis factor — фактор некроза опухолей). Он секретируется макрофагами и опосредует, воспалительные реакции. Практически все клетки организма обладают рецепторами к этому гормону, эффекты которого поэтому могут быть весьма многообразными: шоковое состояние, падение артериального давления, расстройства липидного и углеводного обмена, метаболический ацидоз, активация нейтрофилов вплоть до гибели организма, состояния анорексии и истощения организма. · снижение синтеза каталазы накопление избытка продуктов свободно-радикального и перекисного окисления; · сопутствующие опухоли осложнения: боль, кровотечение, нарушение функций гастроинтестинальной системы; феномен улавливания опухолью субстратов из крови. Кахексия может наблюдаться не только при злокачественных, но и при некоторых доброкачественных опухолях при их определенной локализации: в желудочно-кишечном тракте (вследствие развития непроходимости или резкого нарушения секреторной, моторной и всасывательной функций); в головном мозге, в области трофических центров (вследствие нарушения нервно-гормональной регуляции обмена веществ и энергии). |
