итог физиология. ИТОГ физа. 2 блок Гипоксия типовой патологический процесс, характеризующийся недостаточностью биологического окисления, причина которого заключается в неадекватности снабжения тканей кислородом или нарушении его использования тканями. Гипоксия
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
2 блок Гипоксия - типовой патологический процесс, характеризующийся недостаточностью биологического окисления, причина которого заключается в неадекватности снабжения тканей кислородом или нарушении его использования тканями. Гипоксия - это типовой патологический процесс, при котором уменьшается аэробный метаболизм вследствие снижения парциального давления кислорода в митохондриях, т. е. в клетке уменьшается количество макроэргических соединений и накапливаются продукты анаэробного обмена (Нанн,1969). Гипоксия - состояние, наблюдающееся в организме при неадекватном снабжении тканей и органов кислорода или при нарушении утилизации в них кислорода в процессе биологического окисления (Чарный А.М.,1961) Гипоксия (кислородная недостаточность) - это несоответствие между метаболическим запросом и его энергетическим обеспечением, которое сопровождается временным выходом каких-либо показателей кислородного гомеостаза из пределов колебаний, очерченных границами физиологической зоны (Березовский В.А.,1978). Гипоксемия - недостаточное насыщение крови кислородом. Гипоксия – типовой патологический процесс, характеризующийся недостаточностью биологического окисления, причина которого заключается в неадекватности снабжения тканей кислородом или нарушении его использования тканями. · Гипоксемия – недостаточное насыщение крови кислородом. · Асфиксия– состояние гипоксии, сочетающееся с повышением напряжения углекислого газа в крови и тканях. · Дискапния – изменение содержания в крови углекислого газа · Гиперкапния – увеличение концентрации в крови углекислого газа · Гипокапния – снижение концентрации в крови углекислого газа · Артерио-венозная разница по кислороду– количество О2, использованное тканями; представляет разность между напряжением О2 в артериальной и венозной крови (в норме около 60 мм рт. ст.). · Кислородная емкость крови– количество кислорода, которое способно связать 100 мл крови. · Кривая диссоциации оксигемоглобина- зависимость насыщения гемоглобина кислородом (сатурации; измеряется процентным отношением оксигемоглобина к общему количеству гемоглобина) от напряжения кислорода в крови. · Напряжение газа в крови (РО2, РСО2)– давление газа в воде или тканях организма (чаще в крови). · Насыщение крови кислородом (содержание в крови кислорода, об.%)– содержание кислорода в единице объема крови с учетом физически растворенного О2 и связанного с гемоглобином О2. · Парциальное давление газа (РаО2, РаСО2) – давление газа в смеси газов (воздушная смесь), соответствующее процентному содержанию газа в смеси. · Сатурация гемоглобина (кислородное насыщение гемоглобина, SО2, %)– процент оксигемоглобина от общего содержания гемоглобина. · Физиологическая (перегрузочная) гипоксия– гипоксия вследствие физичских нагрузок, в особенности, тяжелых, обусловлена появлением кислородного долга. · Экзогенный тип гипоксии (гипоксичекая гипоксия)– гипоксия вследствие снижения парциального давления кислорода во вдыхаемом воздухе. Асфиксия (в переводе с греч. – «без пульса») - состояние гипоксии, сочетающееся с повышением напряжения углекислого газа в крови и тканях. Участники биоокисления: субстрат (прежде всего, глюкоза и жирные кислоты), кислород катализатор-фермент (белковая часть и безбелковая часть - витамины). В результате вырабатывается энергия. Энергия макроэргических связей АТФ идет на 3 основных процесса: Работу насосов (натрий-калиевого, кальциевого и других активных транспортов) Синтетические процессы в клетке (прежде всего, белка и других органических веществ) Сократительную деятельность клеток и ее составляющих (цитоскелет), конечно, не только мышечных. Так лейкоциты осуществляют таксис, фагоцитоз. Энергия, рассеивающаяся в виде тепла, создает оптимум (37° С) для действия ферментов и для других белков (гемоглобина, рецепторов). Основные процессы, обеспечивающие биоокисление: Диффузия газов в легких. Транспорт газов кровью. оксигемоглобин (HbO2), бикарбонаты Na и K, растворенная форма О2 и СО2, карбгемоглобин (HbСO2), карбоксигемоглобин (HbCO), его сродство к СО2 в 300 раз больше, чем к O2, метгемоглобин (Fe2+→Fe3+) содержит железо с валентностью III, образующееся под действием нитратов, нитритов, анилина, окиси азота, бензола, сульграниламидов. 3. Диффузия газов в тканях. Кислородная емкость крови - количество O2, которое способно связать 100 мл крови. Относительную оценку кислородной емкости крови дает оксигемометрия, основанная на пропускании света определенной длины волны, и, показывающая процентное содержание в крови оксигемоглобина, относительно 100% насыщения (емкости) крови. Парциальное давление газа (PaO2, PaCO2)отражает давление газа в смеси газов (воздушная смесь), соответствующее его процентному содержанию в ней. Напряжение газа в крови (PO2, PCO2)отражает давление газа в воде или в тканях организма (чаще в крови). Насыщение крови кислородом или содержание в крови кислорода (об.%) – содержание кислорода в единице объема крови с учетом физически растворенного О2 и связанного с гемоглобином О2. Газовый состав крови
Артерио-венозная разница по кислороду–количество О2, использованное тканями; представляет собой разность между напряжением О2 в артериальной и венозной крови (норме около 60 мм рт.ст.). Сатурация гемоглобина или кислородное насыщение гемоглобина (SО2, %)–процент оксигемоглобина от общего содержания гемоглобина. SО2=[HbO2]/ ([Hb] + [HbO2])*100 % Кривая диссоциации оксигемоглобина. Значение ее сдвига Связывание кислорода с гемоглобином и высвобождение его зависят от парциального давления кислорода. 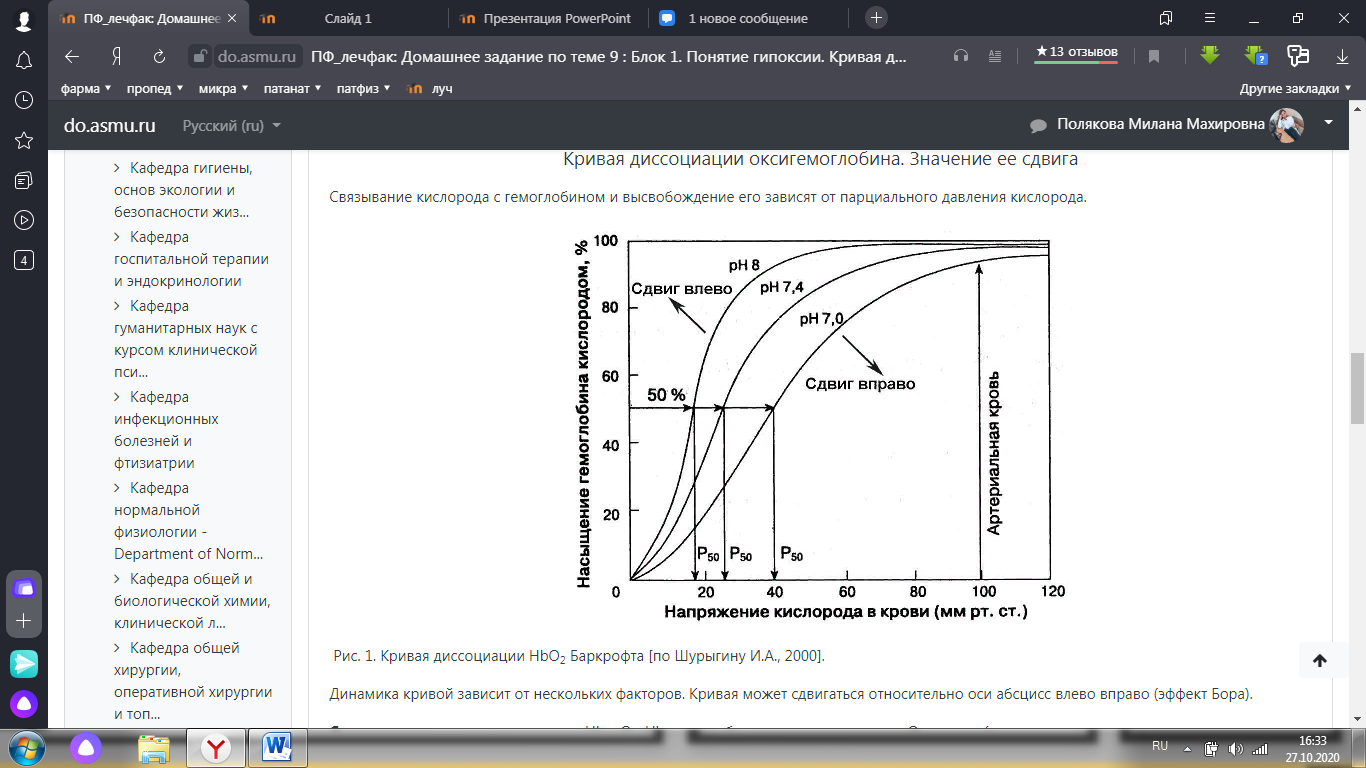 Рис. 1. Кривая диссоциации HbO2 Баркрофта [по Шурыгину И.А., 2000]. Динамика кривой зависит от нескольких факторов. Кривая может сдвигаться относительно оси абсцисс влево вправо (эффект Бора). Сдвиг влево - увеличение сродства Hb к O2, Hb лучше образуется, но хуже отдает O2 в ткани (алкалоз, снижение температуры тела или замерзание). Сдвиг вправо - снижение сродства Hb к O2, Hb хуже образуется, но лучше отдает O2 в ткани (ацидоз, повышение температуры тела или лихорадка). Патогенетическая классификация гипоксий (по И.Р. Петрову)I. Экзогенный тип гипоксии или гипоксическая гипоксия - гипоксия вследствие снижения парциального давления кислорода во вдыхаемом воздухе (характерно снижение артерио-венозной разницы по кислороду). 1. Гипобарическая форма возникает при снижении общего барометрического давления (подъем на высоту более 1000 м над уровнем моря). 2. Нормобарическая форма возникает при избирательном снижении содержания кислорода при нормальном общем давлении (нахождение в замкнутых или плохо проветриваемых пространствах). 3. Гипербарическая форма возникает при избирательном снижении содержания кислорода при повышенном барометрическом давлении (нахождение в замкнутых, плохо проветриваемых пространствах на глубине). 4. Гипероксическая форма возникает вследствие патогенно высокого парциального давления кислорода во вдыхаемой смеси газов, которое обуславливают рост содержания кислорода во вдыхаемой газовой смеси или увеличение давления смеси газов. Гипероксическая гипоксия - это следствие токсичного действия кислорода при его аномально высоком парциальном давлении в альвеолярной газовой смеси и напряжении в артериальной крови и в тканях. Под токсичным действием кислорода понимают повреждения тканей клеток и интерстициальных тканевых структур, обусловленные свободнорадикальным окислением. Токсический эффект кислорода может клинически проявить себя уже при возрастании парциального давления во вдыхаемой газовой смеси до 200 мм рт.ст., если больной непрерывно дышит такой газовой смесью в течение нескольких часов. II. Гипоксия при патологических процессах, нарушающих снабжение тканей кислородом при нормальном содержании его в окружающей среде или утилизации кислорода из крови при нормальном ее насыщении О2. 1. Дыхательный (респираторный) тип гипоксии возникает при недостаточном транспорте кислорода из нормального атмосферного воздуха в плазму протекающей через легкие крови вследствие нарушения системы внешнего дыхания (характерна артериальная гипоксемия). Механизмы развития: Альвеолярная гиповентиляция. Нарушение общей легочной перфузии. Локальные нарушения вентиляционно-перфузионных отношений. Избыточное шунтирование венозной крови в легких. Затруднение диффузии кислорода через альвео-капиллярную мембрану. 2. Сердечно-сосудистый (циркуляторный) тип гипоксии возникает в результате нарушений гемодинамики, приводящих к недостаточному для нормальной жизнедеятельности снабжению органов и тканей кислородом при нормальном насыщении им артериальной крови (характерна венозная гипоксемия). Ишемическая – следствие ишемии (уменьшение или прекращение притока артериальной крови) органа или ткани (например, коронарная недостаточность, ишемический мозговой инсульт и т.д.). Застойная – следствие венозной гиперемии (нарушение оттока венозной крови от органа или части тела) органа или ткани (например, сердечная недостаточность, варикозная болезнь и пр.). Главным гемодинамическим показателем, характеризующим циркуляторную гипоксию, является уменьшение по сравнению с должными величинами скорости кровотока (Q), т. е. количества крови, протекающей через суммарный просвет микрососудов в единицу времени. Q зависит от нескольких факторов: объем крови, циркулирующий в участке ткани, органе или организме в целом. градиент давления между артериальным отделом русла и венозным. суммарный тонус сосудов данного бассейна. реологические свойства крови. Таким образом, развитие данного типа гипоксии может быть обусловлено любым из перечисленных гемодинамических факторов и изменениями текучести крови. Часто имеет место сочетание двух или более факторов. 3. Кровяной (гемический) тип гипоксии возникает в результате неспособности крови при наличии нормального напряжения кислорода в легочных капиллярах связывать, переносить в ткани и отдавать нормальное количество кислорода, т. е. патогенетической основой данного типа гипоксии является уменьшение реальной кислородной емкости крови (характерна артериальная гипоксемия). Причины развития: Уменьшение количества гемоглобина. Качественные изменения гемоглобина наследственного и приобретенного генеза. Нарушения физико-химических условий, необходимых для нормального поглощения кислорода гемоглобином из плазмы крови легочных капилляров и отдачи кислорода в тканевых капиллярах. 4. Тканевой (гистотоксический) тип гипоксии возникает в результате нарушения процессов биологического окисления в клетках при нормальном функционировании всех звеньев системы транспорта кислорода к месту его утилизации (характерно снижение артерио-венозной разницы по кислороду). Утилизация кислорода тканями может затрудняться в результате: a) Действие различных ингибиторов ферментов биологического окисления: 1-й тип ингибирования - цианиды (соединение с Fe3+, что препятствует восстановлению железа дыхательных ферментов и переноса кислорода на цитохром). 2-й тип ингибирования - обратимое или необратимое связывание с функциональными группами белковой части фермента, играющих важную роль в их каталитической активности (тяжелые металлы, алкилирующие агенты и др.). 3-й тип ингибирования - конкурентное торможение - взаимодействие ферментов с веществами, имеющими структурное сходство с естественными субстратами окисления (многие дикарбоновые кислоты). b) Изменение физико-химических условий среды существенно сказывается на активности ферментов: рН, температура, концентрация некоторых электролитов и многое другое. c) Нарушение синтеза ферментов. d) Дезорганизация мембранных структур клетки: перекисное окисление липидов (ПОЛ); активация фосфолипаз; осмотическое растяжение мембран; связывание белков поверхностью мембран и изменения конформации белков; действие избытка ионов кальция. 5. Смешанный тип гипоксии. Один и тот же фактор вызывает сочетание двух или более типов гипоксии. Первично возникает один тип гипоксии, а затем по мере развития болезни присоединяются другие типы. III. Физиологическая (перегрузочная) гипоксия – возникает при физических нагрузках, особенно тяжелых, обусловлена появлением кислородного долга (характерны венозная гипоксемия, гиперкапния и увеличение артерио-венозной разницы по кислороду). Газовый состав крови при различных типах гипоксий
Другие классификации гипоксии По распространенности (общая и местная). По скорости развития (молниеносная (асфиксия, отравление цианидами), острая, подострая, хроническая). По степени тяжести (легкая, умеренная, тяжелая, критическая). Последовательность событий в клетке после прекращения доступа кислорода описывается следующим образом: 0-5 мин. аноксии → снижение уровня АТФ в клетке в 2-4 раза, несмотря на активацию анаэробного гликолиза; 5-15 мин. → появление Са+2 в цитоплазме клетки. Активация гидролитических ферментов, в том числе фермента фосфолипазы А2 митохондрий. При реоксигенации содержание Са+2 в митохондриях повышается, т. к. они еще не повреждены. 15-30 мин. → гидролиз митохондриальных фосфолипидов фосфолипазой A2 и нарушение барьерных свойств мембраны митохондрий. Реоксигенация ткани на этой стадии приводит к активному набуханию митохондрий. Окислительное фосфорилирование разобщено, способность митохондрий накапливать ионы кальция снижена. 30-60 мин. → частичное восстановление функций митохондрий, временное повышение дыхательного контроля, способности накапливать кальций (механизм компенсаторных процессов, приводящих к временному улучшению функций митохондрий, неизвестен); 90-120 мин. → необратимое повреждение митохондрий и гибель клеток. Расстройства обмена веществ при гипоксии 1. Содержание АТФ и креатинфосфата при гипоксии любого типа прогрессирующе снижается вследствие подавления процессов биологического окисления (особенно - аэробных) и сопряжения их с фосфорилированием. 2. Содержание АДФ, АМФ и креатина нарастает вследствие нарушения их фосфорилирования. 3. Концентрация неорганического фосфата в тканях увеличивается. Причины: Повышенный гидролиз АТФ, АДФ, АМФ и креатинфосфата. Подавление реакций окислительного фосфорилирования. 4. Процессы тканевого дыхания в клетках подавлены вследствие дефицита кислорода, недостатка субстратов обмена веществ, подавление активности ферментов тканевого дыхания. 5. Гликолиз на начальном этапе гипоксии активируется. Причины: Дефицит АТФ и снижение его ингибирующего влияния на ключевые ферменты гликолиза. Активация гликолитических ферментов продуктами гидролиза АТФ: АДФ и АМФ. Проявления: Снижение содержания гликогена и глюкозы в клетках. Увеличение внутриклеточного содержания молочной и пировиноградной кислот. Последнее является также результатом торможения их окисления в дыхательной цепи и ресинтеза из них гликогена, требующего энергии АТФ. 6. Содержание Н+ в клетках и биологических жидкостях прогрессирующе нарастает и развивается ацидоз вследствие торможения окисления субстратов, особенно - лактата и пирувата, КТ и в меньшей мере - жирных кислот и аминокислот. 7. Биосинтез нуклеиновых кислот и белков подавлен вследствие дефицита энергии, необходимой для этих процессов. 8. Параллельно активируется протеолиз, обусловленный активацией в условиях ацидоза протеаз, а также неферментного гидролиза белков. 9. Азотистый баланс становится отрицательным. Это сочетается с повышением уровня остаточного азота в плазме крови и аммиака в тканях. Причины: активация реакций протеолиза и торможение процессов протеосинтеза. 10. Жировой обмен характеризуется: Активацией липолиза вследствие повышения активности липаз и ацидоза. Торможением ресинтеза липидов. Причина: дефицит макроэргических соединений. Накоплением в результате вышеуказанных процессов избытка КТ (ацетоуксусной, β-оксимасляной кислот, ацетона) и жирных кислот в плазме крови, межклеточной жидкости, клетках. При этом ВЖК оказывают разобщающее влияние на процессы окисления и фосфорилирования, что усугубляет дефицит АТФ. 11. Обмен электролитов и жидкости в тканях существенно нарушен. Причины: Дефицит АТФ, энергия которой необходима для АТФаз: Nа+,К+-АТФазы, Са2+-зависимой АТФазы и др. Повреждение мембран и их ионных каналов, обеспечивающих энерго- и электрозависимый перенос, а также пассивный транспорт ионов. Изменение содержания в организме гормонов, регулирующих обмен ионов: минералокортикоидов, кальцитонина и др. Проявления: Нарушение соотношения ионов в клетках: Трансмембранного (обычно в условиях гипоксии клетки теряют К+, в цитозоле накапливаются Na+ и Са2+, в митохондриях - Са2+). Между отдельными ионами (например, в цитозоле уменьшается соотношение K+/Na+, К+/Са2+). Увеличение в крови содержания Na+, C1-, отдельных микроэлементов. Накопление избытка жидкости в клетках (набухание клеток), причины: Увеличение осмотического давления в цитоплазме клеток в связи с накоплением в них Na+, Са2+ и некоторых других ионов, а также в результате гидролиза крупных молекул органических веществ (например, гликогена, белка). Повышение онкотического давления в клетках в результате распада полипептидов, ЛП и других белоксодержащих молекул, обладающих гидрофильными свойствами. При гипоксии нарушения функций органов и тканей выражены в разной мере, Это определяется различной резистентностью органов к гипоксии, а также скоростью её развития, степенью и длительностью её воздействия на организм. Резистентность органов к гипоксииНаибольшая устойчивость к гипоксии у костей, хрящей, сухожилий, связок, Даже в условиях тяжёлой гипоксии в них не обнаруживается значительных морфологических отклонений. В скелетной мускулатуре изменения структуры миофибрилл, а также их сократимости выявляются через 100-120 мин, а в миокарде - уже через 15-20 мин. В почках и печени морфологические отклонения и расстройства функций обнаруживаются обычно через 20-30 мин после начала гипоксии. Наименьшей резистентностью к гипоксии обладает ткань нервной системы, при этом различные её структуры по-разному устойчивы к гипоксии одинаковой степени и длительности. Резистентность нервных клеток уменьшается в следующем порядке: периферические нервные узлы → спинной мозг → продолговатый мозг → гиппокамп → мозжечок → кора больших полушарий. Прекращение оксигенации коры мозга вызывает значительные структурные и функциональные изменения в ней уже через 2-3 мин, в продолговатом мозге через 8-12 мин, а в ганглиях вегетативной нервной системы через 50-60 мин. Отсюда следует, что последствия гипоксии для организма в целом определяются степенью повреждения нейронов коры больших полушарий и временем их развития. Срочная адаптация к гипоксии (или 1-ая стадия долговременной адаптации) 1. Приспособительные реакции системы внешнего дыхания: увеличение альвеолярной вентиляции за счет углубления и учащения дыхания и мобилизации резервных альвеол (вызывает развитие дыхательного алкалоза, кривая диссоциации HbО2 сдвигается влево и оксигенация крови улучшается); увеличение легочного кровотока и повышение перфузионного давления в капиллярах легких; возрастание проницаемости альвео-капиллярных мембран для газов. 2. Приспособительные реакции в системе кровообращения: развитие тахикардии, увеличение ударного и минутного объемов сердца; увеличение массы циркулирующей крови за счет выброса из кровяного депо; увеличение системного артериального давления и скорости кровотока; расширение сосудов (под влиянием СО2, рН, аденозина). 3. Приспособительные реакции системы крови: усиление диссоциации оксиHb за счет ацидоза; повышение кислородной емкости крови за счет усиления вымывания эритроцитов из костного мозга; 4. Тканевые приспособительные реакции: ограничение функциональной активности органов и тканей, непосредственно не участвующих в обеспечении транспорта кислорода; увеличение сопряжения окисления и фосфорилирования и активности ферментов дыхательной цепи; усиление анаэробного синтеза АТФ за счет активации гликолиза (накапливается лактат, рН смещается в кислую сторону, а кривая Баркрофта – вправо, HbО2 легче диссоциирует, отдавая кислород). Стадия срочной адаптации может развиваться по двум направлениям: 1. Если действие гипоксического фактора прекращается, то адаптация не развивается и функциональная система ответственная за адаптацию к гипоксии не закрепляется. 2. Если действие гипоксического фактора продолжается или периодически повторяется в течение достаточно длительного времени, то организм переходит во 2-ю стадию долгосрочной адаптации. 2-я стадия - переходная Ей характерно постепенное снижение активности систем, обеспечивающих приспособление организма к гипоксии, и ослабление стрессовых реакций на повторное действие гипоксического фактора. 3-я стадия - стадия устойчивой долговременной адаптации Она характеризуется высокой резистентностью организма к гипоксическому фактору. увеличение силы дыхательных мышц и дыхательной поверхности легких; гипертрофия миокарда; активация эритропоэза за счет усиления образования эритропоэтинов в почках и, возможно, других органах; увеличение массы митохондрий. 4-я стадия 1. Если действие гипоксического фактора прекращается, то постепенно происходит дезадаптация организма. 2. Если действие гипоксического фактора нарастает, то это может привести к истощению функциональной системы и произойдет срыв адаптации и полное истощение организма. Экстремальные состояния - состояния, сопровождающиеся грубыми расстройствами метаболизма и жизненно важных функций и представляющие непосредственную опасность для жизни. Экстремальные состояния, как правило, связаны с действием сверхсильных патогенных факторов. Виды экстремальных состояний коллапс обморок шок кома терминальные состояния Понятия обморока и коллапса. Коллапс – резкое падение АД, развивающееся вследствие острой сосудистой недостаточности, дефицита ОЦК или преходящих нарушений сердечной деятельности. Коллапс развивается обычно как осложнение тяжелых соматических заболеваний и сопровождается ухудшением кровоснабжения жизненно важных органов, прежде всего, головного мозга. Коллапс проявляется резкой слабостью, бледностью, похолоданием конечностей, расстройством сознания (потемнение в глазах, «мушки» перед глазами), однако, в отличие от обморока, сознание при коллапсе сохранено. Общепринятая классификация форм коллапса отсутствует. Чаще всего коллапс классифицируют по этиологии: инфекционный, токсический, геморрагический, гипоксический, ортостатический и др. В зависимости от преобладающего механизма развития гипотензии целесообразно выделять 3 вида коллапса (патогенетическая классификация): 1. Вазодилятационный коллапс – связан с расширением сосудов вследствие дефицита вазоконстрикции. Причины: заболевания эндокринной и нервной систем, острые инфекционные заболевания (инфекционный коллапс при брюшном и сыпном тифе, пневмонии и др. инфекциях), интоксикации (токсический коллапс), передозировка гипотензивных препаратов 2. Гиповолемический коллапс – возникает при резком уменьшении объема циркулирующей крови (гиповолемии). Причины: острая кровопотеря либо дегидратация организма (диарея, неукротимая рвота, передозировка мочегонных средств). 3. Кардиогенный коллапс – развивается при уменьшении сердечного выброса (синдром малого сердечного выброса). Причины: острый инфаркт миокарда, нарушения сердечного ритма со значительным увеличением или снижением ЧСС (тахи- и брадиаритмии) Зачастую коллапс и обморок имеют общие причины (ортостатический, кардиогенный коллапс и обморок и др.), отличаясь друг от друга только степенью угнетения сознания, или коллапс предшествует развитию обморока. Обморок (синкопе, синкопальное состояние) – кратковременная потеря сознания, обусловленная недостаточностью церебрального биоокисления и гипоксией мозга. Обморок может наступать внезапно или предваряться непродолжительным (от нескольких секунд до 2-3 минут) предобморочным состоянием, сопровождающимся такими симптомами, как головокружение; слабость, обильное потоотделение, дискомфорт в эпигастральной области, тошнота, помутненное зрение, бледность, парестезии. Пациент может испытывать чувство приближающейся потери сознания. Продолжительность самого обморока также может составлять от нескольких секунд до нескольких минут. Во время отсутствия сознания артериальное давление у пострадавшего снижено, сердечные тоны прослушиваются с трудом. Пульс может быть крайне редким или, напротив, частым, слабого наполнения и напряжения. Мышцы резко расслаблены, неврологические рефлексы резко снижены, зрачки расширены и наблюдается снижение их реакции на свет. Опасность обморока заключается в вероятности получения травм при падении, а также возможности развития обтурационной асфиксии вследствие западения языка. Черепно-мозговая травма и асфиксия могут стать причиной смерти пострадавшего. От других видов потери сознания обморок отличается быстротой возникновения, непродолжительностью, утратой постурального тонуса (расслабление мышц, противодействующих силе тяжести и ответственных за поддержание позы), спонтанным восстановлением сознания без последствий. Дифференцировать обморок следует с эпилептическим припадком, инсультом, тромбоэмболией легочной артерии, коматозными состояниями. Классификация обморока, как и коллапса, недостаточно разработана. Можно выделить 5 типов обморока, в зависимости от причин: 1. ортостатические 2. нейрорефлекторные 3. кардиогенные 4. цереброваскулярные 5. метаболические 1. Ортостатический обморок возникает при переходе из горизонтального положения в вертикальное, обусловлен нарушением рефлекторной вегетативной регуляции АД. В случае, если развивающаяся артериальная гипотензия не приводит к потере сознания, говорят об ортостатическом коллапсе. Причины: · Нарушения регуляции сосудистого тонуса (болезнь Паркинсона, диабетическая нейропатия, амилоидная нейропатия) · Демпинг-синдром после резекции желудка (постпрандиальный или энтерогенный обморок). · Гиповолемия при болезни Аддисона, кровотечениях, диарее. · Прием лекарственных препаратов или алкоголя. Механизм: перераспределение крови и недостаточная периферическая вазоконстрикция из-за нарушений афферентного (барорецептооы), центрального, либо эфферентного звеньев регуляции сосудистого тонуса. В норме переход человека из горизонтального положения в вертикальное сопровождается незначительным и кратковременным (несколько секунд) снижением систолического АД и повышением диастолического АД с последующей быстрой его нормализацией; также незначительно ускоряется пульс. Начальное снижение АД обусловлено перемещением крови под влиянием силы тяжести к нижним конечностям, что регистрируется барорецепторами каротидного синуса и начинается периферическая вазоконстрикция, благодаря чему кровоток в мозге сохраняется на необходимом уровне. При ортостатическом коллапсе и обмороке этот механизм недостаточно эффективен. 2. Нейрорефлекторные обмороки обусловлены избыточной рефлекторной активацией парасимпатического отдела вегетативной нервной системы Виды нейрорефлекторных обмороков: · Вазовагальный – возникает при сильном эмоциональном стрессе (страх, боль, инструментальное вмешательство, контакт с кровью) или ортостатическом стрессе (длительное стояние). Вазовагальный обморок, вызванный длительным стоянием, не следует путать с ортостатическим обмороком, который возникает в момент перехода в ортостаз. Разница заключается в том, что в первом случае имеет место истощение вазоконстрикторных влияний (на фоне усиления влияния ПНС), а во втором – первичная их недостаточность. · Ситуационный, возникает при кашле, чихании, мочеиспускании, раздражении рецепторов ЖКТ (глотание, дефекация, боль в животе), а также при воздействии ряда других причин (смех, игра на духовых инструментах, подъём тяжестей) · Синдром каротидного синуса – активация ПНС при раздражении синокаротидной зоны (поворот головы, наклон головы кзади, сдавление шеи узким воротничком) 3. Кардиогенный обморок. Так же, как и коллапс, развивается при уменьшении сердечного выброса. Основные причины: · Нарушения сердечного ритма: А) Брадиаритмии в результате дисфункции синусового узла, АВ-блокады II-III степени, дисфункции электрокардиостимулятора (установленного по поводу двух предыдущих причин), передозировки препаратов, урежающих сердечный ритм (β-адреноблокаторы). Б) Тахиаритмии – пароксизмальные тахикардии: наджелудочковые (в т.ч. при синдроме WPW) и желудочковые · Органические заболевания сердца: поражения клапанов сердца (аортальный стеноз); гипертрофическая кардиомиопатия, внутрисердечные образования (миксома предсердия и др.опухоли), врожденные аномалии венечных артерий 4. Цереброваскулярные обмороки. Возникают в основном у пожилых людей с атеросклеротическим поражением брахиоцефальных артерий. Механизм развития связан с транзиторной ишемией головного мозга в бассейне кровоснабжения стенозированной артерии. Одним из вариантов является синдром подключичного обкрадывания, развивающийся вследствие стеноза / окклюзии подключичной артерии до отхождения от нее позвоночной артерии; обмороки при этом возникают из-за частичной или полной инверсии кровотока в позвоночной и базилярной артерии (что приводит к «обкрадыванию» головного мозга). Провоцирующим фактором может быть напряженная работа мышц верхней конечности, при которой происходит усиление обкрадывания. 5. Метаболические обмороки. Причиной являются метаболические нарушения, приводящие к нарушению церебрального биоокисления. Примерами метаболических обмороков являются: · Гипоксемический обморок – обусловлен снижением напряжения О2 в крови при анемиях, дыхательной недостаточности · Голодный обморок – связан с субстратной гипоксией головного мозга в результате голодания · Обморок при гипервентиляции – связан с развитием гипокапнии, при которой развивается спазм мозговых сосудов и снижение мозгового кровотока Учитывая, что общепринятая классификация обмороков отсутствует, два последних типа обморока – цереброваскулярный и метаболический – в ряде руководств относят не к истинным обморокам, а к несинкопальным формам потери сознания.р Шок – стадийно протекающее острое состояние, возникающее вследствие воздействия сверхсильных стрессоров и характеризующееся нарушениями центральной гемодинамики, микроциркуляции и жизненно важных функций. Этиологическим фактором шока является любой сверхсильный раздражитель. Стадии шока1. Компенсированная (эректильная) – сопровождается эмоциональным и поведенческирм возбуждением, активацией органов и систем. 2. Декомпенсированная (торпидная) – угнетение психической, эмоциональной и поведенческой деятельности. 3. Терминальная. Общий патогенез шока· Первичное звено – активация симпато-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем, что обуславливает симптомы эректильной фазы (поведение, увеличение силы и частоты сердечных сокращений, дыхания, усиление энергообмена, активация глюконеогенеза). · Торможение (угнетение) ЦНС на начальном этапе охранительное, но при действии очень сильных раздражителей переходит в патологическое (запредельное), обуславливает торпидную фазу. · «Централизация кровообращения» - циркуляция крови по системе "сердце-мозг-сердце". Необходимо для сохранения кровотока в жизненно важных органах и поддержания системного АД. Развивается в результате активации симапато-адреналовой системы (вазоконстрикция сосудов a-органов [кожа, почки, органы брюшной полости], вазодилатация сосудов b-органов [сердце, мозг]). · Основное звено патогенеза - гиповолемия (и падение АД) вследствие снижения сердечного выброса и недостаточной вазоконстрикции (приводит к нарушению микроциркуляции). Гиповолемия – несоответствие между объемом сосудистого русла и объемом циркулирующей крови, что проявляется падением АД). · Вазоконстрикция сосудов a-органов приводит к ишемическому стазу, вследствие чего развивается гипоксия, ацидоз, сладж. Образующиеся при этом вазоактивные продукты метаболизма вызывают расслабление прекапиллярных сфинктеров, в результате чего вазоконстрикция сменяется неадекватной вазодилатацией и падением АД. Ввиду повреждения сосудистой стенки и массивного поступления в кровоток прокоагулянтов развивается ДВС-синдром. Перечисленные механизмы усугубляют нарушение перфузии a-органов и лежат в основе развития синдрома полиорганной недостаточности (нарушение функций почек, легких, печени). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
