41-80 вопросы. 41. Механизмы и пути передачи инфекции
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
70. Иммунные сыворотки, препараты иммуноглобулинов. Классификация, получение, области применения. Иммунные сыворотки: иммунологические препараты на основе антител. 1. Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины. 2. Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша. 3. Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела. Иммунные сыворотки получают путем гипериммунизации животных (лошади) специфическим антигеном (анатоксином, бактериальными или вирусными культурами и их антигенами) с последующим, в период максимального антителообразования, выделением из крови иммунной сыворотки. Иммунные сыворотки, полученные от животных, называют гетерогенными, так как они содержат чужеродные для человека сывороточные белки. Для получения гомологичных нечужеродных иммунных сывороток используют сыворотки переболевших людей (коревая, оспенная сыворотки) или специально иммунизированных людей-доноров (противостолбнячная, противоботулиническая), содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакцинации или перенесенного заболевания. Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины. Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами. Иммунные сыворотки создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета. 71. Интерфероны. Природа, способы получения и область применения. Интерфероны – группа белков с противовирусным действием, вырабатываемых эукариотическими клетками в ответ на внедрение в них ряда биологических агентов – интерфероногенов. Представляет собой семейство белков-гликопротеидов с молекулярной массой от 15 до 70 кДа. В зависимости от того, какими клетками синтезируется интерферон, выделяют три типа: α, β и γ. Альфа-интерферон вырабатывается лейкоцитами, бета- фибробластами, гамма- вырабатывается активированными Т-лимфоцитами, макрофагами, естественными киллерами, т. е. иммунными клетками. Помимо противовирусного действия интерферон обладает противоопухолевой защитой, т к задерживает пролиферацию опухолевых клеток, а также иммуномодулирующей активностью, стимулируя фагоцитоз, естественные киллеры, регулируя антителообразование В-клетками, активируя экспрессию главного комплекса гистосовместимости. Механизм действия интерферона сложен. Интерферон непосредственно на вирус вне клетки не действует, а связывается со специальными рецепторами клеток и оказывает влияние на процесс репродукции вируса внутри клетки на стадии синтеза белков. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью про многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях( гепатиты, герпес, рассеянный склероз) Интерфероны обладают видоспецифичностью, т е интерферон человека менее эффективен для животных и наоборот. Получают интерферон двумя способами: а) путем инфицирования культуры лейкоцитов или лимфоцитов крови человека безопасным вирусом, в результате чего инфицированные клетки синтезируют интерферон, к-й затем выделяют и конструируют из него препараты интерферона. б) генно-инженерным способом – путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон. Обычно используют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в и ДНК генами интерферона. Рекомбинантный интерферон нашел широкое применение в медицине как профилактическое и лечебное средство при вирусных инфекциях и при иммунодефицитах. Интерфероногены - факторы, индуцирующие синтез интерферонов клетками позвоночных животных. Из природных факторов такими св-вами обладают РНК- и ДНК-геномные вирусы, некоторые виды бактерий, актиномицетов, риккетсий, хламидий, микоплазм, токсоплазмы, плазмодии, НК, липополисахариды бактерий, полисахариды грибов, природные полифенолы. Из синтетических веществ синтез интерферонов индуцируют полифосфаты, поликарбоксилаты, пропандиамин, основные красители. 72. Понятие о серопрофилактике и серотерапии инфекционных заболеваниях. Серопрофилактика (от лат. serum - сыворотка и профилактика), иммунизация людей и животных сыворотками, гамма-глобулинами для быстрого создания пассивного иммунитета после возможного заражения возбудителями инфекций. Серотерапия (serotherapy) [лат. serum — сыворотка и греч. therapeia — лечение] — метод лечения инфекционных болезней человека и животных сыворотками, полученными из крови искусственно иммунизированных организмов. Лечебный эффект основан на явлении пассивного иммунитета — обезвреживании микробов (токсинов) антителами (антитоксинами), содержащимися в сыворотках, которые получают путем гипериммунизации животных (гл. обр. лошадей). Для С. применяют также очищенные и концентрированные сыворотки — гамма-глобулины, гетерогенные (полученные из сывороток иммунизированных животных) и гомологичные (полученные из сывороток иммунизированных или переболевших людей). Иммунные сыворотки применяют при лечении дифтерии (преимущественно в начальной стадии болезни), ботулизма, при укусах ядовитых змей; гаммаглобулины — при лечении гриппа, сибирской язвы, столбняка, оспы, клещевого энцефалита, лептоспироза, стафилококковых инфекций (особенно вызванных антибиотикоустойчивыми формами микробов) и др. заболеваний. Для предупреждения осложнений С. (анафилактический шок, сывороточная болезнь) сыворотки и гетерогенные гамма-глобулины вводят по специальной методике с предварительной кожной пробой. В ветеринарной практике иммунные сыворотки, в том числе гамма-глобулины, применяют при лечении сибирской язвы, геморрагической септицемии крупного рогатого скота, овец и свиней, анаэробной дизентерии ягнят, рожи свиней и т. п. 73. Методы микроскопии. Световая микроскопия Схема иммерсионной микроскопии. Иммерсионная микроскопия используется с целью повышения разрешающей способности обычного светового микроскопа. Разрешающая способность - это минимальное расстояние между двумя точками, при котором они еще видны раздельно. Она прямо пропорциональна длине волны падающего света и обратно пропорциональна показателю преломления среды между объектом и объективом и синусу половины входного угла объектива. Чаще всего для иммерсионной микроскопии используют кедровое масло, которое имеет такой же коэффициент преломления, как стекло (1.51), поэтому при прохождении световых лучей через систему масло-объектив они не преломляются, и не происходит искажения изображения. 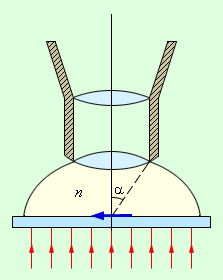 Темнопольная микроскопия основана на способности микроорганизмов сильно рассеивать свет. Для темнопольной микроскопи пользуются обычными объективами и специальными темнопольными парабалоид-конденсорами, центральная часть которых затемнена, так что прямые лучи от осветителя в объектив микроскопа не попадают. В объектив попадают только те лучи, которые отклоняются частицами препарата. Поэтому в темнопольном микроскопе микроорганизмы видны бесцветными на темном фоне. Метод темнопольной микроскопии используется для изучения живых бактерий и их подвижности. При помощи этого метода могут быть обнаружены мельчайшие микроорганизмы, размеры которых лежат за пределами разрешающей способности микроскопа. С помощью темнопольной микроскопии изучают нативные препараты типа "раздавленной" или "висячей капли". 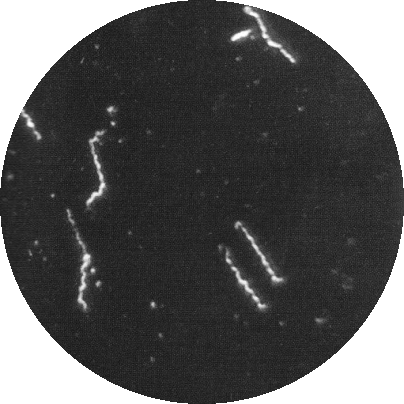 T.pallidum. Темнопольная микроско T.pallidum. Темнопольная микроскоФазово-контрастная микроскопия позволяет изучать живые и неокрашенные объекты за счет повышения их контрастности. При микроскопии неокрашенных микроорганизмов, отличающихся от окружающей среды только по показателю преломления, изменения интенсивности света (амплитуды) не происходит, а изменяется только фаза прошедших световых волн. Человеческий глаз этих изменений заметить не может, и наблюдаемые объекты выглядят малоконтрастными, прозрачными. Для изучения таких объектов используют фазово-контрастную микроскопию, основанную на преобразовании невидимых фазовых изменений световых волн в амплитудные, различимые глазом. Фазово-контрастное устройство может быть установлено на любом световом микроскопе. Оно состоит из: •набора объективов со специальными фазовыми пластинками; •коденсора с поворачивающимся диском. В нем установлены кольцевые диафрагмы, соответствующие фазовым пластинкам в каждом из объективов; •вспомогательного микроскопа. Фазово-контрастная микроскопия применяется также для изучения клеток культуры ткани, действия вирусов на клетки. В этих случаях часто применяют инвертированные микроскопы (с обратным расположением оптики). У таких микроскопов объективы расположены снизу, а конденсор - сверху. 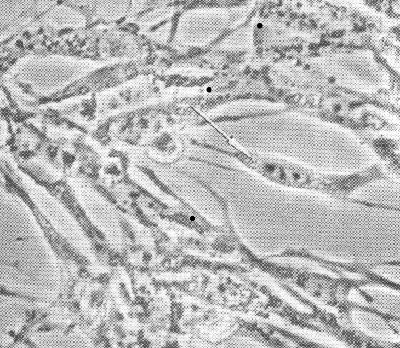 Цитопатическое действие вируса простого герпеса на клеточную культуру фибробластов эмбриона курицы. Фазовый контраст. Люминесцентная микроскопия основана на способности многих веществ биологического происхождения и красителей светиться под действием падающего на них света. Свечение объектов возникает в результате поглощения ими лучистой энергии. Свет люминесценции обладает большей длиной волны, чем поглощенный (правило Стокса). Поэтому люминесценцию выгодно возбуждать либо ультрафиолетовыми лучами, либо сине-фиолетвыми. Возникает люминесценция в цветовой гамме всего или большей части видимого спектра, что дает цветное изображение. Объект, не дающий явления люминесценции, окрашивают специальными красителями - флюорохромами. Люминесценция, свойственная самим микроорганизмам, называется первичной, а после обработки флюорохромами - наведенной или вторичной. 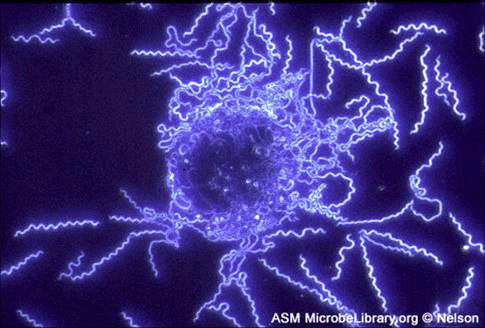 Borrelia burgdorferi. Люминесцентная микроскопия. В осветителе люминесцентного микроскопа используется мощный источник света (ртутно-кварцевая лампа сверхвысокого давления или галогенная кварцевая лампа), излучающий преимущественно в коротковолновой (ультрафиолетовой, синей) части спектра. Используется система светофильтров: возбуждающие светофильтры пропускают только ту часть спектра, которая возбуждает люминесценцию; теплозащитный светофильтр защищает от перегрева другие светофильтры, препарат и оптику люминесцентного микроскопа. В медицинской микробиологии применяют два метода люминесцентной микроскопии: флюорохромирование (окрашивание флюорохромами) и флюоресцирующих антител (реакция иммунофлюоресценции - РИФ). Люминесцентная микроскопия увеличивает контрастность изображения, дает возможность различить отдельные клеточные структуры. Люминесцентная микроскопия применяется для бактериоскопии инфекционных возбудителей, для цитохимического исследования живых и фиксированных микроорганизмов. В РИФ с помощью антител, меченных флюорохромами, выявляются антигены микроорганизмов или антитела в сыворотке больных. РИФ используется для экспресс-диагностики инфекционных заболеваний. Электронная микроскопия Обычный просвечивающий электронный микроскоп(ОПЭМ) во многом подобен световому микроскопу, но только для освещения образцов в нем используется не свет, а пучок электронов. Источником электронов обычно служит нагреваемый катод из вольфрама или гексаборида лантана (1). Катод электрически изолирован от остальной части прибора, и электроны ускоряются сильным электрическим полем с помощью специальной ускоряющей системы (2). Для этого катод поддерживается под потенциалом порядка 100000В относительно других электродов. Для уменьшения рассеивания электронов в колонне микроскопа создается вакуум. Пучок электронов с помощью конденсорных магнитных линз (4) фокусируется на образце (5). Диафрагма (3) определяет ширину пучка в плоскости объекта. Образец помещается в магнитном поле объективной линзы с большой оптической силой (6), которая создает увеличенное изображение объекта (увеличение порядка 100). Аберрации объективной линзы ограничиваются ее диафрагмой (7). Проекционная линза (8) проецирует изображение на экран или пленку (9) и может создавать дополнительное увеличение. В растровом электронном микроскопе применяются электронные линзы для фокусировки электронного пучка в пятно очень малых размеров. Это пятно непрерывно обегает некоторый участок образца аналогично лучу, обегающему экран телевизионной трубки. Для растрового микроскопа требуется высокоинтенсивный источник электронов (1). Для этого вблизи поверхности заостренной вольфрамовой проволочки малого диаметра создается сильное электрическое поле, вытягивающее из нее электроны без нагрева. Яркость такого источника почти в 10000 раз больше, чем источника с нагреваемой вольфрамовой проволокой. Электроны дополнительно ускоряются с помощью ускоряющей системы (2) и фокусируются в пятно малого диаметра магнитной линзой (3). С помощью отклоняющих магнитных катушек (4) электронный пучок обегает весь участок образца (5). Детектор отраженных электронов (6), располагающийся выше образца, регистрирует отраженные электроны. При этом контраст связан в основном с углом падения электронов на образец, и на изображении хорошо выявляется поверхностная структура (сканирующая микроскопия). Детекторы, расположенные под образцом, используютя для растровой просвечивающей микроскопии для исследования тонких образцов. Кольцевой детектор (7) регистрирует электроны, рассеянные на углы более нескольких градусов. Электроны, не претерпевшие рассеяния в образце, а также электроны, замедлившиеся в результате взаимодействия с образцом, проходят в отверстие кольцевого детектора. Энергетический анализатор (8), расположенный под кольцевым детектором, позволяет измерить энергию, потерянную электонами при рассеянии, и вследствии этого получить важную информацию об образце. 74. Методы получения чистой бактериальной культуры – бактериологический метод исследования. Культуральный метод исследования представляет собой выделение из питательной среды бактерий определённого вида путём культивирования, с их последующей видовой идентификацией. Вид бактерий определяется с учётом их строения, культуральных и экологических данных, а также генетических, биохимических и биологических показателей. Для проведения бактериологической диагностики используются схемы, которые утверждены Минздравом. Выведенные из питательной среды новые виды бактерий, свойства которых ещё не определены, называются чистой культурой. После окончательной идентификации их характеристик, бактерии, выведенные из определённого места и в определённое время, получают название штамм. При этом допускается незначительное различие в свойствах, месте или времени выделения штамма одного вида. Цель метода: 1. Этиологический диагноз, то есть выделение и идентификация чистой культуры бактерий. 2. Определение количества микроорганизмов и их особых характеристик. Например, специфическая реакция на антибиотики. 3. Выявление внутриродовых отличий микроорганизмов, на основе их эпидемиологической и генетической составляющей. Это необходимо для определения общности микроорганизмов выделенных в разных местах и разных условиях, что важно для эпидемиологических целей. Данный метод исследования имеет определённый ряд этапов, различных для аэробных, факультативных и облигатных аэробных бактерий. Выведение чистой культуры для аэробных и факультативных аэробных бактерий. 1 этап А) Подготовительные мероприятия. Эта стадия включает в себя забор, хранение и транспортировку материала. Также, при необходимости, может проводиться его обработка, в зависимости от свойств изучаемых бактерий. Например, при обследовании материала на туберкулёз, для выявления кислоустойчивых микробактерий используются растворы щёлочи или кислоты. Б) Обогащение. Данная стадия не является обязательной и проводится в том случае, если количества бактерий в исследуемом материале недостаточно для проведения полноценного исследования. Например, при выделении гемокультуры, исследуемую кровь помещают в среду в соотношении 1 к 10 и хранят в течение суток при температуре 37о. В) Микроскопия. Мазок исследуемого материала окрашивается и изучается под микроскопом - исследуется микрофлора, её свойства и количество. В дальнейшем из первичного мазка необходимо отдельно выделить все находящиеся в нём микроорганизмы. Г) Создание отдельных колоний. На чашку, со специальной, селективной средой, наносится материал, для этого используют петлю или шпатель. Далее, устанавливают чашку вверх дном, для защиты колоний от конденсата, и хранят в термостате около 20 часов, поддерживая температуру 37о. Важно! Следует помнить, что в процессе исследования, необходимо придерживаться правил изоляции. С одой стороны, для защиты исследуемого материала и выводимых бактерий, и с другой стороны, для предотвращения заражения окружающих лиц и внешней среды. Что касается условно-патогенных микроорганизмов, то при их выведении, имеет значение их количественная характеристика. В этом случае, проводится количественный посев, при котором проводят несколько стократных разведений материала в изотоническом растворе хлорида натрия. После, осуществляют посев в чашки Петри по 50 мкл. 2 этап А) Изучение морфологических свойств колоний в средах и их микроскопия. Исследуются чашки и отмечаются свойства микроорганизмов, показатели их количества, темпы роста, а также отмечается наиболее подходящая питательная среда. Для изучения лучше всего выбрать колонии, располагающиеся ближе к центру, и если образуется несколько типов чистых культур, то изучить каждую в отдельности. Для изучения морфотипной чистоты культуры используют мазок колонии, его окрашивают (обычно используется метод по Граму или же любой другой) и тщательно микроскопируют. Б) Накопление чистой культуры. Для этого колонии всех морфотипов рассаживают в отдельные пробирки с питательной средой и содержат в термостате при определённой температуре (для большинства микроорганизмов подходящей является температура 37о, но в некоторых случаях может быть иной). Питательной средой для накопления часто служит среда Клиглера. Она имеет «скошенный» вид в пробирках, где 2/3 её части в виде столбика, а 1/3 – скошенная поверхность, окрашена в светло-красный цвет. Состав: · МПА · 0,1% глюкозы · 1% лактозы · Специальный реактив на сероводород · Феноловый красный индикатор. 3 этап А) Уровень роста и чистоты культуры. В общем порядке, выведенная чистая культура имеет однородный рост и при микроскопическом рассмотрении клетки имеют одинаковое морфологическое и тинкториальное строение. Но встречаются некоторые виды бактерий с ярковыраженным плеофоризмом, при этом, встречаются клетки, имеющие различное морфологическое строение. Если в качестве питательной среды использовалась среда Клиглера, то по изменению цвета столбика и скошенной части определяются биохимические характеристики. Например, если происходит разложение лактозы - желтеет скошенная часть, если глюкозы - пожелтение столбика; при продукции сероводорода происходит почернение из-за перехода сульфата в сульфид железа. Как можно заметить на рисунке, среда Клиглера имеет свойство изменять свой цвет. Это происходит из-за того, что расщепление бактериями азотистых веществ и образование продуктов щёлочи происходит неоднородно как в столбике (анаэробные условия), так и на скошенной поверхности (аэробные условия). В аэробной среде (скошенная поверхность) наблюдается более активное образование щёлочи, чем в анаэробной среде (столбик). Поэтому, когда происходит разложение глюкозы, кислота на скошенной поверхности без труда нейтрализуется. Но, при разложении лактозы, концентрация которой намного больше, кислоту не выходит нейтрализовать. Что касается анаэробной среды, то щелочных продуктов генерируется крайне мало, поэтому здесь можно наблюдать, как глюкоза ферментируется. Рис. Питательная среда Клиглера. 1 – исходная среда, 2 – рост E. coli, 3– рост S. paratyphi B, 4 – рост S. Typhi. E. coli – способствует разложению глюкозы и лактозы с образованием газов, не производит водород. Вызывает пожелтение всей среды с разрывами. S. paratyphi – способствует разложению глюкозы с образованием газов, лактозоотрицателен. Скошенная часть цвет не изменяет, столбик – желтеет. S. paratyphi A- не продуцирует сероводород. S. paratyphi B – сероводород продуцируется (по ходу укола проявляется чёрный цвет). S. typhi – глюкоза разлагается без газообразования, сероводород продуцируется, лактозоотритателен. Скошенная часть не изменяет цвета, столбик – желтеет и среда чернеет по ходу укола. Shigella spp.- лактозоотрицателен, глюкозоположителен, сероводород не продуцируется. Столбик приобретает жёлтый оттенок, а скошенная часть остаётся прежней. Б) Финальная идентификация чистой культуры и её реакция на антибиотики. На данном этапе изучаются биохимические, биологические, серологические и генетические свойства культуры. В исследовательской практике не возникает необходимости в изучении полного спектра свойств микроорганизмов. Достаточно использовать простейшие тестирования для определения принадлежности микроорганизмов к тому или иному виду. 75. Полимеразная цепная реакция. Определение, теоретические и практические основы. Полимеразная цепная реакция Полимеразная цепная реакция – метод, позволяющий провести многократное увеличение (амплификацию) количества определенных молекул ДНК в анализируемом образце (в том числе в биологическом материале или чистой культуре). Главные преимущества ПЦР как диагностического метода в микробиологии – очень высокая чувствительность, позволяющая обнаружение крайне малых концентраций возбудителей в образцах, а такжерегулируемая специфичность, позволяющая обнаруживать или идентифицировать возбудителей на родовом, видовом или субвидовом уровне. Основной недостаток ПЦР вытекает из его крайне высокой чувствительности – образы очень легко загрязнить ДНК из положительного контроля, другого образца или продукта ПЦР, что приведет к ложноположительной реакции. Это накладывает жесткие ограничения на условия, в которых производится смешивание ПЦР и работа с готовыми продуктами ПЦР. Проведение ПЦР. Готовится реакционная смесь, содержащая следующие компоненты: Выделенную ДНК из исследуемого образца, Буферный раствор, Ионы Mg2+ (необходимы для работы фермента), Два праймера – одноцепочечныекороткие молекулы ДНК (длина чаще всегоот 18 до 24 нуклеотидов), комплементарные концам разных цепей обнаруживаемой последовательности ДНК. Смесь дезоксинуклеотидтрифосфатов. Термостойкую ДНК-полимеразу (чаще всего используется Taq-полимераза – полимераза, выделенная из Thermus aquaticus ). Затем данная реакционная смесь помещается в амплификатор, который фактически представляет собой программируемый термостат. В амплификаторе проводится 30-40 циклов смены температур. Каждый из этих циклов состоит из трех этапов (см. Рис. 1): Денатурация (температура 94оС) – разрываются водородные цепи, и цепочки ДНК расходятся. Отжиг праймеров (температура обычно в районе 50-60оС) – к концам цепей ДНК присоединяются праймеры. Вообще, при снижении температуры энергетически выгоднее воссоединение исходных цепей ДНК из исследуемого образца (ренатурация), однако концентрация праймеров в реакционной смеси на много порядков больше концентрации ДНК из образца (по крайней мере, на начальных циклах ПЦР), поэтому реакция отжига праймеров протекает быстрее ренатурации ДНК. Температура отжига выбирается в зависимости от температур плавления (денатурации) праймеров. Элонгация (температура обычно 72оС) – ДНК-полимераза достраивает праймеры по матрице длинных цепей ДНК. Температура соответствует оптимальной температуре работы используемой ДНК-полимеразы. Детекция результатов отличается в различных вариантах постановки ПЦР и описана в разделе «Разновидности ПЦР». Динамика ПЦР На ранних циклах ПЦР количество двухцепочечных молекул ДНК, размер которых определяется расстоянием между местами посадки праймеров, удваивается с каждым циклом. Также образуется малое количество более длинных молекул ДНК, которым можно пренебречь (см. Рис 2). Таким образом, на ранних циклах количество продукта ПЦР описывается формулой m*2n, где m – исходное количество искомой ДНК в пробе, n – число циклов. Затем реакция выходит на плато. Это происходит из-за накопления продукта реакции, снижения концентрации праймеров и дезоксинуклеотидтрифосфатов, а также за счет повышения концентрации пирофосфата (см. Рис 3). Разновидности ПЦР Конвенциональная ПЦР В данном варианте постановки ПЦР реакция идет заранее выбранное число циклов (30-40), после чего анализируется, произошло ли накопление двуцепочечных молекул ДНК в реакционной смеси. Данный вариант постановки ПЦР при использовании в качестве способа диагностики является качественным методом. Положительная реакция свидетельствует о наличии хотя бы следовых количеств искомых молекул ДНК в образце. Отрицательная реакция свидетельствует об их отсутствии. Количественная оценка содержания исходных молекул ДНК в образце невозможна из-за выхода реакции на плато. Основным методом выявления наличия продукта является электрофорез в агарозном или полиакриламидном геле. Продукты ПЦР разделяются в геле под действием электрического поля в соответствии с их молекулярной массой. В гель добавляется интеркалирующий краситель (флуоресцирующий в связанном с двухцепочечной ДНК состоянии - чаще всего бромистый этидий). Таким образом, при облучении ультрафиолетом можно будет увидеть наличие или отсутствие полоски, соответствующей ДНК необходимой молекулярной массы. При проведении ПЦР в диагностических целях всегда ставятся положительный и отрицательный контроли реакции, с которыми сравниваются образцы (см. Рис. 4). ПЦР в реальном времени В данном варианте постановки ПЦР количество продукта ПЦР в реакционной смеси регистрируется постоянно в ходе протекания реакции. Это позволяет построить кривую протекания реакции (см. Рис. 3) и, исходя из неё, рассчитать количество искомых молекул ДНК в образцах. Один из видов проведения ПЦР в реальном времени – с использованием интеркалирующегокрасителя, который добавляется прямо в реакционную смесь (чаще всего используется SYBRGreen). Другой вид – с использованием одного из видов флуоресцирующих зондов, связывающихся с участком внутри ПЦР-продукта, что позволяет повысить специфичность обнаружения (см. Рис 5).Детекцияфлуоресценции происходит непосредственно в приборе в ходе протекания реакции. Помимо возможности количественного обнаружения, существуют и другие достоинства ПЦР в реальном времени по сравнению с конвенциональной. Данный вариант ПЦР более прост, быстр, а также не требует открывания пробирок с продуктами ПЦР, что уменьшает вероятность загрязнения других образцов. Основной недостаток – более высокая стоимость амплификатора со встроенной возможностью детекциифлуоресценции по сравнению с обычным. Цифровая количественная ПЦР Новый, дорогостоящий и пока малораспространенный вариант ПЦР, позволяющий более точно определять количество ДНК в образце.В данном варианте реакционная смесь, содержащая флуоресцентный краситель, разбивается на огромное число микроскопических объемов (например, капелек в эмульсии). После протекания ПЦР анализируется, в какой доле капелек реакция оказалась положительной и, соответственно, наблюдается флуоресценция. Эта доля будет пропорциональна числу искомых молекул ДНК в образце. ПЦР с обратной транскрипцией В данном случае перед тем или иным вариантом ПЦР производится реакция обратной транскрипции (РНК в ДНК) с использованием фермента ревертазы. Таким образом, этот метод позволяет проводить качественное или количественное обнаружение молекул РНК. Это может использоваться для детекции РНК-содержащих вирусов или определения уровня транскрипции (количества мРНК) того или иного гена. 76. Методы определения чувствительности бактерий к антибиотикам. Диско-диффузионный метод На поверхность плотной питательной среды, засеянной сплошным газоном исследуемой культурой, накладывают не более 6 дисков, пропитанных антибиотиками, на расстоянии не менее 2 см друг от друга. Регистрация результатов проводится через 18-24 часов инкубирования в термостате по диаметру зоны отсутствия роста вокруг дисков с антибиотиками. Наличие роста вокруг диска свидетельствует о нечувствительности данного микроба к антибиотику. Для интерпретации результатов используются специальные таблицы. 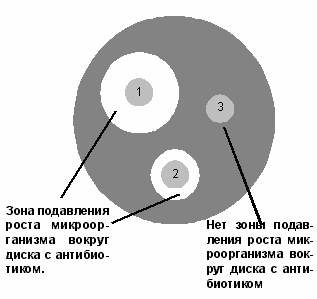 Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом: 1 – микроорганизм чувствителен к антибиотику; 2 – микроорганизм умеренно резистентен к антибиотику; 3 – микроорганизм устойчив к антибиотику. Метод Е-тестов Принцип метода. Определение чувствительности микроорганизма проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной. В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК). 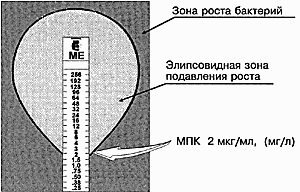 Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов Метод серийных разведений в бульонной среде В пробирках, содержащих 1 мл Мюллер-Хинтон бульона, готовят серийные двукратные разведения антибактериального препарата, например 100 мкг/мл – 1-я, 50 мкг/мл – 2-я, 25 мкг/мл – 3-я, 12,5 мкг/мл – 4-я и т.д. Затем в каждую пробирку вносят 0,1 мл испытуемой бактериальной суспензии. Одновременно ставят контроль роста (1 мл Мюллер-Хинтон бульона и 0,1 мл суспензии бактерий). Посевы инкубируют при 37°С в течение 18-24 ч., после чего отмечают результаты. Отсутствие помутнения среды свидетельствует о задержке роста бактерий в присутствии данной концентрации препарата.  Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде Минимальная подавляющая концентрация (МПК) – наименьшая концентрация антибиотика (в мкг/мл или мг/л), которая in vitro полностью подавляет видимый рост бактерий. 77. Аллергологический метод исследования. Клинико-диагностическое значение гиперчувствительности замедленного типа (ГЗТ). Постановка и оценка аллергической пробы на примере реакции Манту. Антигены многих возбудителей обладают сенсибилизирующим действием, т.е. способны вызывать аллергические реакции. Это используют для диагностики инфекционных заболеваний, а также при проведении эпидемиологических исследований. Наибольшее распространение нашли кожно-аллергические пробы, включающие внутрикожное введение Аг (аллергена). Кожные пробы нашли применение в диагностике таких заболеваний как сап, мелиоидоз, бруцеллёз. Наиболее известна проба Манту, используемая как для диагностики туберкулёза, так и для оценки невосприимчивости организма к возбудителю [4]. Первая классификация аллергий была предложена Р. Куком в 1947 г. В ее основу было положено время развития аллергической реакции. Была выделена гиперчувствительность немедленного типа (ГНТ) и гиперчувствительность замедленного типа (ГЗТ). Реакции ГЗТ возникают через 6-8 ч и позже. ГЗТ опосредована клеточным звеном иммунитета. Перенос аллергизации от больного здоровому возможен только с лейкоцитарным пулом. Специфическая терапия, как правило, оказывается неэффективной. Изучение молекулярных механизмов аллергии привело к созданию Джеллом и Кумбсом в 1968 г. новой классификации. В соответствии с ней различают 4 основных типа аллергии: анафилактический (I тип), цитотоксический (II тип), иммунокомплексный (III тип) и опосредованный клетками (IV тип). Первые три типа относятся к ГНТ, четвертый к ГЗТ. ГЗТ представляет собой лимфоидно-макрофагальную реакцию, которая развивается в результате активации макрофагов под влиянием лимфоцитов, сенсибилизированных к аллергену. Основу ГЗТ составляют нормальные механизмы иммунного воспаления. Активация макрофага возможна в результате контактного или цитокинового воздействия. Контактная стимуляция - результат рецептор-лигандного взаимодействия макрофага, несущего рецепторную молекулу СD40, и Т1-хелпера, экспрессирующего СD40-лиганд. В исключительных случаях эту функцию может выполнять Т2-хелпер. Цитокиновая активация макрофага осуществляется γ-ИФН, который продуцируют Т1-хелперы, Т-киллеры или естественные киллеры. Кроме того, макрофаг может быть стимулирован ЛПС (через СD14-рецепторную молекулу). Ингибиторами активации макрофага являются иммуноцитокины Т2- хелпера: ИЛ-4, 10, 13 и др. Активация макрофага резко повышает его эффективность в осуществлении АЗКЦТ и иммунного фагоцитоза, т.е. деструкции и элиминации антигена. Для обнаружения аллергических реакций IV типа применяют кожно-аллергические пробы, которые широко используют в диагностике некоторых инфекционных заболеваний, паразитозов и микозов (туберкулез, лепра, бруцеллез, туляремия и др.). Реакции гиперчувствительности имеют также большое значение и в норме. Их механизмы лежат в основе воспаления, которое способствует локализации инфекционного агента или иного антигена в пределах определенных тканей и формированию полноценной иммунной реакции защитного характера. 41. Аллергические пробы - биологические реакции для диагностики ряда заболеваний, основанные на повышенной чувствительности организма, вызванной аллергеном. При многих инфекционных заболеваниях за счет активации клеточного иммунитета развивается повышенная чувствительность организма к возбудителям и продуктам их жизнедеятельности. На этом основаны аллергические пробы, используемые для диагностики бактериальных, вирусных, протозойных инфекций, микозов и гельминтозов. Аллергические пробы обладают специфичностью, но нередко они бывают положительными у переболевших и привитых. Все аллергические пробы подразделяют на две группы — пробы in vivo и in vitro. К первой группе (in vivo)относятся кожные пробы, осуществляемые непосредственно на пациенте и выявляющие аллергию немедленного (через 20 мин) и замедленного (через 24 — 48 ч) типов. Аллергические пробы in vitro основаны на выявлении сенсибилизации вне организма больного. Их применяют тогда, когда по тем или иным причинам нельзя произвести кожные пробы, либо в тех случаях, когда кожные реакции дают неясные результаты. Для проведения аллергических проб используют аллергены — диагностические препараты, предназначенные для выявления специфической сенсибилизации организма. Инфекционные аллергены, используемые в диагностике инфекционных заболеваний, представляют собой очищенные фильтраты бульонных культур, реже взвеси убитых микроорганизмов или АГ, выделенные из них. Кожные пробы. Инфекционные аллергены вводят, как правило, внутрикожно или накожно, путем втирания в скарифицированные участки кожи. При внутрикожном способе в среднюю треть передней поверхности предплечья специальной тонкой иглой вводят 0,1 мл аллергена. Через 28 — 48 ч оценивают результаты реакции ГЗТ, определяя на месте введения размеры папулы. Неинфекционные аллергены (пыльца растений, бытовая пыль, пищевые продукты, лекарственные и химические препараты) вводят в кожу уколом (прик-тест), накожно путем скарификации и втирания или внутрикожной инъекцией разведенного раствора аллергена. В качестве отрицательного контроля используют ИХН, в качестве положительного — раствор гистамина. Результаты учитывают в течение 20 мин (ГНТ) по величине папулы (иногда до 20 мм в диаметре), наличию отека и зуда. Внутрикожные пробы ставят в случае отрицательного или сомнительного результата прик-теста. По сравнению с последним, дозу аллергена уменьшают в 100-5000 раз. Кожные пробы на наличие ГЗТ широко применяют для выявления инфицированности людей микобактериями туберкулеза (проба Манту), возбудителями бруцеллеза (проба Бюрне), лепры (реакция Митсуды), туляремии, сапа, актиномикоза, дерматомикозов, токсоплазмоза, некоторых гельминтозов и др. Пробы in vitro. Эти методы исследования безопасны для больного, достаточно чувствительны, позволяют количественно оценить уровень аллергизации организма. В настоящее время разработаны тесты для определения сенсибилизации, основанные на реакциях Т- и B-лимфоцитов, тканевых базофилов, выявлении общих специфических IgE в сыворотке крови и др. К ним относятся реакции торможения миграции лейкоцитов и бласттрансформации лимфоцитов, специфическое розеткообразование, базофильный тест Шелли, реакция дегрануляции тканевых базофилов, а также аллергосорбентные методы (определение специфических IgE в сыворотке крови). Реакция торможения миграции лейкоцитов (РТМЛ). РТМЛ основана на подавлении миграции моноцитов и других лейкоцитов под действием медиаторов, вырабатываемых сенсибилизированными лимфоцитами, в присутствии специфического аллергена. Реакция бласттрансформации лимфоцитов (РБТ). В основе этой реакции лежит способность нормальных лимфоцитов периферической крови вступать в митоз и превращаться в бластные формы при культивировании их in vitro под действием специфических факторов — аллергенов и неспецифических стимуляторов митогенеза — митогенов (фитогемагглютинин, конканавалин А, липополисахариды и другие вещества). Реакция специфического розеткообразования. Розетки — характерные образования, возникающие in vitro в результате прилипания эритроцитов к поверхности иммунокомпетентных клеток. Розеткообразование может происходить спонтанно, поскольку Т-лимфоциты человека содержат рецепторы к эритроцитам барана. Спонтанное розеткообразование здоровых людей составляет 52 — 53% и служит показателем функционального состояния Т-лимфоцитов. Этот феномен воспроизводится также и в том случае, если используют эритроциты, на которых фиксированы соответствующие аллергены. Реакция дегрануляции тканевых базофилов. Методика основана на том, что под действием аллергена происходит дегрануляция тканевых базофилов крысы, предварительно сенсибилизированных цитофильными AT из сыворотки крови больного. Базофильный тест Шелли. Известно, что базофильные гранулоциты человека или кролика также дегранулируются в присутствии сыворотки больного и аллергена, к которому чувствителен данный пациент. Определение антител класса IgE in vitro. Лабораторная диагностика заболеваний, в основе которых лежит ГНТ, основана на определении аллергенспецифических IgEанти-IgE. При использовании радиоактивной метки метод носит название радиоаллергосорбентного теста (PACT), но чаще в качестве метки используют фермент или флюоресцирующее вещество (ФАСТ). Время анализа — 6 — 7 часов. Принцип метода: фиксированный на твердой основе известный аллерген инкубируют с сывороткой крови больного; находящиеся в сыворотке специфическиеIgEанти-IgE связываются с аллергеном и, таким образом, остаются фиксированными на основе и могут вступать в специфическое взаимодействие с добавляемыми мечеными анти-IgE. |
