41-80 вопросы. 41. Механизмы и пути передачи инфекции
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
66. Клетки иммунной системы. Характеристика иммунокомпетентных и антигенпрезентирующих клеток. Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении условно разделяют на четыре группы. 1. Антигенпрезентирующие клетки: макрофаги, дендритные клетки типов 1 и 2, В-лимфоциты. 2. Регуляторные клетки: T-индукторы, Т-хелперы типов 1, 2 и 3, естественные регуляторные Т-клетки. 3. Эффекторные клетки: плазматические клетки (дифференцирующиеся из В-лимфоцитов), цитотоксические Т-клетки с фенотипом CD8+ (или T-киллеры); эффекторные Т-клетки воспаления с фенотипом CD4+ (или Т-лимфоциты, ответственные за гиперчувствительность замедленного типа); нейтрофилы, эозинофилы, базофилы, тучные клетки, натуральные киллеры (NK-клетки), макрофаги. 4. Клетки памяти: Т-клетки памяти с фенотипом CD8+; Т-клетки памяти с фенотипом CD4+; долгоживующие плазматические клетки; В-клетки памяти. Номенклатура CD («Cluster of Differentiation»), которая была разработана нобелевскими лауреатами (1984) G.J.F. Kohler (Швейцария) и C. Milstein (Аргентина/Великобритания), основана на моноклональной технологии. Она позволяет идентифицировать клетки в соответствии с их происхождением, стадией дифференцировки, функциональным состоянием и т.д. (см. табл. 7-1). Данная технология, без сомнения, оказалась революционной в иммунологических и смежных областях исследований. Лимфоциты как главные клетки иммунной системы имеют отличительные особенности: 1. Постоянная «патрульная» рециркуляция по кровотоку, лимфотоку, межтканевым пространствам и секретам.2. Способность распознавать, т.е. взаимодействовать со «своим» и «чужим» по принципу «лиганд - рецептор». Taблица 7-1. Главные идентификационные CD-маркеры клеток иммунной системы
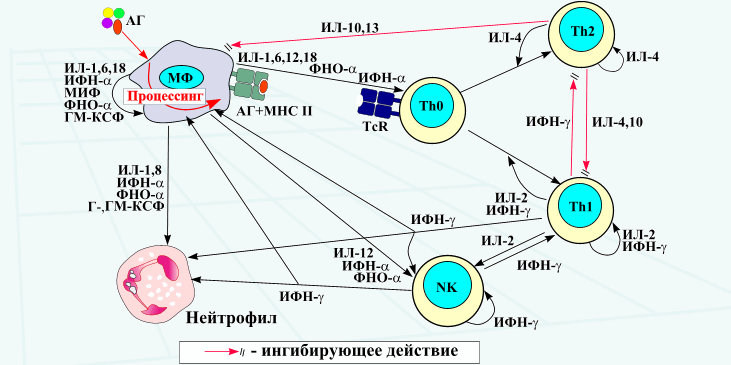
3. Клональная (или групповая) организация (McF. Burnet) и способность формировать сетевые элементы (N.K. Jerne). 4. Способность к непрерывным реаранжировкам в своем геноме в любом возрасте в связи с потребностями формирования специфического ответа на патоген. 5. Умение запоминать антигены и обеспечивать в будущем экспрессный высокоэффективный антигенспецифический ответ. Клон - это группа лимфоцитов, коммитированных к определенному антигену. До встречи с этим антигеном каждый лимфоцит клона называют наивным. По-видимому, в человеческом организме исходно существуют десятки миллионов клонов Т- и В-лимфоцитов. После контакта с соответствующим антигеном и в результате иммунного ответа коммитированный лимфоцит становится праймированным. 67. Цитокины. Строение, функции и значение для развития иммунной системы, лимфопоэза и регуляции иммунного ответа. Цитокины - белки гл. обр. активированных клеток иммунной системы, обеспечивающие межклеточные взаимодействия. К цитокинам относятся интерфероны (ИНФ), интерлейкины (ИЛ), хемокины, факторы некроза опухоли (ФНО), колониестимулирующие факторы (КСФ), факторы роста. Цитокины действуют по эстафетному принципу: воздействие цитокина на клетку вызывет образование ею других цитокинов (цитокиновый каскад). Различают интракринный, аутокринный, паракринный и эндокринный механизмы действия цитокинов. 1. Интракринный механизм - действие цитокинов внутри клетки-продуцента; связывание цитокинов со специфическими внутриклеточными рецепторами. 2. Аутокринный механизм - действие секретируемого цитокина на саму секретирующую клетку. Например, интерлейкины-1, -6 -18, ФНОα являются аутокринными активирующими факторами для моноцитов/макрофагов. 3. Паракринный механизм - действие цитокинов на близкорасположенные клетки и ткани. Например, ИЛ-1, -6 -12 и -18, ФНОα, продуцируемые макрофагом, активируют Т-хелпер (Th0), распознающий антиген и МНС макрофага (Схема аутокринно-паракринной регуляции иммунного ответа). 4. Эндокринный механизм - действие цитокинов на расстоянии от клеток-продуцентов. Например, ИЛ-1, -6 и ФНОα, помимо ауто- и паракринных воздеиствий могут оказывать дистантное иммунорегуляторное действие, пирогенный эффект индукцию выработки белков острой фазы гепатоцитами, симптомы интоксикации и мультиорганные поражения при токсико-септических состояниях.
Интерлейкины (ИЛ) - цитокины, ответственные за межклеточные взаимодействия между лейкоцитами. Описано около 20 интерлейкинов. Факторы некроза опухоли. Различают: собственно фактор некроза опухоли (ФНО), или ФНОα лимфотоксины, или ФНОβ. ФНОα продуцируется макрофагами, а также тучными клетками и лимфоцитами. Он обусловливает развитие токсического шока и кахексии (старое название кахектин), индуцирует острофазные белки и стимулирует ангиогенез. Может индуцировать апоптоз. Способен вызывать геморрагический некроз ряда опухолей. ФНОα продуцируется Т- и В-лимфоцитами, обладает аналогичным действием. Интерфероны - гликопротеины, вырабатываемые клетками в ответ на вирусную инфекцию и другие стимулы. Блокируют репликацию вируса в других клетках и участвуют во взаимодействии между клетками иммунной системы. Различают две серологические группы интерферонов: I типа - ИНФ-α и -β и II типа - ИФН-γ. Интерфероны I типа оказывают противовирусные и противоопухолевые эффекты, в то время как интерферон II типа регулирует специфический иммунный ответ и неспецифическую резистентность. ИНФ-α и ИНФ-β отличаясь по структуре и клеткам-продуцентам, обладают практически одинаковым механизмом действия. В норме ИНФ-α продуцируется мононуклеарными фагоцитами (отсюда одно из названий - "лейкоцитарный ЛФН"), а ИНФ-β - фибробластами ("фибробластный ИФН") . Под воздействием микроба секретируются многими клетками. Усиливают продукцию ИФН пирогеиное действие ИЛ-1 и понижение рН в межклеточной жидкости на фоне повышения температуры. Защитное действие ИНФ I типа реализуется посредством ингибирования репликации РНК или ДНК под воздействием олигоаденилат-синтетазы, которую продуцируют интерферон-содержащие клетки. ИНФ I типа, связываясь со здоровыми клетками, защищает их от вирусов. Антивирусное действие ИНФ I типа может обусловливаться и тем, что он способен угнетать клеточную пролиферацию, препятствуя синтезу аминокислот, например триптофана. Этот механизм, а также способность индуцировать програмированную клеточную гибель некоторых опухолей лежат в основе противоопухолевого действия ИФН I типа. Кроме того, ИНФ I типа усиливает литическое действие нормальных киллеров на клетки-мишени, в том числе трансформированные клетки, индуцирует экспрессию антигенов МНС I и, наоборот, подавляет формирование тех же антигенов МНС II. ИФН-γ ("иммунный ИФН") продуцируется Т-лимфоцитами и NK. Стимулирует активность Т- и В-лимфоцитов, моноцитов/макрофагов и нейтрофилов. Усиливает экспрессию молекул МНС I, МНС II. Стимулирует дифференцировку ThO в Thl. Иммунный ИФН вместе со своим антогонистом ИЛ-4 поддерживает баланс Thl/Th2. Помимо этого, ИФН-γ регулирует апоптоз целого ряда нормальных, а также некоторых инфицированных и трансформированных клеток. Так, он индуцирует програмированную клеточную гибель активированных макрофагов, кератиноцитов, гепатоцитов, клеток костного мозга, эндотелиоцитов и подавляет апоптоз периферических моноцитов и герпес-инфицированных нейронов. Колониестимулирующие факторы (КСФ) - цитокины, регулирующих деление, дифференцировку костно-мозговых стволовых клеток и предшественникон клеток крови. Кроме того, они могут стимулировать дифференцировку и функциональную активность некоторых клеток вне костного мозга. Гранулоцитарный КСФ (Г-КСФ) продуцируется в основном макрофагами, а также фибробластами. Стимулирует деление и дифференцировку стволовые клеток, в некоторой степени усиливает активность нейтрофилов и эозинофилов. Макрофагальный КСФ (М-КСФ) вырабатывается моноцитами, в меньшей степени эндотелиальными клетками и фибробластами. Активирует пролиферации предшественников макрофагов в костном мозге. Гранулоцитарно-макрофагальный КСФ (ГМ-КСФ) продуцируется макрофагами И Т-лимфоцитами, а также фибробластами и эндотелиоцитами. Стимулирует деление и дифференцировку предшественников гранулоцитов и макрофагов, активирует функцию макрофагов и гранулоцитов, пролиферацию Т-клеток. Участвует в стимуляции дифференцировки кроветворных предшестенников Е антигенпрезентирующие дендритные клетки. Трансформирующий фактор роста-β (ТФР-β) - наиболее изученный полифункциональный ростовой фактор, к которому относятся также факторь роста фибробластов, тромбоцитов, эндотелия, инсулиноподобный фактор роста, эпидермальный ростовой фактор и др. ТФР-β продуцируется многими клетками (основныме продуценты - макрофаги), в том числе некоторыми опухолевыми клетками. ТФР-β - мощный деактивирующий фактор для моноцитов/макрофагов, существенно снижая их цитотоксическую и цитокин-продуцирующую активность, а также экспрессию на их поверхности молекул МНС. В этом отношении он действует синергично с другими макрофаг-деактивирующими цитокинами (ИЛ-4, -10 и -13) . ТФР-β относят к преимущественно противовоспалительным цитокинам, благодаря его способности снижать продукцию нитросоединений, реакционно-способных радикалов и провоспалительных цитокинов клетками моноцитарно-макрофагального ряда. Однако в ряде случаев он способен оказывать и провоспалительные эффекты. Большое значение имеет регуляция процессов программированной клеточной гибели нормальных и трансформированных клеток. ТФР-β угнетает апоптоз Thl, а вместе с ИЛ-2 ингибирует апоптоз Th2. Вероятно, ТФР-β, угнетая апоптоз клеток иммунной системы, играет важную роль в генерации клеток памяти. Избыточная активность этого и некоторых других ростовых факторов может приводить к гиперпролиферативным процессам, таким как гломерулонефрит, склерозированию кожи, циррозу печени и др., а также к прогрессирующему опухолевому росту. ТФР-β - один из медиаторов, обусловливающих иммуносупрессию при неопластических заболеваниях. 68. Диагностикумы, диагностические сыворотки. Классификации, способы получения и область применения. В диагностических целях при обнаружении антител в сыворотке крови больных, реконвалесцентов и бактерионосителей используются серологические реакции. Для постановки таких реакций применяются диагностикумы - препараты, содержащие взвесь обезвреженных микроорганизмов или определенные антигены. Необходимость использования диагностикумов для серологических реакций связана не только с явным их преимуществом перед живыми культурами микробов (безопасность в работе), но еще и потому, что для приготовления диагностикумов подбираются штаммы микроорганизмов с высокой чувствительностью к антителам и способностью длительно сохранять антигенные свойства. Для инактивации микроорганизмов при приготовлении диагностикумов чаще всего используются химические вещества, особенно формалин, являющийся лучшим консервантом. Убитые нагреванием микробы хуже сохраняют антигенные свойства и применяются редко. В серологических реакциях (реакции агглютинации, реакции пассивной гемагглютинации, реакции связывания комплемента, реакции торможения гемагглютинации) для выявления специфических антител применяются: бактериальные, эритроцитарные и вирусные диагностикумы. Бактериальные диагностикумы могут содержать инактивированную микробную взвесь или отдельные антигенные компоненты бактерий: О, Н или Vi-антигены и используются в реакциях агглютинации. Эритроцитарные диагностикумы представляют собой эритроциты (обработанные танином или формалином) с адсорбированными на них антигенами, извлеченными из бактерий, и применяются в РПГА (реакции пассивной гемагглютинации). В том случае, когда РПГА используется для выявления антигена в выделениях больных, в тканях и др., применяют «антительные диагностикумы», т. е. эритроциты, сенсибилизированные антителами. Вирусные диагностикумы — препараты, содержащие инактированные вируссодержащие жидкости (культуральные, из куриных эмбрионов или организма животных, зараженных соответствующим вирусом), применяются в РСК (реакции связывания комплемента), реакции торможения гемагглютинации (РТГА) и реакции нейтрализации. В настоящее время в лабораториях используются следующие диагностикумы. 1. Бактериальный диагностикум сальмонелл тифа. Применяется в реакции агглютинации для обнаружения антител в сыворотке больных. 2. Сальмонеллезные О-диагностикумы содержат О-антигены различных групп сальмонелл (инактивированных 15%-ным раствором глицерина). Применяются для выявления О-антител при сальмонеллезных инфекциях в реакции агглютинации с сывороткой больных. 3. Сальмонеллезные Н-монодиагностикумы. Используются в реакции агглютинации для определения заболевания в прошлом (анамнестическая реакция агглютинации) и реже с диагностической целью. 4. Vi — брюшнотифозный диагностикум. Применяется в реакции агглютинации при выявлении брюшнотифозного бактерионосительства. 5. Единый бруцеллезный диагностикум — взвесь бруцелл (инактивированных фенолом), подкрашенная метиленовым синим. Применяется для определения антител в сыворотках крови больных бруцеллезом людей и животных в реакциях агглютинации Райта и Хеддльсона. 6. Эритроцитарный сальмонеллезный О-диагностикум — взвесь эритроцитов с адсорбированными на них О-антигенами различных групп сальмонелл. Используется для постановки РПГА с сывороткой больного при уточнении клинического диагноза сальмонеллезной инфекции. 7. Эритроцитарный Vi-диагностикум — эритроциты, сенсибилизированные очищенным Vi-антигеном S. typhi, применяется в РПГА при выявлении брюшнотифозного бактерионосительства. 8. Гриппозный диагностикум представляет собой аллантоисную жидкость инфицированных вирусом гриппа (типов А, В) куриных эмбрионов и инактивированную мертиолатом или формалином. Диагностикумы необходимы при постановке РТГА с парными сыворотками больных для уточнения клинического диагноза и циркулирующего типа вируса гриппа. 9. Диагностикум вируса клещевого энцефалита получают из суспензии мозга белых мышей, зараженных вирусом клещевого энцефалита. Суспензию подвергают центрифугированию (для осветления) и инактивируют химическими веществами. Диагностикум используется в РТГА и РСК с сывороткой больных при диагностике заболевания. 69. Вакцины. Определение. Современная классификация вакцин. Требования, предъявляемые к современным вакцинным препаратам. Вакцина — медицинский препарат, предназначенный для создания иммунитета к инфекционным болезням. Классификации вакцин: 1.Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Примером таких вакцин являются БЦЖ и вакцина против натуральной оспы человека, в качестве которой используется непатогенный для человека вирус оспы коров. 2.Инактивированные (убитые) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). В препараты иногда добавляют консерванты и адъюванты. 3.Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант. Корпускулярные вакцины – содержащие в своем составе протективный антиген 3.Анатоксины относятся к числу наиболее эффективных препаратов. Принцип получения – токсин соответствующей бактерии в молекулярном виде превращают в нетоксичную, но сохранившую свою антигенную специфичность форму путем воздействия 0.4% формальдегида при 37t в течение 3-4 недель, далее анатоксин концентрируют, очищают, добавляют адъюванты. 4.Синтетические вакцины. Молекулы эпитопов сами по себе не обладают высокой иммуногенностью для повышения их антигенных свойств эти молекулы сшиваются с полимерным крупномолекулярным безвредным веществом, иногда добавляют адъюванты. 5.Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов. Требования, предъявляемые к современным вакцинам: Иммуногенность; Низкая реактогенность (аллергенность); Не должны обладать тератогенностью, онкогенностью; Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны; Длительный срок хранения; Технологичность производства; Простота и доступность в применении. |