Билет 1. Вопрос Ингалипт
 Скачать 11.63 Mb. Скачать 11.63 Mb.
|
|
Преодоление несовместимости в данном случае: необходимо приготовить раздельно порошки ГМТА и аскорбиновой кислоты по согласованию с врачом. Вопрос 3. Radices Althaeaeкорни алтея (Althaeaeradix — алтея корень) Алтея лекарственного (AlthaeaofflcinalisL.) и алтея армянского (AlthaeaarmeniacaTen.) из сем. мальвовых (Malvaceae); используют в качестве лекарственного средства и лекарственного сырья. Заготовка сырья, первичная обработка, сушка. Корни заготавливают осенью, после отмирания надземных частей растений (сентябрь — октябрь), или весной, до начала отрастания (апрель — начало мая). После выкапывания лопатами или плугами корни тщательно очищают от земли, обрезают корневища и мелкие корни, удаляют одревесневшую верхнюю часть главного корня; неодревесневшие корни подвяливают 2-3 дня на воздухе, затем снимают пробку. Длинные корни режут поперечно на куски длиной до 35 см, толстые — вдоль на 2-4 части. Для получения неочищенного сырья после выкапывания и отряхивания от земли корни помещают в корзины и быстро промывают в холодной проточной воде. В остальном обработка проводится так же. как для очищенного от пробки сырья. Траву алтея заготавливают во время цветения (в течение месяца от начала зацветания), скашивая механизированным способом, удаляют пожелтевшие листья и примесь других растений. Корни и траву алтея сушат либо в сушилках при температуре 50-60 °С. либо в хорошо проветриваемых помещениях. В южных районах страны корни сушат также на солнце, укрывая их на ночь. При сушке этого сырья необходимо учитывать его гигроскопичность. Раскладывают его тонким слоем, рыхло, на сетках или рамах, обтянутых тканью. После сушки из сырья удаляют примеси, заплесневевшие и изменившие окраску корни и части травы. Внешние признаки. Корни алтея. Цельное сырье представляет собой очищенные от пробки корни почти цилиндрической формы или расщепленные вдоль на 2-4 части длиной 10-35 см, толщиной до 2 см, продольно-бороздчатые с отслаивающимися длинными, мягкими лубяными волокнами и темными точками — следами опавших или отрезанных мелких корней. Излом в центральной части зернисто-шероховатый, снаружи волокнистый. Цвет корня снаружи и в изломе белый, желтовато-белый, сероватый. Запах слабый, своеобразный. Вкус сладковатый с ощущением слизистости. Измельченное сырье. Смесь кусочков корней различной формы размером от 1 до 7 мм. Цвет желтовато-белый или серовато-белый. Порошок. Имеет белый, желтовато-белый или сероватый цвет, проходит сквозь сито с отверстиями размером 0.31 мм. Качественные реакции. При смачивании среза или порошка корня раствором аммиака или натрия гидроксида появляется желтое окрашивание (слизь). Микроскопия. При анатомическом исследовании корня алтея диагностическое значение имеют: вторичное строение корня с преобладанием в ксилеме тонкостенной паренхимной ткани; многочисленные со слабоутолщенными. неодревесневшими или слабо одревесневшими стенками группы волокон, расположенные прерывистыми концентрическими поясами во флоэме и более мелкими группами в ксилеме; небольшие группы сосудов и трахеид; одно-, реже двурядные сердцевинные лучи: крупные клетки со слизью; клетки паренхимы с крахмальными зернами; мелкие друзы кальция оксалата. При микроскопическом исследовании неочищенного корня алтея, помимо указанных признаков, надо отметить наличие тонкого слоя пробки. При исследовании порошка видны паренхимные клетки с крахмальными зернами и отдельные крахмальные зерна округлой, овальной или яйцевидной формы размером 3-27 мкм, обрывки сетчатых и лестничных сосудов, волокон, друзы кальция оксалата. Слизь обнаруживают при рассмотрении в разведенной туши. Хранение. Хранят сырье в хорошо проветриваемых сухих помещениях. Срок годности корней, очищенных и не очищенных от пробки — 3 года; травы — 5 лет. Использование. Корни используют в качестве отхаркивающего, мягчительного, противовоспалительного и обволакивающего средства в виде порошка, настоя, сухого экстракта и сиропа и в составе грудных сборов при острых и хронических заболеваниях дыхательных путей, а также при заболеваниях желудочно-кишечного тракта. Вопрос 4. Рецепт выписан не верно. Рецепт должен быть выписан на бланке ф.№107/У, заверенный личной печатью и подписью врача. НЕО не регламентированы. НЕО установлены пр.№328. Срок действия рецепта - 2 мес. Рецепт отдается больному с указание на обороте количества отпущенного препарата и даты отпуска и не хранится в аптеке. По истечении срока действия рецепт гасится штампом «Рецепт не действителен». Способ применения ЛС обозначается на русском или русском и национальном языках с указанием дозы, частоты, времени приема и его длительности. Порошки до прихода больного хранят в сухо, защищ. от света месте при Т не выше 25С в тсч. 10 дней.___________^^ I Биле №20. Вопрос 1. s* в-Лактамные антибиотики (в-лактамиды) содержат в молекуле лактамный цикл.. К бициклическим относятся соединения, в которых четырехчленный лактамный цикл сконденсирован с другим циклом по атому азота и соседнему с ним атому углерода. Вторым циклом в системе является пятичленный тиазолидиновый (пенами), пирролидиновый (карбопенамы) или оксазолидиновый (оксапенамы) цикл, либо шестичленный дигидротиазиновый цикл (цефалоспорины и цефамицины) К бициклическим в-лактамидам относятся пенициллины 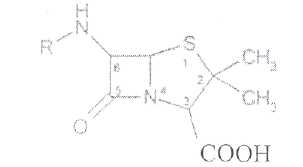 Механизм антибактериального действия в-лактамидов состоит в блокировании конечной стадии образования стенки бактерий, которое вызывает лизис клетки. Под влиянием ферментов — лактамаз происходит процесс инактивации антибиотиков. Действие этих ингибиторов основано на конкурентном антагонизме с пенициллинами. поскольку и те и другие содержат в-лактамное ядро. При окислении атома серы тиазолидинового цикла у производных пенициллановой кислоты образуются соединения, способные подавлять в-лактамазы. Примером могут служить производные 1,1-диоксида пенициллановой кислоты (III): 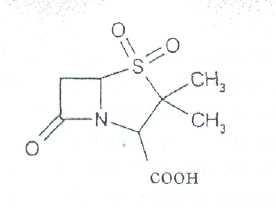 Различие в механизме каталитического действия пенициллиназы. Природный бензилпенициллин применяют в виде натриевой,' калиевой и других солей. Созданные на его основе многочисленные лекарственные формы отличаются наиболее высокой химиотерапевтической эффективностью и наименьшей токсичностью. Однако Ь-лактамный цикл бензилпенициллина легко разрушается под действием фермента пенициллиназы (Ъ-лактамазы), продуцируемой многими микроорганизмами. Кроме того, многолетнее его применение привело к широкому распространению резистентных микробов. Эти обстоятельства послужили предпосылкой создания полусинтетических пенициллинов. Решение такой сложной проблемы стало возможным после выделения в 1957 г. 6-аминопенщиллановой кислоты (6-АПК). являющейся «ядром» пенициллина. Получают 6-АПК из бензилпенициллина (или других пенициллинов), воздействуя ферментом пенициллинацилазой, продуцируемым бактериями. Процесс происходит по схеме: 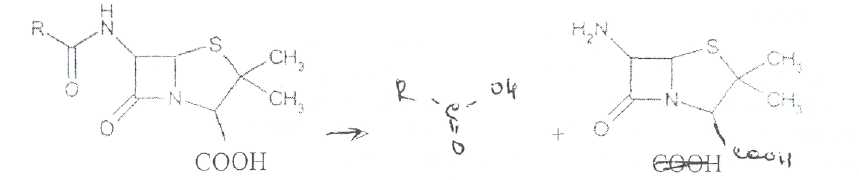 природные пенициллины 6-аминопенициллановая кислота (6-АНК) Извлекают 6-АПК из водного гидролизата экстракцией или с помощью ионообменной хроматографии. Таким образом, первая стадия производства полусинтетических пенициллинов состоит из биосинтеза 6-АПК. На второй стадии осуществляется ацилирование амина в молекуле 6-АПК соответствующей кислотой или ее хлорангидридом. Пенициллины Структурной основой лекарственных веществ природных и полусинтетических пенициллинов является 6-аминопенициллановая кислота, которая включает конденсированные тиазолидиновый (А) и лактамный (В) циклы: 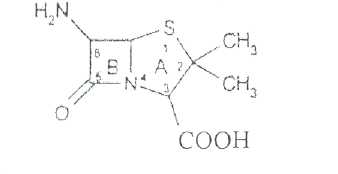 Специфичность биологической активности пенициллинов прежде всего обусловлена наличием в молекуле тиазолидинового и b-лактамного циклов. Расщепление одного из них приводит к полной потере активности. Важная роль в сохранении антибактериальной активности принадлежит также пространственной конфигурации молекул пенициллинов. Характер группировок, присоединенных к гетероциклической системе в положениях 2 и 3, не оказывает заметного влияния на биологическую активность. Различную химическую структуру может иметь радикал, замещающий атом водорода в аминогруппе, которая присоединена клактамному циклу в положении 6. Это позволило получить ряд высокоактивных полусинтетических аналогов более устойчивых, чем природный пенициллин. По физическим свойствам природные пенициллины и их синтетические аналоги представляют собой белые или почти белые кристаллические порошки без запаха. Натриевая и калиевая соли бензилпенипиллина слегка гигроскопичны. Натриевая соль бензилпенициллина очень легко растворима в воде. Натриевая и калиевая соли бензилпенициллина. растворимы в этиловом и метиловом спиртах, Натриевые и калиевые соли пенициллинов практически нерастворимы в хлороформе и эфире. Свойства пенициллинов 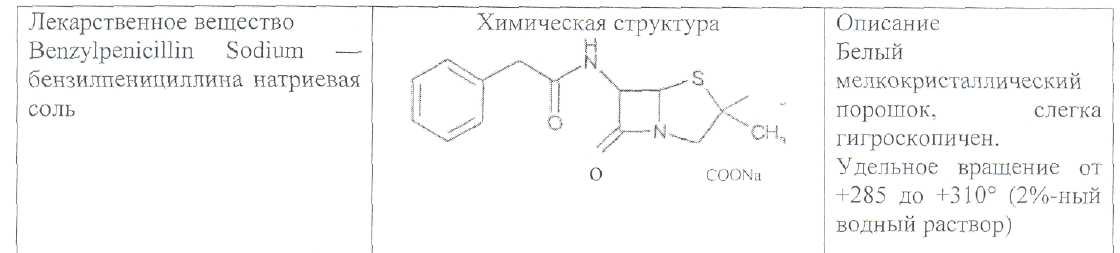 Подлинность природных и синтетических пенициллинов подтверждают с помощью УФ- и ИК-спектрофотометрии. Устанавливают значения оптических плотностей растворов солей бензилпенициллина при длинах волн 280 и 263 нм, разность между которыми должна быть не менее 0.72. ИК-спектры природных и полусинтетических пенициллинов идентифицируют по совпадению с полосами поглощения соответствующих стандартных образцов в области 4000— 400 см- . Подлинность бензилпенициллина натриевой соли устанавливают также методом ТСХ на силикагеле Н или пластинках Сорбфил с последующим проявлением в парах иода. Важная физическая константа пенициллинов — удельное вращение водных или спиртовых растворов. Все они вращают плоскость поляризованного света вправо. Химические реакции, используемые для испытаний подлинности пенициллинов. основаны на обнаружении в их молекулах различных функциональных групп, продуктов деструкции, атома серы, связанных аминов, катионов калия и натрия. Для испытания подлинности пенициллинов и их полусинтетических аналогов используют цветную реакцию, основанную на разрыве в-лактамного цикла с образованием внутрикомплексной соли меди (II) с гидроксамовой кислотой (осадок зеленого цвета) или железа (III) —- красное или фиолетовое окрашивание: 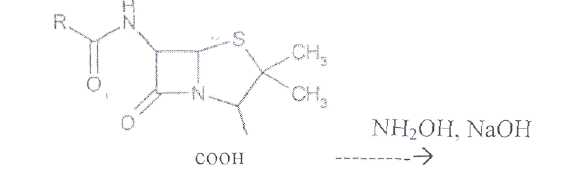 хлороводородной кислоты, то в осадок выпадает свободный бензилпенициллин, растворимый в избытке хлороводородной кислоты, а также в этаноле, хлороформе, эфире. 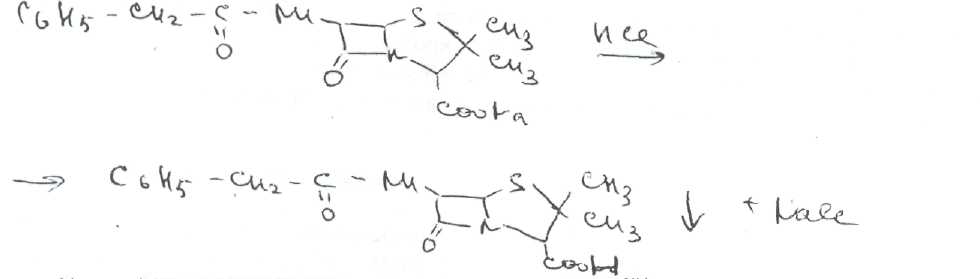 Соли бензилпенициллина при кипячении в 4%-ном растворе гидроксида натрия гидролизуются с образованием натриевой соли фенилуксусной кислоты, которая после добавления избытка разбавленной серной кислоты обнаруживается по характерному запаху.  Ьензилпенйциллин подвергает кислотному "Гидролизу до бензилпеницилленовой кислоты. Она вступает в реакцию сочетания с производным глютаконового альдегида, который образуется (рН 4.9) в результате расщепления пиридинового цикла пол действием тиоцианата хл°Ра- СсЛ<.- см..^^. - 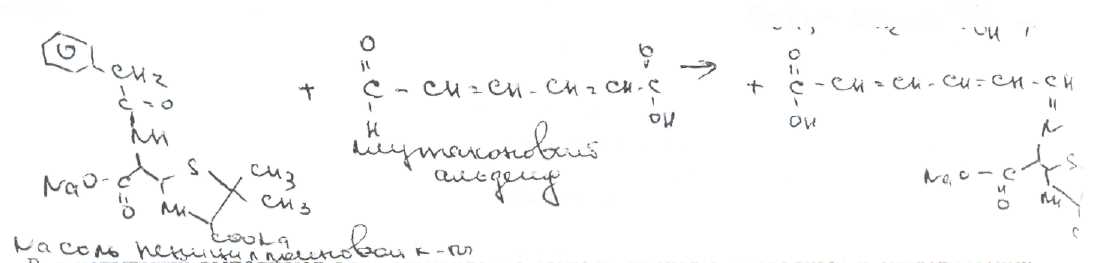 Г ял испытании выполняют для установления степени чистоты природных и синтетических пенициллинов. По величине оптической плотности растворов определяют светопоглощающие примеси. Выбор длины волны и допустимые значения оптической плотности зависят от химической структуры испытуемого пенициллина. В некоторых пенициллинах устанавливают допустимое ФС содержание иодсорбирующих примесей (0.5-6%) методом обратного иодометрического определения в фосфатном или ацетатном буфере. Природные и синтетические пенициллины испытывают на наличие воды (по методу К. Фишера) и устанавливают рН растворов или водных суспензий (потенциометрически). Испытание на токсичность Испытание проводят на здоровых белых мышах обоего пола массой 19—21 г. на которых ранее не проводили никаких испытаний. Для испытания на токсичность отбирают по 2 флакона или ампулы от каждой серии, -содержащей не более 10 000 флаконов или ампул. При количестве в серии флаконов или ампул более 10 000 отбирают по 3 флакона или ампулы от каждой серии. Для проведения испытания из отобранных флаконов или ампул готовят общий раствор (смешанная проба). Общее количество отобранного лекарственного средства должно быть достаточным для проведения трех полных испытаний.испытание на пирогенность Испытание проводят на здоровых кроликах обоего пола, не альбиносах, массой 2—3.5 кг, содержавшихся на полноценном рационе. Каждый кролик должен находиться в отдельной клетке в помещении с постоянной температурой. Колебания температуры не могут превышать ±3 °С. При уборке клеток и взвешивании животных их оберегают от возбуждения (избегать шума и резких движений). ОПРЕДЕЛЕНИЕ АНТИМИКРОБНОЙ АКТИВНОСТИ АНТИБИОТИКОВ МЕТОДОМ ДИФФУЗИИ В АГАР Определение антимикробной активности антибиотиков основано на их способности угнетать рост микроорганизмов. Определение проводят методом диффузии в агар на плотной питательной среде путем сравнения размеров зон угнетения роста тест-микробов, образующихся при испытании растворов определенных концентраций Государственного стандартного образца и испытуемого препарата. Антимикробная активность антибиотиков выражается в единицах действия — ЕД или «мгк». Для большинства антибиотиков 1 ЕД или «мкг» соответствуют 1 мкг активного вещества (кислоты или основания); для антибиотиков, имеющих иное количественное выражение единицы, соответствующие указания даются в частных статьях. При определении антимикробной активности антибиотиков используют стандартные образцы, активность которых, как правило, устанавливают в соответствии с Международными биологическими стандартами. При отсутствии последних для указанных целей могут быть использованы международные химические стандарты, антимикробную активность которых рассчитывают на основании показателей качества, установленных физико-химическими методами. Антимикробную активность стандартных образцов антибиотиков, не имеющих аналогов в международной коллекции стандартов, рассчитывают также на основании показателей качества, установленных физико-химическими методами. Стандартные образцы антибиотиков утверждаются и рассылаются Государственным научно-исследовательским институтом по стандартизации и контролю лекарственных средств Минздрава СССР, хранятся и используются в соответствии с рекомендациями, указанными на этикетке стандартного образца. Методы количественного определения пенициллинов Количественное определение пенициллинов выполняют химическими методами. В некоторых из них (натриевой, калиевой, новокаиновой солях бензилпенициллина. феноксиметилпенициллине и амоксициллине) сумму пенициллинов определяют иодометрическим методом. Сущность способа заключается в том, что продукт инактивации пенициллина (1 М раствором гидроксида натрия при комнатной температуре) — натриевую соль пенициллоиновой кислоты — окисляют иодом. Процесс окисления необходимо проводить при рН 4,5 (ацетатный буфер). Схема инактивации и окисления на примере бензилпенициллина: 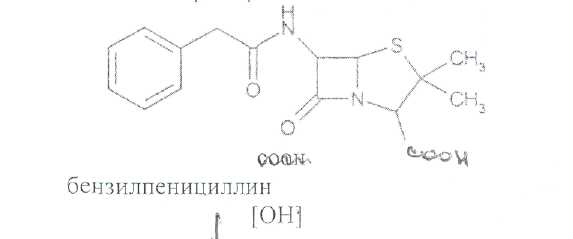 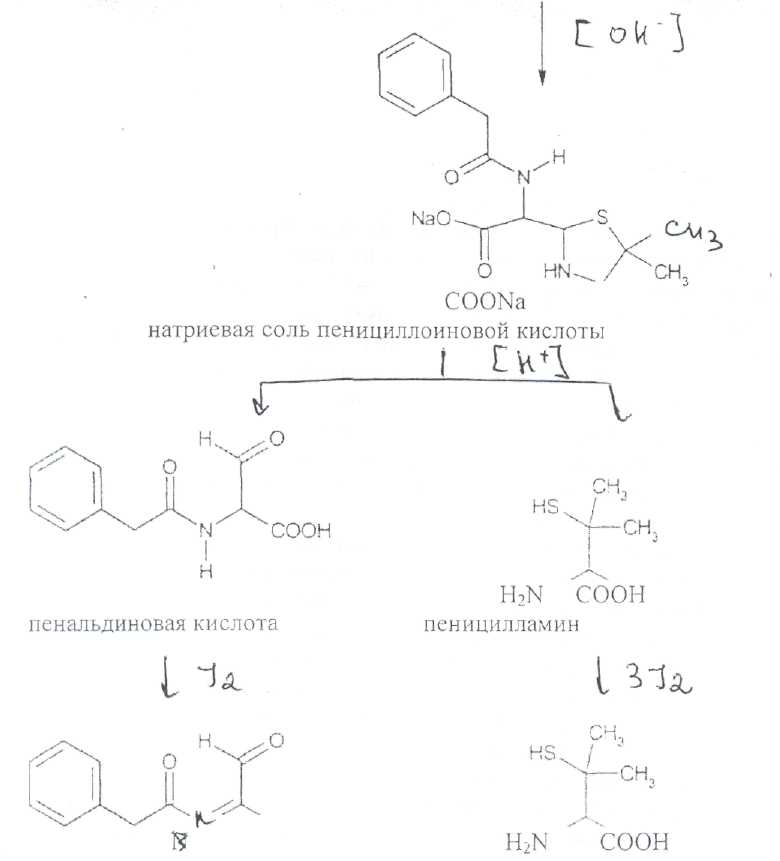 дегидропенальдиновая кислота пеницилламиновая кислота Определение суммы пенициллинов выполняют обратным иодометрическим методом. Избыток 0.01 N4 раствора иода оттитровывают раствором тиосульфата натрия той же концентрации после 20 мин пребывания ее в темном месте (индикатор крахмал). Одновременно проводят контрольный опыт с тем же количеством пенициллина, не подвергнутого щелочному гидролизу, а также иодометрическое определение соответствующего ГСО. Количественное определение натриевой соли бензилпенициллина выполняют гравиметрическим методом. Бензилпенициллин извлекают амилацетатом и количественно осаждают в виде N-этилпиперидиновой соли: 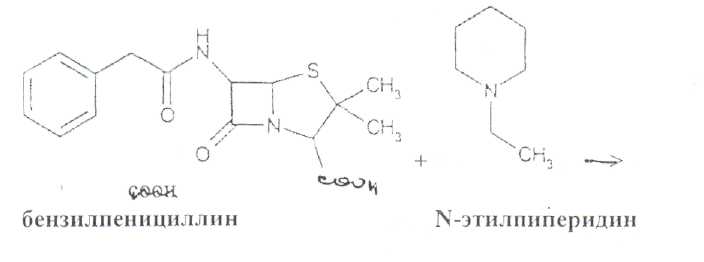 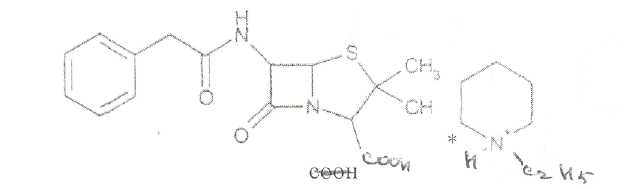 п-зшлпииеридиииъая ииль исыдишеницидлина Осадок N-этилпиперидиновой соли бензилпенициллина промывают, высушивают до постоянной массы и взвешивают. Затем делают пересчет на соответствующую соль. Активность пенициллинов устанавливают микробиологическим методом по антибактериальному действию на определенный штамм золотистого стафилококка. Одна единица действия соответствует активности 0,5988 мкг химически чистой натриевой соли бензилпенициллина (1670 ЕД в 1 мг). Микробиологический метод определения пенициллинов дает воспроизводимость результатов 5-10%. Этот метод приведен в ряде ФС как альтернативный вместе с химическим или спектрофотометрическим методом. Алкалиметрический метод определения суммы пенициллинов имеет удовлетворительную воспроизводимость, но дает завышенные результаты, так как одновременно титруются вес примеси, взаимодействующие со щелочью. Наиболее точные, сопоставимые с микробиологическим методом результаты дает спектрофотометрическое определение пенициллинов, основанное на их гидролизе до пеницилленовых кислот. Они имеют максимум светоп or лощения при 320-324 или 335 нм. Для определения бензилпенициллина натриевой соли, феноксиметилпенициллина соли МФ также рекомендовано спектрофотометрическое определение. Оно основано на взаимодействии раствора пенициллинов при нагревании на водяной бане с имидазолом и хлоридом ртути (II). Светопоглошение полученного раствора измеряют при 325 нм относительно смеси реактивов. Фотоколориметрические методы определения природных пенициллинов основаны на реакциях образования окрашенных гидроксаматов железа или меди. Пенициллины хранят по списку Б, в сухом месте, при комнатной температуре. Упаковывают соли бензилпенициллина во флаконы, герметически закрытые резиновыми пробками, обжатыми алюминиевыми колпачками. На воздухе, при повышении температуры, в присутствии влаги, тяжелых металлов они быстро разлагаются. Натриевая соли бензилпенициллина содержат в каждом флаконе по 125 000. 250 000, 500 000 и 1 000 000 ЕД: Природные пенициллины применяют для лечения пневмонии, гонореи, сифилиса, раневых и гнойных инфекций, перитонита, дифтерии, скарлатины, ангин различной этиологии и инфекционных заболеваний, вызванных чувствительными к пенициллину микроорганизмами. Полусинтетические аналоги имеют более широкий спектр антибактериального действия. В процессе использования антибиотиков к ним может развиваться устойчивость микроорганизмов (антибиотикорезистентность). Возможна так называемая перекрестная устойчивость, которая относится не только к применяемому препарату, но и к другим антибиотикам, сходным с ним по химическому строению (например, ко всем тетрациклинам). Вероятность развития устойчивости уменьшается, если дозы и длительность введения антибиотиков оптимальны, а также при рациональной комбинации антибиотиков. Если к основному антибиотику возникла устойчивость, его следует заменить другим, резервным, антибиотиком. |
