Мои ответы. Болезнь нарушение жизнедеятельности организма, вызванное действием чрезвычайных раздражителей, характеризуются снижением работоспособности, приспособляемости организма к условиям окружающей cреды и одновременным развитием не только патологических,
 Скачать 1.95 Mb. Скачать 1.95 Mb.
|
|
Дисфагия (от греч. dys- затруднение, нарушение и phagein-есть, глотать) – расстройство глотания, (перехода пищевого комка из полости рта в полость желудка). Обычно возникает в результате расстройств жевания, повреждения зубо-челюстного аппарата, глотательных мышц, сужения просвета пищевода, а также нарушений либо афферентации от окончаний тройничного, гортанного и языкоглоточного нервов, либо деятельности центра глотания продолговатого мозга, находящегося под контролем среднего мозга и коры больших полушарий, либо эфферентации по тройничному, языкоглоточному, подъязычному и блуждающему нервам. Может нарушаться как произвольное глотание (ротовая фаза с участием соматической нервной системы и мышц языка, его передней, средней и корневой частей), так и непроизвольное глотание (быстрая глоточная и медленная пищеводная фазы с участием парасимпатических, симпатических и метасимпатических структур автономной нервной системы). При расстройстве быстрой глоточной фазы, реализуемой с участием мышц глотки, пищевой комок может поступать обратно в полость рта, а также в носовые ходы и другие дыхательные пути. При нарушении медленной пищеводной фазы может задерживаться не только открытие глоточно-пищеводного, но и нижнего пищеводного (кардиального) сфинктера, а также перемещение пищевого комка по просвету пищевода с участием перистальтических сокращений его циркулярных и продольных гладких мышц. 61. Патология желудка. Нарушение секреторной и моторной функции желудка. Как известно, желудок выполняет резервуарную, секреторную, моторную, всасывательную и выделительную функции.Как резервуар, он является местом, где скапливается поступившая при глотании пища. Резервуарная функция тесно связана с моторной функцией желудка, ответственной за перемешивание и продвижение желудочного содержимого в 12-перстную кишку. Железами желудка секретируется в сутки 2-3 л желудочного сока. В его состав входят пепсиноген (вырабатывается главными клетками), соляная кислота - (вырабатывается обкладочными клетками), «запускает» процесс перехода пепсиногена в пепсин, расщепляющий все белки; слизистыми клетками вырабатывается слизь, имеющая защитное для эпителиальных клеток желудка значение. G-клетками антрального отдела желудка при раздражении блуждающего нерва вырабатывается сильнейший возбудитель секреции свободной HCI гастрин. Хотя показано, что, очевидно, непосредственным фактором, вызывающим секрецию соляной кислоты, является гистамин. При патологии может наблюдаться: 1. Гиперсекреция желудочного сока, (увеличено часовое напряжение секреции) обычно сопровождающаяся гиперхлоргидрией (повышением уровня свободной HCI). Это наблюдается при язвенной болезни 12-пер-стной кишки, пилороспазме, пилоростенозе, после приема алкоголя, горячей пищи, некоторых лекарственных препаратов (салицилаты, глюкокортикоиды и др.).2.Гипосекреция желудочного сока, (снижено часовое напряжение секреции) часто сочетающаяся с гипо- или даже ахлоргидрией (гипо- анацидные состояния). 3.Гиперацидное состояние (гиперхлоргидрия) – повышение кислотности желудочного сока. 4.Гипоацидное состояние (гипохлоргидрия) – понижение кислотности желудочного сока. 5.Анацидное состояние (ахлоргидрия) – отсутствие соляной кислоты в желудочном соке. 6.Ахилия – отсутствие соляной кислоты и пепсина в желудочном соке. Такие состояния наблюдаются при атрофических гастритах, раке желудка и пр. Нарушения моторики желудка могут проявлять себя в двух формах:а). В виде гипокинеза (снижение перистальтики) и гипотонии, вплоть до атонии (потеря мышечного тонуса), что наблюдается при атрофии его мышечной стенки, нередко -при воспалительных заболеваниях желудка (гастриты), при развитии опухоли желудка. В этом случае характерно застаивание пищи в желудке, что часто сочетается с резким снижением секреции желудочного сока, с ахилией. При этом в желудке может размножаться разнообразная микрофлора, начинаются процессы брожения (а иногда и гниения). б). В виде гиперкинеза (усиление перистальтики) и гипертонии (повышение тонуса мышц желудка), чему способствует грубая пища, алкоголь. Эти явления могут наблюдаться при язвенной болезни желудка, некоторых видах гастрита и др. Усиливает моторику желудка и гастрин. Спастические сокращения мышц желудка могут стать источником боли. 62.   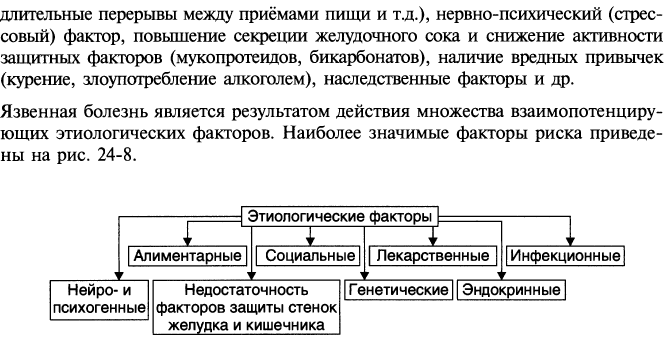    63. Патология кишечника. Нарушение секркторной и моторной функций. Нарушение секреторной функции кишечника: 1. 12-перстная кишка..А.Нарушение желчеотделения . Причины:- закупорка желчных протоков, - сдавление их (опухоль головки поджелудочной железы), - дискинезия желчевыводящих путей.Последствия гипохолии (уменьшение желчеотделения):1. Нарушение переваривания и всасывания жиров (в результате недостатке желчных кислот, которые эмульгируют жиры и активируют липазу).2. Уменьшение перистальтики кишечника.3. Нарушение всасывания жирорастворимых витаминов.4. Активация Гр”-” микрофлоры кишечника (т.к. желчные кислоты в норме оказывают бактерицидное действие). Б. Нарушение поступления в 12-перстную кишку панкреатического сока:1. Дуоденит 2. Закупорка или сдавление протока.3. Опухоль.4. Панкреатиты.5. Аутоиммунные процессы. Последствия:Нарушение переваривания жиров, белков и углеводов. Расстройства моторной функции кишечника:1. Повышение:усиление перистальтики, диарея.Причины:- воспалительный процесс в кишечнике - повышение возбудимости рецепторов кишечной стенки,- недоброкачественная пища,- повышение тонуса n/ vagus.,- эффектные состояния ЦНС (испуг, страх). 2. Ослабление: снижение перистальтики, запоры (обстинация) .запоры: А.Спастические (при повышении тонуса сфинктеров), Б. Атонические (при снижении перистальтики. Причины атонических запоров:пища с минимумом клетчатки, гиповитаминоз В1, органические изменения в строении кишечной стенки (болезнь Гиршпрунга). Кишечная непроходимость:1) Механическая:рост опухоли, рубцовое сдавление, заворот кишечника, инвагинация, спаечная болезнь. 2) Динамическая:спазм кишечной мускулатуры, паралич кишечной мускулатуры. 3) Вследствие нарушения кровоснабжения участка кишечника. НАРУШЕНИЕ ВСАСЫВАНИЯ. Всасывание зависит от:секреции, моторики, пристеночного пищеварения. Пристеночное пищеварение - этап между полостным пищеварением и всасыванием.Причины расстройства пристеночного пищеварения:1. Нарушение структуры ворсинок и поверхностного дыхания тонкой кишки (при дизентерии, холере).2. Изменение ферментативного слоя кишечной поверхности (при гипохолии).3. Расстройства моторики кишечника.4. Недостаточность полостного пищеварения. 64. Поджелудочная железа. патофизиологические механизмы развития острого и хронического панкреатита. Острый панкреатит развивается при нарушении оттока панкреатического сока (дискинезия протоков), проникновении желчи в выводной проток железы (билиопанкреатический рефлюкс), отравлении алкоголем, алиментарных нарушениях (переедание) и др. Изменения железы сводятся к отеку, появлению бело-желтых участков некроза (жировые некрозы), кровоизлияний, фокусов нагноения, ложных кист, секвестров. При преобладании геморрагических изменений, которые становятся диффузными, говорят о геморрагическом панкреатите, гнойного воспаления—об остром гнойном панкреатите, некротических изменений — о панкреонекрозе. Хронический панкреатит может быть следствием рецидивов острого панкреатита. Причиной его являются также инфекции и интоксикации, нарушения обмена веществ, неполноценное питание, болезни печени, желчного пузыря, желудка, двенадцатиперстной кишки. При хроническом панкреатите преобладают не деструктивно-воспалительные, а склеротические и атрофические процессы в сочетании с регенерацией ацинозных клеток и образованием регенераторных аденом. Склеротические изменения ведут к нарушению проходимости протоков, образованию кист. Рубцовая деформация железы сочетается с обызвествлением ее ткани. Железа уменьшается, приобретает хрящевую плотность. При хроническом панкреатите возможны проявления сахарного диабета. Смерть больных острым панкреатитом наступает от шока, перитонита. 64. Нарушение внешнесекреторной функции поджелудочной железы. По мере прогрессирования воспалительного процесса в поджелудочной железе у пациентов с хроническим панкреатитом происходит постепенное замещение железистой (секреторной) ткани органа соединительной, или рубцовой. Как результат, в поджелудочной железе уменьшается численность секреторных (ацинарных) клеток, которые в физиологических условиях в ответ на поступление пищи в просвет двенадцатиперстной кишки выделяют в кишечник богатый пищеварительными ферментами и щелочью секрет (панкреатический сок). Он содержит весь спектр ферментов, способных переваривать белки, жиры, углеводы, но только липаза, фермент, обеспечивающий в присутствии желчи расщепление жира до жирных кислот и мыл, в пищеварительном тракте не имеет значимых «дублеров». А потому в условиях снижения численности секреторных клеток более вероятной становиться ситуация, когда количество выделившегося в просвет двенадцатиперстной кишки сока окажется недостаточным для процесса переваривания и последующего всасывания, прежде всего жиров и жирорастворимых витаминов, а только затем белков, углеводов. Это состояние специалисты называют внешнесекреторной недостаточностью поджелудочной железы. Дальнейшее прогрессирование воспалительно-рубцовых изменений поджелудочной железы может обусловить присоединение нарушений эндокринной функции органа с развитием сахарного диабета. Клинические проявления Наиболее типичным проявлением внешнесекреторной недостаточности поджелудочной железы является плохая переносимость жирной пищи, особенно жареной и копченой. Как следствие, появление после ее потребления чувства тяжести в животе и обильного кашицеобразного «жирного» стула, так называемая панкреатическая стеаторея (выделение с калом жира). Частота испражнений обычно не превышает 3-6 раз в сутки. Достаточно простым и легко определимым критерием повышенной «жирности» кала является его способность оставлять следы на унитазе, которые плохо смываются водой. Возможно появление вздутия живота и коликообразной боли в нем. Ограничение приема жирной пищи, прием пищеварительных ферментов (см. ниже) способствует снижению выраженности указанных признаков и даже их исчезновению. Проявлениями дефицита жирорастворимых витаминов в организме могут быть боли в костях, повышенная их ломкость и склонность к судорожным сокращениям мышц (гиповитаминоз D), нарушения в системе свертывания крови в виде кровоточивости (гиповитаминоз К), расстройства сумеречного зрения, или «куриная слепота», повышение сухости кожи (гиповитаминоз А), склонность к инфекциям, снижение либидо, потенции (гиповитаминоз Е). Бледность кожных покровов, одышка, учащенное сердцебиение, быстрая утомляемость, снижение работоспособности и другие признаки В12-дефицитной анемии могут наблюдаться вследствие нарушения усвоения поступающего с пищей соответствующего витамина из-за недостатка панкреатических протеаз (ферментов, расщепляющих белки). Снижение массы тела, как следствие недостаточного поступления питательных веществ, указывает на выраженную внешнесекреторную недостаточность поджелудочной железы. 65. Расстройство желчеобразования и желчевыделения. Желтухи (механическая, паренхиматозная, гемолитическая), патофизиологические механизмы. Нарушение желчеобразования и желчевыделения отмечают при различных процессах — болезнях печени, желчного пузыря, инфекционных заболеваниях, болезнях крови и др. При этом нарушается и пигментный обмен. Процесс образования желчных пигментов в основном происходит в клетках РЭС из гемоглобина разрушенных эритроцитов, то есть это чисто экскреторный процесс. Вначале образуется непрямой (белковый) билирубин, который током крови переносится к клеткам печени, где освобождается от белка и в соединении с глюкуроновой кислотой превращается в прямой (безбелковый) билирубин. Этот билирубин с желчью поступает в кишечник, где путем окисления превращается вначале в уробилин, а потом в стеркобилин, который и выводится с мочой и калом. Наиболее характерные нарушения пигментного обмена, желчеобразования и желчевыделения отмечаются при желтухе. Желтуха — симптомокомплекс, развивающийся при поражении печени и желчных путей и сопровождающийся желтым окрашиванием кожных покровов и слизистых оболочек, связанным с отложением в них желчных пигментов. Возникновению желтухи всегда предшествует билирубинемия. В зависимости от происхождения различают три вида желтух: Механическая — следствие затруднения или прекращения оттока желчи из печени в двенадцатиперстную кишку (воспаление и набухание слизистых оболочек желчных путей или двенадцатиперстной кишки). Накопление желчи приводит к давления в желчных путях, растяжению и разрыву желчных капилляров, наполнению печеночных клеток желчью и их гибели. Желчь изливается в лимфатические щели и поступает в общий круг кровообращения. при этом виде желтухи развивается не только билирубинемия, но и билирубинурия (вывод почками прямого билирубина). Непоступление желчи в кишечник приводит к тому, что в моче уменьшается или полностью исчезает уробилин, а в кале — стеркобилин. Каловые массы обесцвечиваются (белесые). Накопление в крови солей желчных кислот вызывает общее возбуждение с последующим угнетением центральной нервной системы, понижением возбудимости периферических рецепторов и болевой чувствительности. Частыми симптомами являются кожный зуд, который возникает в результате раздражения нервных окончаний кожи солями желчных кислот, а также понижение артериального давления и свертываемости крови, урежение работы сердца, гемолиз форменных элементов крови. Все эти признаки возникают из-за сильной токсичности желчи. Токсичность ее во много раз превышает токсичность мочи. При введении желчи под мозговые оболочки развиваются эпилептические судороги, а под кожу — некроз. Вследствие гибели печеночных клеток механическая желтуха при известных условиях может стать причиной паренхиматозной желтухи. Паренхиматозная (печеночная, инфекционно-токсическая) желтуха вызывает не только функциональные, но и морфологические изменения печеночных клеток. Поэтому нарушается не только пигментный, но и другие виды обменов, а также антитоксическая и барьерная функции печени. Отмечаются билирубинемия, билирубинурия и уробилинурия. Присутствие в крови желчных кислот (в результате внутрипеченочной закупорки) обусловливает появление симптомов, свойственных для механической желтухи. Наблюдают эту желтуху при некоторых инфекционных процес-» сах (болезнь Боткина, пневмония, тиф), отравлениях фосфором, хлороформом, мышьяком, эфиром и другими ядами. Гемолитическая желтуха — следствие усиленного разрушения эритроцитов при некоторых инфекционных и кровепа-разитарных заболеваниях, а также отравлениях гемолитическими ядами (мышьяк, фенилгидразин, змеиный яд и др.). При усилен-^ ном распаде эритроцитов в крови повышается кол-во непрямого билирубина. Происходит это потому, что печень не в состоянии обра7 ботать такое большое кол-во билирубина из-за снижения жел-» чеобразовательной функции печени. Желчеобразовательная спо-; собность печени понижается потому, что непрямой билирубин, как', токсичное вещество, вызывает поражение печеночных клеток. Почками непрямой билирубин не выводится. При наличии большого, кол-ва в крови непрямого билирубина в кишечник с желчью поступает и повышенное кол-во прямого билирубина, поэтому больше образуется уробилина и стеркобилина — отмечается уроби-1 линурия, а каловые массы имеют интенсивную окраску. При этой форме желтухи нарушается только пигментный обмен, так как желчные кислоты и холестерин в крови не накапливаются.    НЕТ ТАКОГО. Основные синдромы при патологии печени – причины, механизмы развития, проявления. Нарушения функции печени (метаболической, антитоксической). Синдромы цитолиза, холестаза, мезенхимально-воспалительный. В зависимости от характера патологического процесса в печени и использования различных лабораторных методов исследования выделяют следующие основные клинико-бихимические синдромы. Воспалительный синдром. Возникает при воспалении перилобулярных желчных ходов (холангиолитах) и междольковых желчных протоков (холангитах), а также кровеносных сосудов, желчных канальцев, гепатоцитов, эндотелиоцитов и соединительно-тканных структур. В патогенезе важное место в его развитии занимает сенсибилизация иммунокомпетентных образований и активация макрофагально-гистиоцитарной системы. Синдром характеризуется повышением в сыворотке крови содержания γ-глобулинов, особенно IgG, IgM и IgA, иногда гиперпротеинемией, появлением различных неспецифических антител и положительных белково-осадочных проб (тимоловой, сулемовой, формоловой). Синдром холестаза. Обусловлен нарушением процесса желчевыделения. Различают внутрипеченочный и внепеченочный холестаз. Первый обусловлен нарушением образования желчной мицеллы и поражением мельчайших желчных ходов. Второй связан с нарушением оттока нормальной желчи в результате механических препятствий во внепеченочных желчных путях. Обе формы холестаза сопровождаются повышением в крови: 1) активности экскреторных ферментов (щелочной фосфатазы, γ-глютамилтранспептидазы, 5'-нуклеотидазы, β-глюкуронидазы), 2) содержания холестерина, фосфолипидов, желчных кислот, 3) уровня билирубина (г.о. его конгъюгированной формы). Синдром цитолиза. Обусловлен нарушением целостности гепатоцитов, повышением проницаемости мембран клеток и их органелл. Возникает при острых и хронических повреждениях печени (гепатотропными вирусами, токсическими веществами, лекарствами и др.). В патогенезе деструкции гепатоцитов и их мембран важное значение имеют активация лизосомальных гидролаз, расстройства окислительных процессов, дефицит кислорода, избыток свободных радикалов и перекисей, флогогенных факторов, аутоантител, сенсибилизированных Т-лимфоцитов, острый недостаток энергетических веществ и нарушение синтеза белков. Синдром характеризуется повышением в крови активности индикаторных ферментов (аспартат- и аланинаминотрансферазы, лактадегидрогеназы, альдолазы), уровня билирубина (г.о. его неконъюгированной формы) и снижение активности секреторных ферментов (холинэстразы, церулоплазмина, проантикоагулянтов). 66. нарушение обмена веществ при патологии печени. Нарушение обмена веществ при патологии печени. Нарушение обмена белков.В печени происходит биосинтез белка: до 100% от всей массы альбуминов и до 80% - гамма-глобулинов, в том числе таких жизненно важных, как протромбин и фибриноген, проконвертин, проакцелерин, принимающих участие в свертывании крови. В печени происходит образование из аммиака мочевины, дезаминирование и переаминирование аминокислот, катаболизм нуклеопротеидов с их расщеплением до аминокислот, пуриновых и пиримидиновых оснований. Белоксинтезирующие процессы в гепатоцитах обеспечивают рибосомы, но для метаболизма гепатоцита синтез белка и ферментов осуществляет свободные рибосомы и полисомы, а для других целей – рибосомы, связанные с мембранами эндоплазматической сети. В связи с тем, что гепатоцитах нарушается связь рибосом с микросомами, а также в последующем подвергаются диструкции и свободные рибосомы, - в печени нарушается белоксинтезирующая функция. Это связано как с нарушением синтеза белка, так и со снижением дезаминирования, переанимирования. В результате аминокислоты не усваиваются организмом, а накапливаются в крови и выводятся с мочой. При патологии печени в моче также содержится мочевая кислота – конечный продукт обмена нуклеотидов и аммиака – промежуточный продукт белкового обмена. Аммиак является токсичным веществом для организма. Его детоксикация происходит в эндоплазматической сети гепатоцита, через орнитиновый цикл, где он преобразуется в мочевину. При нарушении этой функции печени (недостаток АТФ, фрагментация эндоплазматической сети) в крови резко возрастает содержание аммиака, что приводит к возбуждению центральной нервной системы, при этом появляются судороги, развивается гепатоцеребральная недостаточность и печеночная кома. Нарушение обмена углеводов. Достаточно напомнить, что печень – почти единственный орган, который фиксирует углеводы (такую же функцию выполняют мышцы) в виде гликогена до 4% от своей массы. Благодаря гликогенезу, глюконеогенезу, гликолизу в крови животных поддерживается генетически запрограммированный уровень сахара. Существуют различные патологические состояния, связанные с нарушением процесса фиксации гликогена в организме (агликогенозы), или наоборот, гликоген откладывается в большом количестве, но из-за отсутствия определенных ферментов расщепляться не может (гликогеноз). Такие состояния описаны у крупного рогатого скота (генерализованный гликогеноз). При патологии в печени в организме нарушаются и синтез, и расход углеводов. Следовательно , как пороговое вещество глюкоза появляется в моче (глюкозурия). В печени меньше образуется АТФ, что снижает биосинтетические и пластические процессы. К недостатку глюкозы в организме наиболее чувствительна нервная система, в результате возникает гипогликемическая кома (нарушается координация движений, появляется тремор отдельных групп мышц, животное падает, и без оказания врачебной помощи возможна его гибель). Нарушение обмена липидов. Исключительно важно значение печени в липидном обмене: в ней происходит гидролиз триглицеридов на глицерин и жирные кислоты, насыщение, окисление жирных кислот до кетоновых тел, осуществляется метаболизм холестерола, синтез и выведение липопротеидов различной плотности. В норме в печени может содержаться от 8 до 20% жира от массы органа, а при патологии – более 30%. Это отмечается при кетозе, липидозе, сахарном диабете, недоброкачественном кормлении с включением в рацион технических жиров, попадании токсинов. Для обеспечения энергетических потребностей организма при патологии печени усиливается кетогенез (образование кетоновых тел).В крови накапливаются кетоновые тела, и возникает кетоз (симптомокомплекс, характеризующийся дистрофией печени, накоплением кетоновых тел в крови и выделением их с молоком и мочой). Из-за нарушения структуры митохондрий, недостатка АТФ и метаболитов цикла трикарбоновых кислот кетоновые тела не утилизируются. Более того, структурные изменения в гепатоцитах приводят к нарушению синтеза и выделению из печени липопротеидов, ослаблению окисления жирных кислот. В этом случае в них из крови не включается холестерол. В печень поступает больше эндогенного жира, и в ней нарушается протоплазматическая структура, развивается жировая инфильтрация, а затем дистрофия. Нарушение обмена витаминов.Жирорастворимые витамины всасываются в кровь при наличии желчи в кишечнике, а водорастворимые – депонируются или чачтично синтезируются в печени. Нарушение желчевыделительной функции печени приводит к уменьшению всасывания витаминов гиповитаминозам. Более того, витамины входят в состав коферментов, и при их недостатке совращается обмен веществ. Достаточно сказать, что при гепатозе, гепатите, циррозе рекомендуют вводить почти все витамины и витаминоподобные вещества (холин, инозин, липоевая, оротовая, пангамовая кислоты, незаменимые жирные кислоты). Нарушение обмена микроэлементов.Многие микроэлементы входят в состав гормонов, ферментов и таким образом активно участвуют в обмене веществ. При функциональной недостаточности печени нарушается депонирование и соединение их с белками. 67. печеночная недостаточность. Печеночная недостаточность (ПН) – снижение одной или нескольких функций печени ниже уровня, необходимого для нормальной жизнедеятельности. Причины ПН. 1.Первичные поражения печени. ПН вызывают патологические процессы, локализованные в самой печени: инфекции, интоксикации, опухоли, отложения солей (камни), нарушение питания (белковая и витаминная недостаточность) генетические дефекты гепатоцитов.2.Вторичные поражения печени. Патологические процессы наблюдаемые в других органах и системах организма приводят к ПН: шок, сердечная недостаточность, общая гипоксия, почечная недостаточность, эндокринопатии, (диабет) метастазы опухолей в печень. Проявления ПН. Нарушение всех видов обмена:1. Углеводный обмен – неустойчивый уровень сахара в крови – после приема пищи – гипергликемия, натощак – гипогликемия. 2. Жировой обмен: снижение образования и выделения желчи ведет к нарушению расщепления и всасывания жиров в ЖКТ; гиперхолестеринемия и снижение липопоротеидов высокой плотности способствует атеросклерозу. 3. Нарушение белкового обмена: снижение синтеза альбуминов гипоонкия крови отеки; снижение синтеза прокоагулянтов кровоточивость; снижение синтеза мочевины и увеличение концентрации аммиака в крови. 4. Нарушение обмена витаминов: снижение всасывания жирорастворимых витаминов (А, Д, Е, К) из кишечника; нарушения превращения провитаминов в витамины (каротин в витамин А); нарушение превращения витаминов в коферменты (пантотеновой кислоты в ацетил коэнзим А). Нарушению обмена витаминов приводит к эндогенному авитаминозу. Нарушение антитоксической функции печени приводит к накоплению в организме ядовитых продуктов: Кишечных ядов – фенольных ароматических соединений (фенол, индол, скатол), биогенных аминов (кадаверин, путресцин, тирамин), аммиака. Ядовитых метаболитов: низкомолекулярных жирных кислот (валериановой, капроновой), токсического производного пирувата – ацетоина. Экзогенных ядов: грибкового, микробного происхождения, ядохимикатов. Снижается инактивация клетками Купфера коллоидных частиц и микроорганизмов.В терминальной стадии печеночной недостаточности в организме развивается печеночная кома. (ПК). Причиной развития ПК считают отравление ЦНС ядовитыми веществами. Эти вещества накапливаются в организме вследствие выпадения антитоксической функции печени. Для ПК характерны нарастающая печеночная желтуха, повышение температуры тела, метаболический ацидоз, признаки выраженной интоксикации, расстройства дыхания и функции сердечно-сосудистой системы.По механизму развития выделяют два варианта печеночной комы: шунтовую и печеночно-клеточную.Шунтовая ПК кома развивается как следствие цирроза печени и портальной гипертензии. Портальная гипертензия - это повышение давления в системе портальных сосудов, связанное с нарушением в них кровотока Стойкая портальная гипертензия приводит к развитию портоковальных анастомозов (через геморроидальные, пищеводные, пупочные вены). По этим анастомозам кровь, оттекающая из ЖКТ, сбрасывается в общий ток крови, минуя печень. Данная форма ПК часто возникает после приема пищи богатой белками, и не сопровождается выраженной печеночной желтухой.Печеночно-клеточная кома возникает при массивном некрозе печеночных клеток, когда существенно снижается гомеостатическая и барьерная функции печени. Для нее характерна гипогликемия, гипопротеинемия, гипераминоацидемия, накопление аммиака. Аммиак нарушает работу цикла трикарбоновых кислот, так как связывается с -котоглютаровой кислотой с образованием глутаминовой кислоты. Это резко снижает процессы окисления в нервных клетках и приводит к дефициту АТФ. Нарушаются процессы желчеобразования и развивается выраженная печеночная желтуха. Дефицит прокоагулянтов приводит к развитию геморрагического синдрома. 68. общие причины и механизмы возникновения и развития почечной патологии. Нарушение клубочковой фильтрации и канальцевой реабсорбции. ПАТОЛОГИЯ ПОЧЕК И МОЧЕВЫВОДЯЩИХ ПУТЕЙ Патологию почек вызывают первичные и вторичные причины. Первичные, или наследственные, формы патологии обусловлены нарушением синтеза ферментов (ферментопатии) Цистинурия. Аминоацидурия. тубулопатии (поражение канальцев почек). Почечный несахарный диабет. аномалии развития почек (поликистоз, удвоенная почка, семейная дисплазия почек) Вторичные, или приобретенные, причины: биологические факторы, т.е. инфекции (бактерии, вирусы, риккетсии), химические (сулема, ртуть), лекарственные вещества (антибиотики, сульфаниламиды) физические (переохлаждение, травма, лучевые воздействия), иммунопатологические факторы. камни, опухоли ухудшение почечного кровообращения осложнения других заболеваний (гипертоническая болезнь, сахарный диабет) аллергия и аутоаллергия Общие механизмы возникновения и развития патологии почек Нарушения мочеобразования почками являются результатом расстройств процессов фильтрации, реабсорбции и экскреции. Расстройства фильтрации плазмы крови в клубочках могут быть обусловлены снижением или увеличением объема фильтрации плазмы крови. Снижение объема фильтрации плазмы крови происходит в результате: понижения фильтрационного давления в клубочках при коллапсе, артериальной гипотензии, ишемии почек, задержке мочи в мочеточниках или мочевом пузыре; уменьшения площади клубочкового фильтра при некрозе части почки или склерозе клубочков при хронических гломерулонефритах; снижения проницаемости мембран клубочков вследствие их склероза, например при сахарном диабете или амилоидозе. Увеличение объема фильтрации плазмы крови обусловлено: повышением фильтрационного давления в клубочках, например увеличении тонуса ГМК выносящих артерий под влиянием избытка катехоламинов. Пг; при феохромоцитоме или ангиотензина при ишемии почек, при гипоонкии – печеночная недостаточность, голодание. увеличением проницаемости клубочкового фильтра, например при воспалении в клубочках или в строме, под влиянием БАВ гистамина, кининов, гидролитических ферментов. Нарушение функции канальцев. Нарушение процессов реабсорбции, экскреции и секреции в канальцах может сопровождаться расстройствами водно-электролитного обмена, кислотно-основного равновесия, обмена глюкозы, аминокислот, гормонов. Снижение канальцевой реабсорбции может быть следствием: генетических дефектов ряда ферментов эпителия канальцев; гиалиново-капельной дистрофии эпителия канальцев. При преимущественном повреждении проксимальных отделов нефрона нарушается реабсорбция органических соединений (глюкозы, аминокислот, белка, мочевины, лактата), а также бикарбонатов, фосфатов, ионов хлора, калия. При повреждении дистальных отделов почечных канальцев расстраиваются процессы реабсорбции натрия, калия, магния, кальция, воды. Нарушение процессов экскреции эпителием канальцев ионов калия, водорода, ряда метаболитов, экзогенных веществ может наблюдаться при гломерулонефритах, пиелонефрите, ишемии почек. 69. Мочевой синдром (протеинурия, гематурия, лейкоцитурия, цилиндрурия) при различных заболеваниях Гематурия. Под ней понимают появление в моче либо свежих (неизмененных), либо выщелоченных (измененных) эритроцитов. Различают почечную и внепочечную гематурию. Почечная гематурия возникает в результате повреждения клубочков. (мальпигиевых телец), а также канальцев почек. Развивается при нефритах, нефрозах, травмах, опухолях, гемофилиях, капилляротоксикозах. Для нее характерно наличие в моче выщелоченных эритроцитов. Она часто сочетается с протеинурией, является стойкой (эритроциты постоянно обнаруживаются во всех трех порциях мочи при проведении трех стаканной пробы). Внепочечная гематурия возникает вследствие альтеративных изменений мочевыводящего аппарата. Встречается при мочекаменной болезни (слизистые лоханки, мочеточников, мочевого пузыря, уретры повреждаются разнообразными камнями), при воспалительных процессах, опухолях и др. Для неё характерно наличие в моче свежих эритроцитов, которые обнаруживаются в отдельных порциях мочи. Данная гематурия не стойкая (проходит после ликвидации воспалительного процесса), может как сочетаться, так и не сочетаться с протеинурией. Следует отметить, что с суточной мочой здорового человека постоянно выделяются свежие эритроциты (до 0,5-2 млн.). Протеинурия.. Она сопровождается увеличением сверх нормального (то есть больше 60-80 мг/сут) количества белков (как альбуминов, так и глобулинов). Обычными лабораторно-клиническими методами количество белка в моче здоровых людей не определяется, хотя обычно достигает 60-80 мг/сут. Различают следующие виды протеинурии: 1) физиологическую (функциональную) – до 0,1 г/л, 2) патологическую (почечного и внепочечного происхождения) – свыше 0,1 г/л. Физиологическая протеинурия характеризуется, главным образом, альбуимнурией, а также - и - (но не -) глобулинурией. Она возникает при повышенной мышечной работе, ортостатической пробе (принятии вертикального положения из горизонтального), выраженном лордозе у детей и юношей, дегидратации организма (усиленное потоотделение при повышении температуры окружающей среды), охлаждении организма, приеме большого количества белковой пищи и др. Важно отметить, что физиологическая протеинурия исчезает вскоре после устранения причины, вызвавшей ее. Патологическая протеинурия, сопровождающаяся повышенным выделением различных белков (альбуминов,1-, 2-, 1-, 2-, -глобуллинов). Она может быть трех видов: 1) ренальной, 2) преренальной, 3) постренальной. Ренальная протеинурия возникает при нефротическом или нефритическом синдроме в результате повреждения соответственно клубочков (базальной мембраны, подоцитов, эндотелия клубочковых капилляров) или эпителиальных клеток канальцев (так называемая тубулярная протеинурия). Преренальная протеинурия возникает при расстройствах общего кровообращения (сердечной и/или сосудистой недостаточности), приводящих к уменьшению доставки крови к почкам или затруднению оттока от последних; усиленном образовании патологических белков (например, при миеломной болезни и др.) и их выделении из организма; при подвижной почке, приводящей к перекручиванию сосудов почки и развитию гипоксии почки (с включением ренальных механизмов); при гемолизе эритроцитов, сопровождающимся гемоглобинурией. Постренальная протеинурия сопровождается выделением белка из клеток мочевыводящих путей (мочеточников, мочевого пузыря, мочеиспускательного канала), предстательной железы, семявыносящих протоков, при их воспалении, повреждении, опухолях. С клинической и патофизиологической точек зрения протеинурия может быть: 1) постоянной и преходящей, 2) немассивной и пассивной (0,1 г/кг массы тела и более за сутки). Важно отметить, что массивная протеинурия является не только показателем поражения почек, но и имеет самостоятельное клиническое значение. Ибо при этом развивается выраженная гипопротеинемия и изменяется белковый спектр сыворотки крови, которые приводят к различным расстройствам в организме. Цилиндрурия. Цилиндры - единственные элементы мочи только почечного происхождения. Они представляют из себя белковые слепки канальцев почек. Различают следующие виды цилиндров: 1) Стекловидные (гомогенные, гиалиновые) цилиндры – это свернувшиеся в трубочку белки. Это особая форма протеинурии. Их наличие в моче свидетельствует о повышенной проницаемости как клубочков, так и канальцев. Образование этих цилиндров зависит не только от интенсивности выделения белков с мочой, но и от условий, способствующих свертыванию белка - желтуха, изменение рН крови и тканей. 2) Зернистые (это гиалиновые цилиндры, содержащие распавшиеся эпителиальные клетки канальцев). 3) Эритроцитарные и лейкоцитарные (это гиалиновые или зернистые цилиндры с адгезированными к их поверхности эритроцитами и лейкоцитами). 4) Эпителиальные (состоят из спущенных клеток эпителия канальцев почек). 5) Жировые (состоят из дегенерированных и спущенных эпителиальных клеток канальцев, покрытых капельками жира). 6) Восковидные (встречаются при дистрофических процессах в канальцах, в частности.при амилоидозе, жировой дистрофии и т.д.).Общие симптомы при заболеваниях почек: Почечные отеки (общие отеки тела- анасарка). Почечная артериальная гипертензия. Почечная эклампсия (судороги). Почечная недостаточность. Уремическая кома. 69. Нефротический синдром — клинико-лабораторный симптомокомплекс, включающий массивную протеинурию, нарушения белкового, липидного и водно-солевого обменов, а также отеки, вплоть до анасарки, развивающийся при первичных заболеваниях почек или других заболеваниях, чаще системных. Нефротический синдром подразделяют: Первичный нефротический синдром. Первичный нефротический синдром развивается при заболеваниях собственно почек — при всех морфологических вариантах гломерулонефрита, пиелонефритах, нефропатии беременных, опухолях почек (гипернефроме). Вторичный нефротический синдром. Вторичный нефротический синдром развивается при поражениях почек другой природы (непервичная патология почек). Основные причины вторичного нефротического синдрома: диффузная болезнь соединительной ткани, ревматоидный артрит, системные васкулиты, септический эндокардит, хронические нагноительные заболевания бронхов, легких, костносуставной системы, туберкулез почек, сифилис, малярия, гемобластозы, лимфогранулематоз, сахарный диабет, аллергические заболевания с выраженной, тяжелой клинической картиной, прием D-пеницилламина, препаратов золота, противоэпилептических средств. Патогенез. В основе развития нефротического синдрома лежат иммунные нарушения, аналогичные происходящим при гломерулонефрите. Кроме того, имеют значение патогенетические механизмы, лежащие в основе заболевания, приведшего к развитию нефротического синдрома. Патофизиология многих признаков нефротического синдрома изучена хорошо. Общим для большинства форм нефротического синдрома является повышение клубочковой проницаемости для белков, обусловленное основным патологическим процессом и приводящее к альбуминурии. Кроме того, при некоторых заболеваниях происходит повышенная потеря с мочой более крупных белков. Когда скорость потерь альбумина превышает интенсивность его синтеза, развивается гипоальбуминемия. Это снижает онкотическое давление и способствует перемещению жидкости в ткани. Образовавшаяся в итоге гиповолемия стимулирует повышенную секрецию ренина, альдостерона и антидиуретического гормона. Эти изменения способствуют задержке натрия и воды, следствием чего является олигурия и низкая концентрация натрия в моче. Поэтому натрий и вода поступают в ткани, содействуя этим увеличению отеков. Гипоальбуминемия способствует увеличению образования липопротеинов. Общий уровень в плазме липидов, холестерина и фосфолипидов повышен постоянно, при этом их уровень пропорционален гипоальбуминемии. 70. Экстраренальные симптомы и синдромы. Внепочечные (экстраренальные) симптомы и синдромы, характерные для нефропатий Азотемия — повышение в крови остаточного азота более 30 ммолъ/л, или его главных компонентов (мочевины более 6 ммолъ/л, креатинина более 0,1 ммолъ/л). Под остаточным азотом понимают совокупность азотсодержащих веществ плазмы крови (50% его составляетм Чем выше уровень остаточного азота в крови (или мочевины и креатинина), тем больше нарушена экскреторная функция почек. Азотемия всегда сопровождается тяжелой интоксикацией организма и нарушением функций многих систем: нервной, сердечно-сосудистой, пищеварительной, системы крови и других. Гипергидратация, отеки. Нарушения водного и электролитного баланса характерны для большинства заболеваний почек. Все случаи олигурии сопровождаются задержкой жидкости в организме и выраженным отечным синдромом. При этом у больных увеличивается ОЦК (объем циркулирующей крови) и происходит перегрузка сердца с его дилатацией или гипертрофией, растет артериальное и внутричерепное давление. На фоне анурии легко развиваются отек мозга, отек легких и другие грозные осложнения. В патогенезе «почечных» отековведущую роль могут играть следующие факторы: 1) увеличение эффективного фильтрационного давления (ЭФД) в капиллярах, обусловленное гиперволемией и ростом гидростатического давления (механический фактор); 2) снижение эффективной онкотической всасывающей силы (ЭОВС) в капиллярах вследствие прогеинурии и гипопротеинемии (онкотический фактор); 3) активация РААС и вторичный альдостеро-низм, спровоцированный уменьшением почечного кровотока и повышенной секрецией ренина из ЮГА; 4) повышение проницаемости сосудов, например, при гломерулонефрите с генерализованным капилляритом или других аутоиммунных заболеваниях (мембраногенный фактор); 5)лимфатическая недостаточность, обусловленная перегрузкой лимфооттока. Для «почечных» отеков характерна локализация на лице (пастозность лица) и особенно в области глаз. Однако при тяжелой гипергидратации отеки могут быть генерализованными, особенно при нефротическом синдроме и на фоне анурии. Гипогидратация может развиться у больных на фоне полиурии в тех случаях, когда потеря воды с мочой не компенсируется ее адекватным поступлением в организм. Обезвоживание не менее опасно, чем гипергидратация, так как при этом может снизиться ОЦК, АД, сердечный выброс, повыситься вязкость крови и риск тромбоза. В результате нарушения центрального и периферического кровообращения разовьется гипоксия, ацидоз. Дисбаланс электролитов характеризуется изменением содержания в крови натрия, калия, кальция, магния, ионов хлора, бикарбоната. Однако эти изменения зависят от конкретной нозологической формы нефропатии. Нефротический синдром может быть первичный (липоидный нефроз) вторичный — при гломерулонефрите, пиелонефрите и любых других заболеваниях почек, сопровождающихся протеинурией более 3,5 г в сутки. Его патогенез складывается из сочетания резко выраженной гипергидратации и отечного синдрома с гиперлипидемией, повышенной свертываемостью крови и снижением иммунитета. Главными в механизме «нефротических» отеков являются: снижение онкотического давления крови и ЭОВС, вторичный альдостеронизм лимфатическая недостаточность При этом может развиваться анасарка (отек всего тела, всех органов), асцит и другие водянки. Гиперлипидемия характеризуется повышением в крови больных холестерина и ЛПНП на фоне снижения ЛПВП, вследствие чего повышается риск развития атеросклероза, артериальной гипертензии и ишемической болезни сердца. У больных появляется липидурия с большим количеством зернистых цилиндров. Механизм этих нарушений имеет несколько объяснений. В целях компенсации дефицита белка печень усиливает его синтез. Параллельно повышается синтез липопротеидов и холестерина (общий метаболический путь). С мочой теряется фактор липолиза и до 1% ЛПВП, что способствует увеличению ЛПНП, которые легко откладываются в стенках сосудов, в том числе в гломерулах и в мезангии. Повреждение почек усиливается. Снижается активность ЛХАТ (лецитинхолестеринацетилтрансферазы) — модулятора обмена триглицеридов в плазме, катализатора эстерификации холестерина. Снижается клиренс триглицеридов, так как избыток холестерина подавляет липопротеидлипазу. Повышенный риск тромбообразования у больных с нефротическим синдромом обусловлен увеличением в крови прокоагулянтов на фоне дефицита антикоагулянтов (антитромбин выводится с мочой) и ослабления фибринолитической системы. Нарушение синтеза иммуноглобулинов и их потеря с мочой приводит к снижению гуморального иммунитета и повышает риск развития инфекционных осложнений. Почечная артериальная гипертензия осложняет течение большинства нефропатий. Ее патогенез связывают прежде всего с активацией РААС, так как при заболеваниях почек часто уменьшается почечный кровоток, приводящий к повышенной секреции ренина из ЮГА. При этом повышение тонуса резистивных сосудов (их спазм) обусловлен как действием на гладкие мышцы сосудистой стенки ангиотензина II, так и вазопрессина (АДГ). Секреция АДГ усиливается из-за повышения осмоляльности плазмы крови, обусловленной гипернатриемией (вторичный альдостеронизм). Кроме того, избыток в крови Na+ приводит к повышению чувствительности сосудов к катехоламинам, отеку эндотелиоцитов и увеличению ОЦК (задержка воды способствует нормализации осмоляльности плазмы, но одновременно повышает АД). Гиперволемия особенно выражена у больных с олигурией и анурией при почечной недостаточности. В ряде случаев поврежденные почки уменьшают выработку важнейших депрессорньгх факторов — про-стагландинов и кининов. Артериальную гипертензию, в патогенезе которой этот механизм является ведущим, принято называть «ренопривной». У некоторых больных важную роль в патогенезе почечной артериальной гипертензии играет наследственная предрасположенность. При выраженном склерозе почечной артерии гипертензия может носить злокачественный характер и приводить к необходимости пересадки почки. Анемия часто развивается у больных с патологией почек. В ее патогенезе могут играть роль несколько факторов: уменьшение продукции эритропоэтинов; потеря с мочой эритроцитов, железа, трансферрина при хронической патологии почек, сопровождающейся гематурией ипротеинурией; повреждение костного мозга, усиление неэффективного эритропоэза, нарушение включения железа в гем под влиянием уремических токсинов, ингибиторов эритропоэза. 71. Острая почечная недостаточность. Этиология. Патогенез, стадии. Нарушение функций почек при острой почечной недостаточности. Это такое состояние организма, при котором почки не способны даже в состоянии физического покоя при базальном приеме белков (0,5 г/кг веса тела в сутки) и при нормальной деятельности остальных органов выполнять свои гомеостатические функции. В зависимости от скорости развития выделяют острую и хроническую ее формы. В основе последних лежит либо тубулярная, либо тотальная (тубулярная и клубочковая) недостаточность. Одним из важных морфофизиологических показателей почечной недостаточности является значительное (более чем в 2 раза) уменьшение числа функционирующих нефронов. При этом страдают все процессы в почках (клубочковая фильтрация, канальцевые реабсорбция и секреция важнейших веществ, а также биосинтетические и метаболические функции). Последние сопровождаются нарушением способности почек как концентрировать, так и разводить мочу; расстройством мочеобразовательной и мочевыделительной функции, приводящих к развитию азотемии, нарушением водно-электролитного, кислотного-основного состояния, различных видов обмена, а значит приводит к неспособности почек обеспечивать постоянство внутренней среды. ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ (ОПН) Представляет очень тяжелую форму патологии, нередко приводящую к летальному исходу организма. Этиология. Среди причин развития ОПН большое значение имеют: 1) выраженные нарушения общего и почечного кровообращения (особенно внезапное падение кровотока в корковом слое почек, приводящее к быстро прогрессирующему снижению клубочковой фильтрации до 10-1 мл/мин. Это часто возникает при тяжелом геморрагическом и травматическом шоке и др. процессах, приводящих в ишемии почек); 2) быстро возникающие тяжелые повреждения паренхимы почек, вплоть до ее некроза. Это часто выявляется при отравлениях тяжелыми металлами, ядовитыми грибами и др. веществами, в том числе лекарственными средствами, при размозжении большого количества мягких тканей, при инфекциях, сепсисе, токсико-аллергических реакциях и т.д.; 3) быстро прогрессирующие острые диффузные гломерулонефриты и пиелонефриты, а также васкулиты; 4) развитие непроходимости мочевыводящих путей (из-за камней, опухолей, соединительнотканных рубцов и т.д.) и др. Таким образом, различают преренальные, ренальные и постренальные причины ОПН. Большинство случаев ОПН возникает в результате первых двух. |
