МОНОГРАФИЯ Диагностика и лечение деструктивного панкреатита. Лаптев В.В., Нестеренко Ю.А., Михайлусов С.В.. МОНОГРАФИЯ Диагностика и лечение деструктивного панкреатита. Диагностика и лечение деструктивного панкреатита
 Скачать 1.91 Mb. Скачать 1.91 Mb.
|
8.7. Пункция гнойников под контролем УЗИКак показывает анализ последних 20 лет, в клинику ежегодно госпитализируется от 200 до 350 больных с различными формами острого панкреатита. Из них практически у каждого третьего больного выявляется панкреонекроз. В последние годы наметилась тенденция к снижению летальности в фазе токсемии и значительное увеличение числа пациентов с гнойными осложнениями панкреонекроза. Это заставляет разрабатывать новые и совершенствовать традиционные способы санации гнойных очагов. Вероятные причины развития гнойных процессов у больных с пан-креонекрозом представлены в таблице 21. Таблица 21. Причины формирования гнойных осложнений панкреонекроза 1. Обширное поражение поджелудочной железы. Более % наблюдений 2. Позднее обращение больных в клинику — 38,2% 3. Запоздалое проведение комплексного лечения — 26,2% 4. Неполноценное медикаментозное лечение, экономические проблемы — 1,1% 5. Пожилой возраст и другая соматическая патология у больных — 2,8% Многолетний опыт ведения больных с панкреонекрозом показал, что риск нагноения ткани поджелудочной железы и клетчаточных пространств значительно выше при обширном некротическом процессе. Широкое применение высокоинформативных диагностических методов исследования позволяет достоверно оценивать объем поражения забрю-шинной клетчатки и сальниковой сумки. За последние семь лет резко возросло число пациентов с субтотальным и тотальным панкреонекрозом. Если в конце 80-х и в начале 90-х годов этот тяжелый процесс выявлялся почти в половине наблюдений, то к концу столетия он стал верифицироваться практически у 9 из 10 больных. Тщательное динамическое наблюдение за ними позволяет утверждать, что именно эти пациенты входят в группу повышенного риска развития гнойных осложнений. Конечно же, риск формирования гнойных осложнений повышается при позднем обращении больных за помощью, при запоздалом проведении комплексного лечения, что согласуется с данными литературы (Бри-скин К.С. и соавт., 2000; Данилов М.В. и соавт., 1986; Кадощук Ю.Т. 1989; Кубышкин В.А. и соавт., 1987; Лищенко А.Н. 1993; Нестеренко Ю.А. и соавт., 1998; Шалимов С.А. и соавт., 1990). Анализ анамнестических данных позволил отметить, что гнойные осложнения развились у 100 пациентов из 387 (25,8%), госпитализированных позднее третьих суток от начала заболевания. Существенную роль играет адекватность терапии и материальное обеспечение (Гельфанд Б.Р. и соавт., 2000; Данилов М.В. и соавт., 2000; Нестеренко Ю.А. и соавт., 1994; Савельев B.C. и соавт., 2000; Aranda E. et al., 1991). Как известно, по генезу гнойные осложнения делятся на первичные, или эндогенные, когда происходит присоединение аутоинфекции, и вторичные, или экзогенные, когда внедрение инфекции связано с открытым характером хирургического вмешательства. Это нужно учитывать поборникам хирургического вмешательства при остром панкреатите, особенно в фазах токсемии и постнекротического инфильтрата. Из 387 пациентов с панкреонекрозом, оперированных в фазе токсемии в связи с ошибочной трактовкой причины перитонита (43 случая), гнойные осложнения выявлены у 22 (51,2%). И наконец, несмотря на то, что пациенты старших возрастных групп (старше 60 лет) с панкреонекрозом составляют лишь 730 часть (2,8%), у этих соматически ослабленных больных также повышается риск нагноения некротизированной поджелудочной железы и забрюшинной клетчатки, что согласуется с данными литературы (Буянов В.М. и соавт., 1985; Маят B.C. и соавт., 1983). Санация гнойных очагов на фоне панкреонекроза не может быть своевременной и адекватной без создания стройной схемы диагностического алгоритма. В настоящее время обсуждается несколько вариантов лечения больных с гнойными осложнениями панкреонекроза. Прежде всего, это пунк-ционная чрескожная направленная санация (Брискин Б.С. и соавт., 1989; Гальперин Э.И. и соавт., 1989; Кизименко Н.Н. и соавт., 1993; Кузин Н.М. и соавт., 1996; Лобаков А.И. и соавт., 1998; Михайлусов СВ. 1998; Шапо-вальянц и соавт., 1998; Шкроб О.С. и соавт., 1998; Hancke S. et al., 1976; М.С. Hill et al., 1983; Pickleman V et al., 1987) и оперативный метод ( Бат-винков Н.И. и соавт., 1987; Брехов Е.Н. и соавт., 1996; Гальперин Э.И. и соавт., 2000; Данилов М.В. и соавт., 2000; Кубышкин В.А. 1986; Кукош М.В. и соавт., 1996; Прудков М.И. и соавт., 1998; Савельев B.C. и соавт., 2000; Beger H.G. et al., 1989). При этом высокая летальность на фоне гнойно-деструктивных осложнений заставляет исследователей обсуждать буквально все аспекты лечения: набор диагностических тестов для точного предоперационного определения формы процесса, хирургическую тактику, доступы к поджелудочной железе и забрюшинной клетчатке, выбор метода санации. Особенное внимание уделяется вопросам диагностики зон омертвевших инфицированных тканей в забрюшинной клетчатке, чтобы в процессе лечения предупредить резидуальные и рецидивные септические процессы. Несмотря на многолетний повышенный интерес хирургов к вопросу лечения гнойных осложнений панкреонекроза, единая лечебная доктрина до сих пор не создана. В конкретных клинических ситуациях врачи принимают весьма неоднозначные тактические решения. Нет по-прежнему общепризнанного мнения в отношении оптимальных сроков и методов оперативного пособия, хотя ни у кого не вызывает сомнения необходимость вскрытия гнойников. Реальную опасность представляют запоздалые вмешательства при обширных поражениях поджелудочной железы и окружающей клетчатки, когда на фоне прогрессирующей гнойной интоксикации развиваются необратимые метаболические нарушения и декомпенсация важнейших органов и систем. Драматическое течение гнойно-септических осложнений панкреонекроза объясняется быстрым распространением гноя по забрюшинной клетчатке вследствие особенностей анатомического строения; отсутствием каких-либо тканевых барьеров, поскольку они разрушаются ферментами. После расплавления париетальной брюшины возможен прорыв гнойника в брюшную полость и развитие перитонита (Kaushik S.P. et al., 1988). Кроме того, описаны опорожнения абсцесса в просвет полых органов (ободочную кишку, желудок, двенадцатиперстную кишку, желчный проток), а также фомирование внутренних свищей различной локализации (Филин В.Н., 1982). Одно из наиболее тяжелых осложнений гнойно-некротического процесса, которое нередко является непосредственной причиной смерти, — аррозия сосудов забрюшинного пространства (селезеночных, желудочно-двенадцатиперстных, нижней брыжеечной вены и др.). В большинстве публикаций содержится призыв к «своевременному» хирургическому вмешательству. Однако четко сформулировать критерии момента, когда необходимо проводить операцию, до сих пор не удается. С одной стороны, при развившихся гнойных осложнениях некротического процесса хирургическое вмешательство является уже запоздалым и во многом утрачивает свою спасательную роль. С другой стороны, во время вмешательства в ранние сроки обнаруживают лишь инфильтративные изменения и очаги стерильных некрозов, при которых операция не приносит облегчения, а лишь усугубляет течение заболевания в связи с операционной травмой, инфицированием очагов деструкции (Becker J.M. et al., 1984). В нашей клинике сложилась активно-выжидательная тактика лечения гнойных осложнений панкреонекроза, основанная на уточненной диагностике с использованием диагностических возможностей эхотомографии. Мы хорошо понимаем реальную опасность, которую несут запоздалые и неадекватные вмешательства, а поэтому считаем, что уже первичное обнаружение жидкостных структур является показанием к активизации хирургических действий. Для сокращения до минимума вероятности экзогенного инфицирования клетчатки и ткани поджелудочной железы манипуляции (чрескожные пункционные вмешательства и операции) следует проводить с соблюдением правил асептики и антисептики в специально оборудованных операционных. В анализируемой нами группе больных с гнойными осложнениями панкреонекроза было 387 пациентов (316 после лечения блокаторами панкреатического биосинтеза). 35 (9,04%) переведены из других лечебных учреждений, из них после оперативных вмешательств в фазе токсемии — 16 человек; в фазе инфильтрации — 2; с гнойным процессом — 3. В 22 наблюдениях нагноения; развились после ошибочно проведенных лапаротомий в результате неправильной трактовки генеза перитонита в клинике. Использованы различные варианты лечения гнойного (табл. 22) процесса Таблица 22. Способы лечения гнойных осложнений панкреонекроза
8.7.1. Чрескожная санация гнойных очаговПосле работ, проведенных СВ. Михайлусовым (1998), в клинике ши роко применяются чрескожные варианты неоперационной санации гнойных очагов, развившихся на фоне панкреонекроза. Сразу следует отметить, что при апостематозном поражении поджелудочной железы (1 наблюдение), с нашей точки зрения, альтернативы хирургическому лечению нет. В подобной ситуации весьма затруднительна диагностика характера процесса. Вынужденная же дренирующая операция не дает полноценного санационного эффекта. При запоздалой диагностике разрушительное вмешательство (резекция поджелудочной железы и спленэктомия) оказывается непереносимым для больного, и летальный исход неизбежен. Оснащение современными ультразвуковыми приборами со специальными датчиками дает возможность достичь высокой точности проведения чрескожной санации. Поначалу большинство хирургов негативно относились к этой манипуляции, но в настоящее время все больше хирур- гов считают, что чрескожное дренирование осумкованных гнойных осложнений панкреонекроза может вытеснить традиционные операции. В клинике накоплен опыт лечения 282 пациентов с ограниченными гнойными очагами различной локализации, возникшими на фоне панкреонекроза. И сегодня мы можем аргументированно утверждать, что чрескожная неоперационная санация является альтернативой хирургическому лечению. Непременным условием применения пункционных процедур является, прежде всего, четкая визуализация жидкостного очага. Для лечения осумкованных жидкостных образований возможно проведение: • тонкоигольных пункций; • дренирования. Тонкоигольные пункции эффективны лишь при очагах с объемом жидкости не более 50 мл (5 пациентов). Подобное лечение (многократные пункции) оправдано в тех ситуациях, когда дренирование невозможно из-за особенностей топографии очага (по траектории проведения дренажа располагается двенадцатиперстная кишка) и его плоской формы. Во всех этих наблюдениях хороший лечебный эффект получен у 1 больного после двух манипуляций; у 2 — после четырех и у 2 — после пяти. При переоценке пункционных возможностей очагов (13 наблюдений) пришлось после пункций произвести дренирование очага под ультразвуковым контролем. Для хорошего пролонгированного санационного эффекта имеет смысл применять дренирование очагов стилет-катетерами различного диаметра (178 наблюдений). Достаточно сложным при этом является вопрос выбора оптимальной траектории проведения дренажа. По нашему мнению, следует избегать повреждения селезенки, двенадцатиперстной и тонкой кишок, крупных сосудистых структур и элементов гепатодуоденальной связки. Как отмечено в работах СВ. Михайлусова (1998), в качестве «акустического окна» можно использовать ткань печени, малый сальник, желудочно-селезеночную и желудочно-ободочную связки; кроме того, возможен внебрюшинный доступ (рис. 37, 38, 39,40,41). Особую осторожность следует соблюдать при проведении дренажа через ранимую рыхлую мезоколон (рис. 42). Хотя панкреонекроз сопровождается выраженным инфильтративным и спаечным процессом в брюшной полости, особенно после перенесенных ранее оперативных вмешательств, что уменьшает риск развития фатальных последствий, следует соблюдать особую осторожность при проведении манипуляции. При чрескожном дренировании для получения желаемого эффекта необходимо выполнять следующие условия (табл. 23 ). Таблица 23. Условия, необходимые для достижения желаемого эффекта при чрескожном дренировании 1. Организация ультразвуковой хирургической службы в стационаре 2. Оснащение специальной операционной 3. Подготовка специалиста-хирурга, владеющего методикой эхотомографии 4. Визуализация гнойного очага 5. Выбор оптимальной траектории проведения дренажа 6. Микробиологическое исследование для подбора последующей антибактериальной терапии 7. Оценка размеров, формы и характера содержимого очага для определения необходимости дренирования, количества дренажей с целью достижения наилучшего санационного эффекта 8. Незамедлительная фистулография для уточнения распространенности процесса и установления вероятности получения желаемого санационного эффекта после дренирования 9. Оценка содержимого очага для определения необходимости последующей секвестрэктомии 10. Динамические ультразвуковые исследования и фистулография для оценки эффективности декомпрессии очага и решения вопроса о целесообразности дальнейших более активных хирургических действий 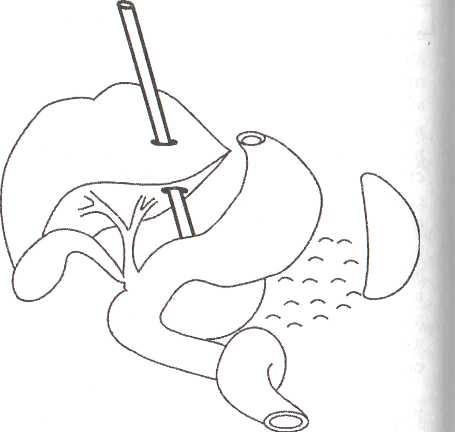 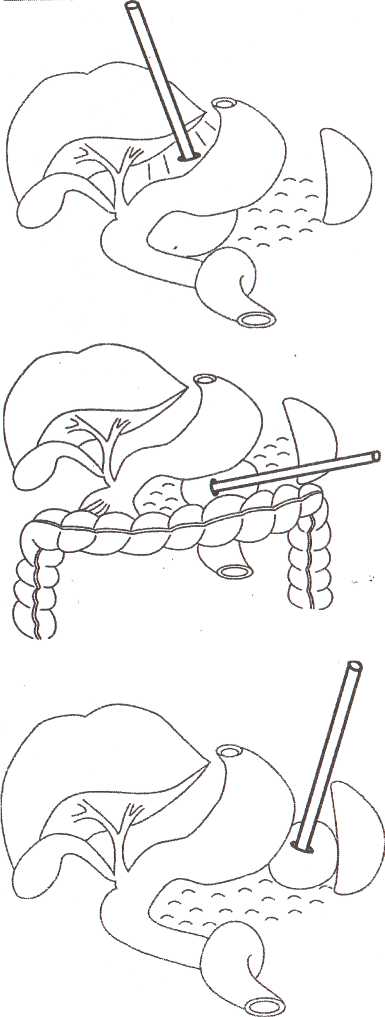 Рис. 37. Схема дренирования жидкостного образования сальниковой сумки через паренхиму печени Рис. 38. Схема дренирования жидкостного образования сальниковой сумки, расположенного в области головки поджелудочной железы, через печеночно-желудочную связку Рис. 39. Схема дренирования жидкостного образования сальниковой сумки, расположенного в области тела поджелудочной железы, через желудочно-ободочную связку После дренирования полученный материал отправляют на микробиологическое исследование для определения чувствительности флоры к антибиотикам. Топография, размеры и форма очага определяют количество проводимых в него дренажей. При осумкованном процессе проводят от 1 до 3 дренажей (рис. 43,44). Что касается наших наблюдений, то мы в 164 случаях устанавливали 1 дренаж; в 8 — 2 дренажа и в 6 случаях — 3. Динамические ультразвуковые исследования необходимо проводить через 2-3 дня после дренирования для оценки размеров и характера содержимого первично дренируемого очага и выявления новых жидкостных структур. Повторные фистулографии также помогают следить за динамикой процесса. Подтверждение этим исследованием слипание стенок полости является аргументом в пользу того, что можно удалить дренажи после нормализации клинико-лабораторных данных (рис. 45, 46, 47). Рис. 43. Схема дренирования жидкостного образования сальниковой сумки двумя дренажами при сложной анатомии полости Рис. 44. Эхограмма. Жидкостное образования сальниковой сумки неправильной (гантелеобразой) формы на фоне панкреонекроза, требующее дренирования несколькими трубками. 1 — передняя брюшная стенка; 2 — паренхима печени; 3 — жидкостное образование; 4 — детрит; 5 — усиление эхосигнала Контроль за состоянием больных в процессе лечения после пункцион-ного дренирования абсцесса позволил определить необходимость операции ввиду неэффективности лечебных мероприятий у 10 человек из 118 (8,5%). В последние два года в случаях, когда в очаге выявляются секвестры, мы проводим бужирование дренажных каналов с расширением их диаметра. 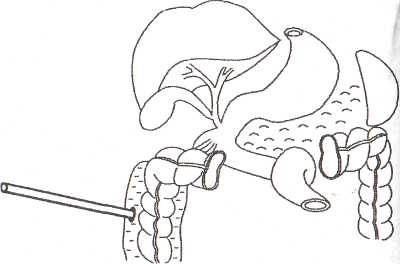 Рис. 41. Схема дренирования гнойного затека по ходу пара-колической клетчатки. Доступ дренирования люмбальный 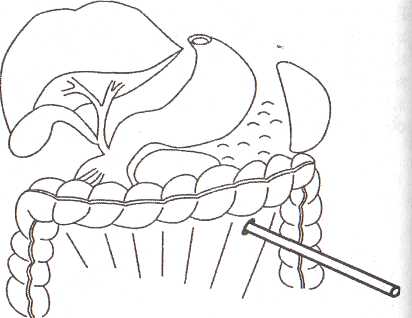 Рис. 42. Схема дренирования жидкостного образования сальниковой сумки через брыжейку поперечной ободочной кишки 8.7.2. Чресфистульная санация гнойных очаговЧресфистульная санация гнойного очага проводится через дренажные каналы. Обязательными условиями, обеспечивающими ее эффективность, является видеоскопическое удаление нежизнеспособных тканей при помощи холедохоскопа и лапароскопа. Доступ для видеоскопической санации осуществляется через пункци-онные и сформированные на трубках каналы, в том числе после традиционных операций и оментобурсостомии. Создание наружного свища необходимо с целью извлечения секвестров. При дренировании после операции это не представляет труда. После же пункционного дренирования (диаметр трубок при первичной манипуляции — 3-5 мм) вследствие особенностей пункционных насадок датчика ультразвукового прибора для удаления нежизнеспособных тканей необходимо бужирование сформированных дренажных каналов. В клинике для этого применяются металлические гильзы диаметром от 5 до 20 мм. Набор включает несколько инструментов, внешний и внутренний размер которых отличается на 1-2 мм. Количество последовательно проводимых бужирований определяется площадью некротизированных участков, расположенных в клетчаточных пространствах, и размерами металлических гильз для бужирования свищевых ходов. Этап расширения свищевого хода после первичного дренирования начинали с третьих-пятых суток от момента первичной декомпрессии. Представленные сроки от дренирования до первичного бужирования связаны во всех случаях с необходимостью сформированности дренажного канала. Многокомпонентная терапия при этом нужна для стабилизации состояния пациентов. Двукратное либо многократное бужирование свища проводится вследствие необходимости широкой ревизии клетчаточных пространств. При этом удаление нежизнеспособных тканей осуществляется при помощи гибкого холедохоскопа и жесткого лапароскопа. При выраженной кровоточивости продолжается санация полостей с использованием проточно-промывной системы под регулярным динамическим эндоскопическим и ультразвуковым контролем для своевременного обнаружения секвестров, доступных для удаления. Перед началом бужирования свищевого хода в обязательном порядке проводится фистулография, позволяющая получить достоверную информацию о топографии затеков. Методика бужирования свищевого хода после пункционного дре: рования. Больной находится в положении, в котором производилос наложение первичного дренажа. В зонтичный катетер устанавливаю' стилет-катетер соответствующего диаметра. Производят инфильтрационную анестезию дренажного канала. После этого скальпелем рассекают мягкие ткани передней брюшной стенки, апоневроз брюшной стенки или межреберных промежутков. Поверх стилет-катетера проводят гильзу. Вращательными движениями ее продвигают до корзинки катетера. Подтверждением факта попадания гильзы в полость гнойного очага служит поступление гноя или детрита между стенками стилет-катетера и трубчатого бужа. Гильзу фиксируют к коже шелковой лигатурой. Перед вторичным бужированием силиконовый катетер удаляют. Сформированный вокруг первичной гильзы ход также инфильтрируют новокаином, и манипуляция повторяется. Удаление некротизированных тканей после бужирования дренажных каналов. Осуществляется в несколько этапов. Все манипуляции проводятся под внутривенным наркозом, либо под местной анестезией с внутривенным потенцированием. Первый этап — диагностический — выполняется при помощи тонкого фиброскопа (холедохоскопа), который вводят по дренажному каналу в полость забрюшинного абсцесса или флегмоны. При этом оценивают размер и форму гнойника, наличие дополнительных недренируемых карманов, секвестров, их размеры и характер. При наличии небольших смещаемых («зрелых») секвестров возможно их извлечение при помощи корзинки Дормиа либо вакуум-отсоса В большинстве случаев требуется выполнение второго этапа — видео-скопической секвестрэктомии. С этой целью производится дополнительное бужирование дренажного канала до диаметра 10—12 мм, что позволяет провести по нему операционный лапароскоп с инструментальным каналом (рис. 49). Применение операционного лапароскопа позволяет выполнить лечебные манипуляции через один доступ, без использования дополнительных проколов для манипуляторов. Во время эндоскопической секвестрэктомии при помощи манипулятора производят фрагментацию и отделение секвестров от их основания тупым путем в пределах некротизированных тканей, чтобы избежать кровотечения, и их экстракцию. Ви-деоскопическая секвестрэктомия может осуществляться за несколько сеансов (от 2 до 8). Каждый сеанс заканчивается установлением дренажа с налаживанием проточного диализа (рис. 50). Гнойные полости промывают солевыми растворами антисептиков. После полного очищения гнойной полости от секвестров и некротических масс устанавливают дренаж на всю длину полости, который сохраняют до полной ликвидации полости (по данным динамических фистулографии и УЗИ). В этот период в полость по дренажу 1 раз в сутки вводят мазевые антисептические препараты (левомеколь, левосин и др.). Больные, как правило, выписываются из стационара с дренажами, и дальнейшее долечивание и удаление дренажей производится в амбулаторных условиях. Завершающий этап чресфистульной санации — обработка полости растворами антисептиков. Электрокоагуляция при контактной кровоточивости осуществляется при помощи электрохирургического блока Р5Э-2, работающего в режиме коагуляции 3.5-4А, что обеспечивает надежный гемостаз и удаление некротизированных тканей. В процессе дальнейшей ревизии продолжается промывание полости фракционно растворами антисептиков. Необходимо изменять варианты проведения дренажей. Так, для создания наилучших условий облитерации очагов проводится «сквозной» дренаж для адекватного слипания стенок очага (рис. 51). Чрескожная санация осумкованных гнойных очагов на фоне панкрео-некроза имеет явные преимущества перед их оперативным лечением, о чем свидетельствуют цифры, приведенные в таблице 24. Рис. 49. Бидеоскопическая секвестрэктомия 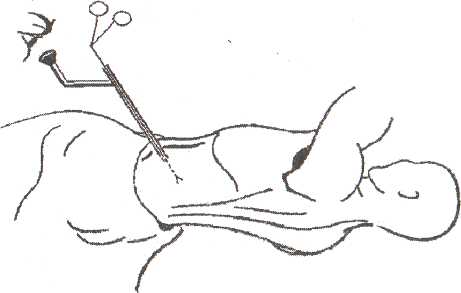 Рис. 50. Схема проточного дренирования при забрюшинной левосторонней флегмоне 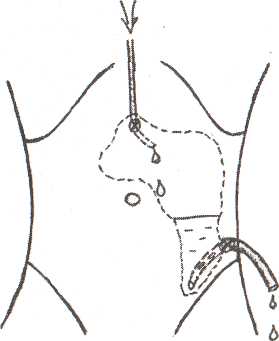 Рис. 51. Фистулография. Гнойник забрюшинной клетчатки слева. После эндоскопической санации Таблица 24. Результаты лечения осумкованных гнойных осложнений панкреонекроза
При традиционных операциях спаечный процесс значительно затрудняет ревизию. Так, в 3 случаях (3,03%) не все полости были обнаружены, что потребовало повторных вмешатальств. Помимо этого, в ходе операции отмечались ятрогенные повреждения полых органов у 4 больных (4,04%) и сосудистых структур — у 14 (14,1%). При пункционных же вмешательствах кровотечение было остановлено консервативными мероприятиями. Лишь в одном наблюдении пришлось оперировать больного в экстренном порядке после дренирования гнойника через мезоколон в результате подтекания гноя в брюшную полость. У пациентов, которым было проведено чрескожное дренирование осумкованных гнойных очагов (178 больных), лечение было успешным и окончательным в 161 случае (90,4%). В 15 случаях дренирование было дополнено чресфистульной санацией очага. К операции пришлось прибегнуть в тот период, когда еще не применялась видеоскопическая санация гнойных полостей (2 наблюдения). В процессе лечения при щадящей санации отмечено меньшее количество осложнений по сравнению с операцией. Хороший косметический эффект дренирующих манипуляций подтверждает факт отсутствия вентральных грыж у пациентов. После операции они выявляются практически у каждого третьего больного. Если при пункционном дренировании и выявляются кишечные свищи, они никогда не сопровождаются выделением кишечных масс на брюшную стенку, то есть являются внутренними и обнаруживаются лишь при фистулографии (рис. 52). Свищи не сопровождаются мацерацией кожи и закрываются самостоятельно после удаления дренажей. После операций и обширных ревизий формирование наружного кишечного свища всегда серьезно отражается на состоянии больных и требует специального лечения. Панкреатические внутренние свищи (рис. 53) при пункционном лечении наблюдались лишь в 15,8% наблюдений. При этом выделение панкреатического сока наружу по дренажу было лишь у 14 пациентов из 29 (48,3%). На коже отсутствовали характерные изменения, встречающиеся при полном наружном свище. Сроки пребывания больных в стационаре после пункционной санации сокращаются практически вдвое по сравнению с оперированными пациентами. Срок пребывания пациентов в клинике при чрескожной санации составил 25,3 дня. Большинство неоперированных больных (159 человек из 164) были выписаны из стационара с дренажами и наблюдались амбулаторно вплоть до удаления трубок после контрольных ультразвуковых исследований и фистулографии. Среди оперированн больных средний срок пребывания в стационаре составил 57,2 дня. Таким образом, использование для лечения больных с осумкованными постнекротическими гнойниками чрескожной пункционной декомпресии с применением при необходимости эндоскопической чресфистульной санации дало положительные результаты. Данная методика позволяет практически полностью отказаться от традиционного оперативного лечения, сопровождающегося большим числом осложнений и неблагоприятных последствий. Проведенная нами видеоскопическая санация осумкованных образований (15 наблюдений) с одним летальным исходом (6,7%) позволяет рекомендовать ее для широкого применения в клинической практике. 8.7.3. Пункционное лечение распространенных гнойных процессовОтсутствие естественных тканевых барьеров, препятствующих распространению инфекции, создает оптимальные условия для проникновения гноя как в грудную клетку, так и до малого таза с развитием тяжелейших осложнений. В данной работе мы остановимся только на таком осложнении, как забрюшинная флегмона, которая, по нашим данным, составляет лишь 26,9% от всех гнойных осложнений панкреонекроза. Однако неудовлетворенность результатами ее лечения заставляет постоянно совершенствовать методы как общей, так и местной терапии этого тяжелого осложнения. Результаты лечения гнойных флегмон определяются ранней диагностикой затеков и их топографией. В настоящее время общепринято оперативное лечение. Неоперационные способы санации считаются неприемлемыми. За 20-летний период забрюшинная флегмона выявлена нами у 104 из 1308 больных с панкреонекрозом (7,95%). В четверти случаев флегмона локализовалась в корне брыжейки тонкой и поперечной ободочной кишок. В 75% случаев — в параколических и паранефральных пространствах. В 15 случаях выявлено двустороннее поражение клетчатки. За указанный период в клинике использованы различные способы санации флегмон забрюшинной клетчатки (табл. 25). Таблица 25. Способы санации забрюшинной флегмоны, возникшей на фоне панкреонекроза, по материалу нашей клиники — 104 наблюдения
При проведении хирургической санации обязательными этапами вмешательств считались секвестр- и некрэктомия с эвакуацией гнойного отделяемого. В послеоперационном периоде тактика ведения больных была различной. Санированные очаги лечили «открытым» способом, с использованием запланированных санационных операций, включающих применение проточно-промывных систем, и оментобурсостомий (табл. 26). Лишь в последние 8 лет в клинике используются пункционные методики. Таблица 26. Характер лечения забрюшинной флегмоны, возникшей на фоне панкреонекроза
Непременным условием применения пункционной санации мы считаем обнаружение при помощи УЗИ скопление жидкости в забрюшинной клетчатке, далее следует поэтапное лечение (табл. 27). Таблица 27. Этапы пункционной санации забрюшинной флегмоны 1. Ультразвуковая визуализация жидкостного очага с пункционным подтверждением жидкостного характера процесса 2. Дренирование затеков несколькими дренажами 3. Фистулография 4. Использование проточно-промывной системы 5. Бужирование дренажных каналов 6. Видеоскопическая санация Второй этап — незамедлительное дренирование жидкостных образований. Методика проведения дренажа не отличается от подобной манипуляции при осумкованном очаге. При выборе же доступа предпочтение следует отдавать внебрюшинному доступу (транслюмбальному). Однако залогом успеха при обширном поражении клетчатки является возможность создания проточно-промывных систем при помощи нескольких трубок. Мы использовали от 2 до 7 дренажей (рис. 54). Детальную оценку распространенности процесса после дренирования дает рентгенологическая фистулография, которая определяет характер лечения (рис. 55, 56). Она позволяет выявить секвестры, если данные УЗИ неубедительны. Так, в анализируемой группе 8 больных при помощи фистулографии обнаружены неоднородные структуры в проекции затека — отторгнувшиеся участки некротизированной клетчатки. Данные же эхотомографии были весьма неубедительными. Дренирование затеков обеспечивает отток гноя с детритом. Адекватная декомпрессия и направленное антибактериальное лечение (после получения результатов посева содержимого затеков) на фоне интенсивной общей терапии способствуют восстановлению региональной микроциркуляции вокруг очагов. Рис. 54. Схема дренирования затеков по ходу толстой кишки на фоне пан-креонекроза 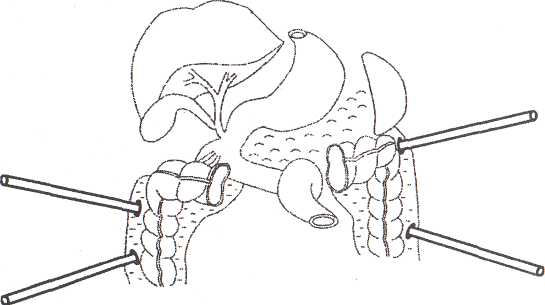 Одним из основных факторов, определяющих эффективность лечебных манипуляций, является обнаружение и удаление нежизнеспособных тканей. Следует подчеркнуть, что отрицательным моментом щадящей санации является невозможность сразу же установить дренажи большого диаметра из-за особенностей конструкции пункционных датчиков ультразвуковых приборов. Поэтому на следующем этапе лечения, начиная с 3-5 суток, проводится бужирование дренажных каналов. Установление трубок большого диаметра после этого создает благоприятные условия для видеоскопической секвестр- и некрэктомии. При помощи холедохо-скопа и операционного лапароскопа производится последовательное удаление свободно лежащих секвестров. Насильственное извлечение омертвевшей клетчатки приводит к кровотечению и ятрогенному повреждению рядом лежащих анатомических структур. Видеоскопическая санация произведена в 25 случаях. При этом каждому пациенту выполнено от 2 до 7 процедур. В процессе санации осуществляется визуальный контроль за эффективностью мероприятий и правильностью установки дренажей для последующей проточно-промывной санации. Сложившийся сегодня лечебный алгоритм позволяет нам в большинстве случаев отказаться при забрюшинной флегмоне от оперативного лечения. С нашей точки зрения, операция показана лишь в тех случаях, когда не представляется возможным достичь адекватной санации затеков. В послеоперационном периоде после дренирования клетчаточных пространств также приемлем вариант эндоскопических санаций (через свищевые ходы и оментобурсостому) — 8 наблюдений. Подобный щадящий подход дает возможность значительно уменьшить травматичность лечения, что легче переносится больными и существенно отражается на результатах. Рассматривая результаты лечения забрюшинных флегмон, мы сочли необходимым сравнить различные группы больных по характеру и числу осложнений (табл. 28). Таблица 28. Результаты лечения забрюшинной панкреатической флегмоны
При пункционных вмешательствах значительно сокращается частота наружных аррозивных кровотечений и кишечных свищей. Лишь одна больная после чрескожного дренирования и видеоскопической санации оперирована по поводу кровотечения из аррозированной селезеночной артерии. Кишечные и панкреатические свищи (рис. 57), как и при лечении осумкованных гнойников, были внутренними, в отличие от оперированных больных. В этой группе не было и вентральных грыж, которые среди оперированных наблюдались в 20 случаях (45,5%). При рассмотрении цифр летальности обращает на себя внимание раз- ница данного показателя в группе неоперированных и подвергнутых санации при помощи операции, в том числе реоперации. Неудачи в груп- пе пациентов, которым была проведена щадящая санация, связаны с не- удовлетворительной компенсацией нарушений белкового и водно-электролитного баланса. На это указывает свободные от гноя и секвестров по-1 лости затеков у 17 пациентов из 23 умерших (73,9%). В последней группе больных, леченных по отработанной схеме с применением адекватной за-1 местительной терапии, отмечено улучшение результатов, что позволяет надеяться на дальнейшее снижение летальности. В эту группу входило! 25 больных, из них умерло 8 (32%). Данный показатель, как и при осумко-| ванных процессах, можно расценивать весьма обнадеживающим. В качестве иллюстрации эффективности разработанного комплексного лечения больных с забрюшинными флегмонами приводим два клинических наблюдения. Больной Ж., 39лет, переведен в нашу клинику 19.07.2000 г. (и.б. № 23585) из другого лечебного учреждения, где лечился по поводу геморрагического панкрео-некроза, через 2 недели с момента заболевания. При поступлении у пациента отмечаются повышение температуры тела до 38°С, боли в животе. Палъпа-торно в левой половине брюшной полости определяется инфильтрат больших размеров. При экстренно проведенном ультразвуковом исследовании выявлены признаки геморрагического панкреонекроза с узким эхонегативным образованием по ходу левого параколического пространства. При диагностической пункции из забрюшинной клетчатки гноя не получено. Начата комплексная консервативная терапия. 26.07 произведено дренирование жидкостного образования забрюшинной клетчатки слева под контролем ультразвука. При фистулографии диагностирован параколическип затек вдоль всей нисходящей ободочной кишки 8х30см (рис. 58). В полость гнойника введен дополнительный дренаж для создания проточно-промывной системы. На 5-е, 8-е и 9-е сутки производилось последовательное бужирование свищевых каналов. 21.08, 28.08, 31 08 и 06 09 больному произведена оментобурсоскопия с извлечением большого количества секвестров и санацией забрюшинного затека. В процессе лечения течение заболевания осложнилось нижнедолевой пневмонией слева и гидротораксом Производилась пункция левой плевральной полости под контролем ультразвука с хорошим лечебным эффектом. 13.10удалены дренажи из забрюгиинной клетчатки после подтверждения факта спадения полостей при контрольных УЗИ и фистулографии (рис. 59). Больной выписан из стационара в удовлетворительном состоянии. Больной Л., 23 лет, и.б. №2101, госпитализирован в стационар 16.10.2000 г. в экстренном порядке с клинической картиной острого панкреатита, панкреа-тогенного перитонита. При ультразвуковом исследовании диагностирован геморрагический панкреонекроз; признаки билиарной гипертензии отсутствовали; в брюшной полости значительное количество жидкости. При лапароскопии в брюшной полости обнаружено большое количество геморрагического выпота. Произведена санация и дренирование пятью дренажами для проведения перитонеального диализа. В тот же день произведена аспирация панкреатического сока при лечебно-диагностической дуоденоскопии. Начата консервативная терапия в реанимационном отделении. В комплекс лечения включены 5-фу (внутриаортально) и цефалоспорины III поколения. 24.10 на фоне клинико-лабораторных признаков интоксикации выявлено жидкостное образование сальниковой сумки и забрюшинной клетчатки, которое дренировано под контролем ультразвука двумя дренажами. Получен вязкий детрит. При фистулографии оценено распространение гнойного процесса по забрюшинной клетчатке (рис. 60). Выявлено обширное поражение. 31.10 проведено бужирование дренажных каналов ввиду наличия вязкого отделяемого в дренаже. На фоне комплексного лечения 22.11 и 25.11 произведена оментобурсостомия с извлечением секвестров и санацией полости, имеющей неправильную форму со множеством отрогов. 17.11 при контрольной фистулографии выявлены признаки внутреннего тонкокшиечного свища. Продолжено фракционное промывание дренируемой полости. По данным динамического УЗИ и фистулографии, полость значительно уменьшилась в размерах. 8.12 больной в удовлетворительном состоянии выписан из стационара на амбулаторное долечивание с дренажом в остаточной полости. Дренаж удален амбулаторно. В заключение следует отметить, что щадящие методы лечения гнойных осложнений панкреонекроза заслуживают внимания практических врачей. Сугубо консервативный подход к ведению больных в фазе токсемии, а также усовершенствованную технику пункционных вмешательств можно рассматривать как один из вариантов лечения больных, который, наряду с оперативными методами санации, может быть широко использован в повседневной работе хирургических стационаров. Таким образом, при малейшем подозрении на формирование гнойно-некротических очагов на фоне панкреонекроза необходима незамедлительная ультразвуковая верификация процесса при помощи контактного сканирования и тонкоигольной пункции. При осумкованном гнойном очаге объемом менее 50 мл (получены детрит и гной) оправдано применение тонкоигольных пункций. При очагах большего объема и при рецидиве гнойного процесса после пункции следует прибегнуть к дренированию жидкостного образования. Если осуществить этапную санацию малоинвазивным способом невозможно, альтернативы операции нет. После установления дренажа (дренажей) показана фистулография, помогающая уточнить топографию процесса и распространенность поражения. При флегмоне, а также при осумкованных очагах большого объема и неправильной формы улучшение санационного эффекта можно достичь путем создания проточно-промывных систем, то есть установления нескольких дренажей пункционным способом. При секвестрации клетчатки требуется ее удаление. Для некр- и секве-стрэктомии свищевые ходы необходимо бужировать с последующим использованием эндоскопа. Если осуществить данный этап по каким-либо причинам неудается, больного следует оперировать. Видеоскопическая санация дает весьма обнадеживающие результаты и у оперированных больных: в послеоперационном периоде через оментобурсостому или дренажные каналы можно осуществлять лечебно-диагностические процедуры. Малоинвазивное пункционное лечение уже сегодня практически полностью может вытеснить традиционные хирургические операции при осумкованных гнойных процессах. Что же касается пункционного лечения забрюшинных флегмон, то, с нашей точки зрения, это весьма перспективный метод, не ухудшающий результаты лечения, а даже улучшающий их и позволяющий практически полностью отказаться от люмбо- и лапаротомий. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
