Диф.диагностика гепатоспленомегалии. Дифференциальная диагностика при синдроме гепатоспленомегалии учебное пособие для студентов
 Скачать 17.33 Mb. Скачать 17.33 Mb.
|
ДНКHBcAg HВeAg Pre-Sl Pre-S2HbsAgРис.1. Схема структуры вируса гепатита В В сердцевине вируса расположен еще один антиген, условно обозначенный как HBxAg, что соответствует пока еще недостаточной информации о его значении. Белок внешней облочки HBV представляет "поверхностный" (superficialis) антиген - HBsAg, его и именовали поначалу "австралийским". Содержание HBsAg в крови больных варьирует в широких пределах от очень небольших величин (1-10 нг в 1 мл) до огромных концентраций порядка 500 мкг/мл. На наружной оболочке HBV в зоне, предшествующей области S-антигена расположены белки pre-S - pre-Sl, pre-S2, играющие важную роль в механизме взаимодействия HBV с печеночными клетками. В организме больного ГВ ко всем вирусным антигенам вырабатываются антитела: анти-НВс, анти-HBs, анти-НВе, анти-pre-Sl, анти-рге-82, анти-НВх. Все антигены и антитела к ним по своей совокупности представляют комплекс специфических маркеров HBV, индикация которых имеет разное по информативности диагностическое, прогностическое и эпидемиологическое значение. HBV высокоустойчив, сохраняясь в условиях комнатной температуры 3 мес, в холодильнике - 6 мес, в замороженном виде - 15-20 лет, в высушенной плазме - 25 лет. Кипячение обеспечивает гарантированную инактивацию вируса только при условии достаточной продолжительности (более 30 мин.). Вирус противостоит действию практически всех дезинфицирующих средств и консервантов крови. Так, в 1-2% растворе хлорамина инактивация наступает через 2 часа, в 1,5% растворе формалина - только при 7-дневной экспозиции. Вирус устойчив к лиофилизации, воздействию эфира, ультрафиолетовому облучению. ГВ является антропонозной нетрансмиссивной кровяной инфекцией. Его особенностью является наличие множественных - естественных и искусственных путей передачи, разнообразие источников инфекции. Потенциальные источники HBV-инфекции:
Заражение ГВ происходит при инокуляции очень малых обьемов крови - 0,0005мл. Инфекционность крови может сохраниться при ее разведении в 8-10 раз. Для сравнения - инфицирующая доза крови при ВИЧ/СПИД-инфекции на несколько порядков выше: 0,1 мл. Соответственно, контагиозность ГВ, по крайней мере, в 100 раз выше, чем при ВИЧ-инфекции. Пути передачи ГВ существуют искусственные (артифициальные) - в результате парентеральных медицинских (лечебных и диагностических), а также немедицинских иньекций (наркомания). Естественные неартифици-альные пути передачи HBV-инфекции реализуются перинатальным заражением, половым путем, а также в результате так называемых гемоперкутант-ных контактов (порезы, трещины на губах, ссадины, кровоточивость десен). Важную группу риска представляют медицинские работники, что подтверждает высокую долю горизонтального пути инфицировния HBV. При анализе профессиональных заражений работников здравоохранения было установлено, что факторами передачи могут явиться брызги инфицированной слюны, попадающие на поврежденные участки кожи.Статистика инфицированности вирусными гепатитами среди медперсонала показывает, что наиболее неблагополучны в этом отношении отделения гемодиализа, гематологии, лабораторная служба. Проведенные нами исследования на базе научно-практического Центра гастроэнтерологии Областной клинической больницы (г.Томск, 1998г.) подтверждают высокую частоту выявления маркеров вирусных гепатитов именно в данных отделениях. Так в отделении гемодиализа около 38% медперсонала являются больными ХГ или носителями вирусов гепатита, причем наблюдается их неуклонный рост. После острого гепатита В хронизация наступает в 5-10% случаев, хотя в последние годы называется гораздо более низкий процент хрониза-ции(1%). Патогенетической особенностью ГВ является отсутствие прямого ци-топатического эффекта вируса, его повреждющее действие иммуноопосре-довано. В основе патоморфологических изменений при ГВ, как и других вирусных гепатитах, лежит цитолиз гепатоцитов, инициирующий развитие прогрессирующего некротического процесса. Развитие цитолиза связано с активацией прооксидантных и, наоборот, угнетением антиоксидантных систем клетки, что сопровождается накоплением свободных радикалов, усиливается перекисное окисление липидов (ПОЛ). В гидрофобном барьере биомембран появляются "дыры", определяющие повышение их проницаемости, а затем этот процесс распространяется и на внутриклеточные органеллы. Особо важное значение приобретает повреждение мембран ли-зосом, из которых выходят мощные протеолитические ферменты - гидролазы, что в значительной степени определяет развитие некроза гепатоцитов. Репликация отдельных компонентов HBV происходит раздельно: нуклеокапсида - в ядрах гепатоцитов, белков внешней оболочки (HBsAg) -в цитоплазме. Конечный этап состоит в сборке полного вириона. При этом избыток HBsAg, не использованного для сборки вириона, через межклеточные пространства попадает в кровь. Сборка вириона в гепатоцитах заканчивается презентацией его растворимого нуклеокапсидного антигена HBeAg на мембране гепатоцитов, где происходит его "узнавание" иммуноцитами. Циркулирующий HBeAg подавляет оба звена иммунитета. Клеточный - путем снижения продукции гамма-интерферона, играющего важную пусковую роль в механизме "узнавания" антигенов вируса Т-лимфоцитами, гуморальное - подавлением антителообразования В-лимфоцитами. Важным открытием современного этапа явилось установление возможности внепеченочной репликации HBV, в частности, в клетках костного мозга, крови, лимфатических узлов и селезенки. Репликация HBV в мо-нонуклеарных клетках крови, которые не контролируются иммуноцитами, способствует еще одному пути "ускользания" вируса от иммунного надзора. Важно отметить существование мутантных штаммов HBV, возникающих в основном у больных ХГ и фульминантным гепатитом. При длительном нахождении HBV в гепатоцитах происходит внедрение - интеграция его генетического аппарата с геномом клетки, что делает вирус недосягаемым для иммунного контроля и является одним из основных механизмов хронизации HBV-инфекции, а равно и потенциальной угрозы малигнизации. Согласно новым рекомендациям, при ХГВ следует разграничивать два варианта - с высокой и низкой репликативной активностью вируса, а критерий их разграничения - индикация HBeAg. Сохранение циркуляции HBeAg в крови спустя 6 мес. и больше от начала болезни подтверждает развитие ХГВ с высокой репликативной активностью (HBeAg-позитивный ХГВ). Наступление к этому времени сероконверсии с прекращением циркуляции HBeAg и появлением анти-НВе при сохранении персистирующей HBs-антигенемии характеризует развитие ХГВ с низкой репликативной активностью (HBeAg-негативный ХГВ). Причем, при последнем варианте предусмотрено его дополнительное разграничение в зависимости от уровня АлАТ. Нормальные или близкие к норме показатели АлАТ соответствуют персистирующему течению HBV-инфекции с интеграцией вируса с геномом гепатоцита без активного иммунного цитолиза (интегративный тип ХГВ). Сохранение высокого уровня АлАТ при отсутствии признаков активной репликации HBV требует исключения присоединения других вирусов гепатотропного действия (интегративный микст-гепатит В+С, B+D, В+А). Специфическими маркерами HBV при хроническом ГВ являются:
Важно уточнить, что отсутствие в крови HBeAg может соответствовать штамму HBV, лишенному способности синтезировать HbeAg (HBVe-штамм). К особенностям ХГВ, вызванного HBVe-, следует отнести: отсутствие клинического улучшения при наступлении сероконверсии HBeAg-анти-НВе, сохранение повышенной активности АлАТ при исключении микст-гепатита, обнаружение в крови HBV-ДНК, нередко в высокой концентрации. Такой вариант ХГВ может быть обозначен как HBeAg-негативный гепатит, протекающий с сохранением репликативной активности. Отсутствие HbeAg у мутантного типа объясняется наличием мутации pre-core-региона, что и приводит к нарушению продукции данного антигена (Brunetto et al., 1989). Для обоих типов вируса («дикого» и «мутантного») общими маркерами служат HBsAg, HBcorAglgG, HBV ДНК. Маркеры репликации «дикого» и «мутантного» типов HBV 1. "Дикий "тип: HBsAg+, HBeAg+, HBeAb-, HBcorIgG+, HBV ДНК. 2. «Мутантный» тип: HBsAg+, HBeAg-, HBeAb+, HBcorIgG+, HBV ДНК. КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА Большей частью ХГВ имеет в основном сглаженное малосимптом-ное течение. У большинства больных с несомненными клинико-лабораторными и морфологическими признаками ХГВ вообще нет указаний на перенесенный когда-либо в прошлом острый гепатит. Это вполне объяснимо с учетом угрозы развития хронизации исключительно после легких, стертых желтушных и чаще безжелтушных форм острой фазы болезни, в значительной части остающихся нераспознанными. В основном ХГВ протекает без желтухи, другие проявления его тоже не столь манифестны, что определяет ХГВ как «немой» гепатит. Первые проявления соответствуют жалобам больных на быструю утомляемость, ухудшение общего самочувствия, слабость, головные боли, снижение толерантности к физическим нагрузкам, чувство усталости уже в утренние часы. Появление и прогрессирование этих симптомов соответствует постепенному развитию печеночной недостаточности. С относительно меньшим постоянством присоединяются диспепсические расстройства, редко бывает болевой абдоминальный синдром. Может иметь место субфебрилитет. Оценка астено-вегетативных и диспепсических расстройств, установление их гепатогенной природы облегчается при выявлении увеличения печени, причем большей частью незначительное. Пальпаторно имеется ее уплотнение, что подтверждает известную давность болезни. Не часто гепатомегалия сопровождается увеличением селезенки, что характеризует генерализованную реакцию ретикулоэндотелиальной системы. Гепатоспленомегалия иногда протекает с увеличением лимфатических узлов. Признаки гиперспленизма наблюдаются редко, преимущественно при тяжелом течении болезни по типу ХАГ-цирроза. Анемия и тромбоцитопения, наряду с гиперспленизмом, могут быть обусловлены геморрагическим синдромом. Последний связан с угнетением белковосинтезирующей функции печени и уменьшением выработки факторов свертывания, прежде всего прокоагулянтов (протромбина, проконвер-тина, проакцелерина). Снижение коагулогического потенциала крови сопровождается мелкими кожными кровоизлияниями, ограниченными пете-хиальными высыпаниями, кровоточивостью десен, транзиторными носовыми кровотечениями. Развивающаяся анемия носит апластический характер, что подтверждается невысокими показателями содержания ретикулоцитов. Существенно при ХГВ и развитие внепеченочных изменений, но их выраженность и спектр существенно меньше, чем при аутоиммунном гепатите (см. "Аутоиммунный гепатит"). Хроническое носительство HBsAg. Это сугубо условное наименование, которым принято обозначать субклинические и инаппарантные формы ХГВ. Чаще соответствует клинически латентной интегративной форме хронической HBV-инфекции. Ее характеризуют не как носительство отдельного HBsAg, а полного вириона HBV. Наряду с этим, следует отметить возможность и носительства именно HBsAg в результате его избыточного синтеза в гепатоцитах. Формирование хронического носительства HbsAg обусловлено прежде всего неполноценностью иммунного ответа и оно встречается несравненно чаще клинически манифестных форм ХГВ. Причем установлены четкие половые различия - преимущественная частота носительства HBsAg среди мужчин. Это связано с генетически детерминированным у них ослабленным иммунным ответом. Диагностика хронического носительства основывается на выявлении длительной HBs-антигенемии (не менее 6 мес.) при полном отсутствии каких-либо клинических проявлений HBV-инфекции. У носителей HBsAg в крови часто обнаруживаются антитела к HBcAg класса G, которые могут сохраняться в течение неопределеноого времени. Установлена возможность спонтанного исчезновения HBsAg. Морфологическая диагностика ХГВ более важна для определения активности процесса в печени, а не установления этиологической принадлежности гепатита, определяемую исключительно серологически. По морфологии нельзя судить и о репликатив-ной активности HBV. В то же время имеется ряд неспецифических гистологических критериев, которые с большой долей вероятности могут быть отнесены к HBV-инфекции. Это совокупность следующих изменений в биоптатах печени:
Исходы ХГВ. ХГВ должен рассматриваться как потенциально обратимый. Но при репликативном и интегративном типе ХГВ может развиваться ЦП, а также гепатоцеллюлярная карцинома. Последняя представляет первичную неметастатическую опухоль, происходящую из печеночных клеток, и вместе с холангиокарциномой (опухолью, происходящей из клеток внутрипеченочных желчных протоков) и гепатохолангиомой (опухолью смешанного происхождения) описывается под объединяющим названием первичного рака печени. Считается, что вирусная ДНК, не обладая прямым онкогенным действием, в условиях многолетней персистенции в гепатоцитах, активирует клеточные онкогены. Это, с одной стороны, приводит к усиленной пролиферации, а с другой - стимулирует апоптоз, т.е. "программирует" ускоренную гибель клеток. Таким образом, многолетнюю интеграцию HBV с геномом гепатоцита рассматривают как "потенциальный предвестник первичного рака печени". ХРОНИЧЕСКИЙ ВИРУСНЫЙ ГЕПАТИТ D (ХГD) Вирус гепатита дельта (HDV) является уникальным, совершенно не похожим на все известные вирусы человека. HDV не имеет ни внешней, ни внутренней оболочки. Его структура состоит из генома и белка, кодирующего синтез специфического антигена - HDAg. Геном представляет однони-тевую РНК очень мелких размеров (Рис.2.). Важнейшей особенностью HDV является его облигатная зависимость от наличия вспомогательного вируса, т.к. только при этом условии становится возможной репликация HDV. Роль вируса-помощника играет HBV, во внешнюю оболочку которого, состоящую из HBsAg и встраивается HDV. 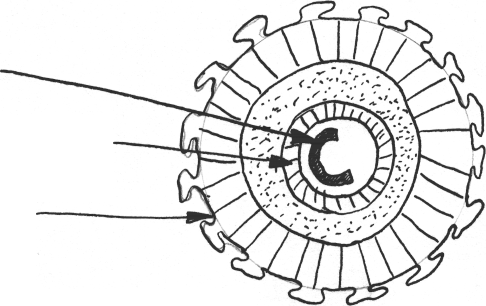 РНК HDV core Ag HbsAg Рис.2. Схема структуры вируса гепатита D. Заражение обоими вирусами может произойти одновременно, что соответствует развитию HDV/HBV-коинфекции. Другим вариантом является внедрение HDV в ранее HBV-инфицированные гепатоциты, в основном у хронических носителей HBsAg. Это называют HDV/HBV-суперинфекцией. Эпидемиологическая характеристика (распространенность, источники инфекции и пути передачи) ГВ и TD достаточно близка. Особенностью является то, что при гемотрансфузионном пути заражения относительно чаще возникает сочетанное заражение HBV и HDV. Кроме того, больные отделения гемодиализа - одна из основных групп высокого риска заражения ГВ, относительно мало поражены HDV-инфекцией. За последние годы резко возросла доля HDV-инфицированных наркоманов с внутривенным введением наркотических средств. При HDV-инфекции отмечено относительно меньшее значение полового пути передачи. Патогенетической особенностью ГВ является развитие микст-гепатита, возникновение поражения печени под влиянием двух гепато-тропных вирусов - HBV и HDV. При первичной HDV/HBV-коинфекции ак-тивная репликация HDV приводит к подавлению репродукции HBV. Содержание HBV-ДНК уменьшается, или полностью исчезает из крови, прекращается циркуляция HBeAg, падает содержание или исчезает HBsAg. Подавление репликации HBV чаще временное, но может быть и стабильным. В случае же HDV/HBV-суперинфекции имеется прогрессирующее течение болезни с развитием фульминантного гепатита и ЦП, что обусловлено прежде всего HDV. Ниже приведены критерии разграничения сочетания двух инфекций:
наличие в сыворотке крови HBV-ДНК, HBeAg, анти-НВс IgM, HBsAg, HDV-PHK, анти-HDV IgM, часто тяжелое течение, частота хронизации соответствует частоте хронизации HBV.
HBsAg, анти-HBcor сумм., HDV-PHK, анти-HDV IgM, быстрое прогрессирование процесса в ХГ и ЦП, малая эффективность противовирусной терапии. ХГ является при HDV/HBV-суперинфекции основной формой болезни. Клинически манифестные формы характеризуются прогрессирующим течением, близким к хроническому репликативному ГВ. В начальной стадии преобладают субъективные расстройства. Хронические носители HBsAg, ранее вполне компенсированные, начинают испытывать быструю утомляемость, слабость. Резко снижается трудоспособность, половая активность, у женщин появляются расстройства менструального цикла. Наблюдаются диспепсические нарушения, беспричинное похудание. Характерно более постоянное сочетание гепатомегалии с увеличением селезенки с признаками гиперспленизма. Известным отличием XГD от ХГВ является отсутствие внепеченочной репликации вируса в моноцитах и других клетках. Основной особенностью XГD является его циррозогенность. Угроза малигнизации при XГD относительно меньшая, чем при ГВ. ХРОНИЧЕСКИЙ ГЕПАТИТ С (ХГС) Вирус гепатита С (HCV) обладает наиболее высоким хрониогенным потенциалом. Частота хронизации после острого гепатита С составляет 75-85%. Именно HCV-инфекция является основной причиной формирования всей группы хронических болезней печени - ХГ, ЦП, гепатокарциномы. HCV остается загадочным вирусом, его называют "ласковым убийцей". Не выяснен до конца патогенез гепатита С (ГС), который объяснил бы возможность летальных исходов спустя четверть века торпидного течения. Спорна даже сама возможность выздоровления больных ГС. РНК HCV представляет мелкий, покрытый оболочной сферический вирус с однонитевой линейной РНК (Рис.3.). гликопротеины Е протеин С 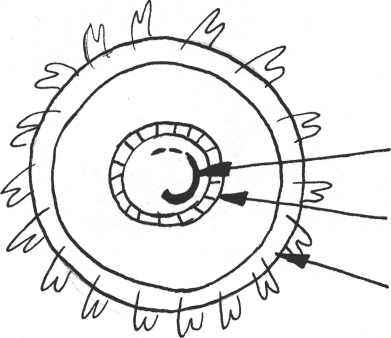 Рис.3. Схема структуры вируса гепатита С. Геном вируса кодирует струтурные и 6 неструктурных белков. К структурным, наряду с белками сердцевины (C-core protein), относят и гликопротеины облочки (E-envelope protein 1 и 2). Неструктурную область представляет комплекс белков с ферментативной активностью. Из них ключевая роль в репликации HCV принадлежит NS3- протеиназе - ферменту, катализирующему заключительный этап синтеза вирусного полипротеина. Существенной особенностью HCV является его генетическая гетерогенность. Для целей клинической практики достаточно разграничивать 5 генотипов HCV: la, lb, 2а, 2Ь и За.     с C 3 N5  труктурная область неструктурная область труктурная область неструктурная область   NS4 NS5 NS2 C E1 E2 NS1 NS2 NS3       c 200 NS5 c 22   c 33 gp33 gp70 c 100  5-1-1 Рис.4. Схема организации генома вируса гепатита С. Пути передачи и источники инфекции аналогичны таковым при ГВ. При ГС меньшее значение имеет вертикальный путь передачи от инфицированных матерей. У значительного числа больных ХГС нет никакого парентерального анамнеза, вирус обнаруживается не только в крови, но и слюне, моче и даже слезной жидкости, хотя и в очень малых концентрацях. Патогенетической основой ГС является его проникновение в гепато-циты, где и происходит репликация. У HCV имеется также внепеченоч-ная репликация, в частности, в мононуклеарах крови. Он обладает пря-мым цитопатическим действием, вызывающим цитолиз. Но антигены HCV обладают существенно меньшей иммуногенностью и не индуцируют, по крайней мере, выраженных иммунопатологических реакций. Вирус спосо-бен вызывать "Т-клеточную анергию", что в значительной мере способст-вует хронизации процесса, в том числе имеет значение апоптоз вирусспе-цифических Т-клеток. Гуморальный иммунный ответ при ГС также сла-бее, о чем говорит менее интенсивное антителообразование. Преимущест-венные темпы хронизации ГС - у алкоголиков и злостных курильщиков. Возможна к тому же и реинфекция. В основе "ускользания" HCV из-под иммунного надзора основная роль принадлежит уникальной способности вируса изменять антигенную структуру, многократно обновляющуюся в течение одной минуты. Морфологические особенности ХГС (хотя и не патогномоничные) преставлены сочетанием изменений:
Отличительной особенностью ХГС является малосимптомное, латентное течение, большей частью остающееся нераспознанным, вместе с тем постепенно прогрессирующее и в дальнейшем бурно финиширующее с развитием ЦП и гепатоцеллюлярной карциномы. В многолетнем течении HCV-инфекции выделяют три последовательные фазы: острую, латентную и реактивации. Причем в острую фазу иммунный контроль частично сохранен, чему соответствует пусть редкая, но все же возможность выздоровления. В латентную фазу остаточный иммунитет уже недостаточен для элиминации вируса. Эта фаза соответствует хроническому перси-стирующему течению HCV-инфекции с сохранением вирусемии при полном или почти полном отсутствии клинических проявлений. Ее условно характеризуют как хроническое носительство HCV. Важно отметить существенные отличия от хронического носительства при HBV. Латентная фаза ГС является предстадией фазы реактивации инфекционного процесса с развитием клинически манифестного ХГС. При HBV-инфекции хроническое носительство HBsAg, при отсутствии HDV-суперинфекции, крайне редко является предстадией клинически манифестного ХГВ. Латентная фаза может продолжаться многие годы, до 15-20 лет, при этом инфицированные лица считают себя здоровыми. Имеется небольшой астенический синдром, умеренная гепатомегалия, уплотненная консистенция печени, селезенка не увеличена. Может быть 1,5-2 кратное повышение активности АлАТ, у 1/3 больных - нормальные значения. HCV-PHK обнаруживается непостоянно, в низких концентрациях. Положительная реакция на HCV-PHK в латентную фазу подтверждает диагноз, однако не обязательно характеризует репликативную активность вируса. В крови закономерно присутствуют анти-HCV NS3-4, анти-HCV IgG. Анти-HCV класса IgM, как правило, отсутствуют. Выделяют инаппарантную форму (АлАТ - норма) и субклиническую (АлАТ до 3-х норм). Наступление фазы реактивации знаменует практически полную утрату иммунитета, что приводит к всплеску активности HCV-инфекции, основной клинической формой которой является ХГ. ХГ дебютирует нередко гиперферменемией, которая может опережать клиническую картину заболевания (см. ХГВ). Критериями фазы реактивации является наличие: HCV-PHK, анти-HCVcore IgM, анти-HCVcore IgG, aHTH-NS4, увеличение АлАТ в 3 и более раз. Преимущественные темпы прогрессирования фазы реактивации отмечены при 1 генотипе HCV. В клинической картине ХГС, по аналогии с ХГВ, следует учитывать возможность развития многочисленных внепеченочных проявлений (см. « Аутоиммунный гепатит» ). ГЕПАТИТ G К настоящему времени идет поиск новых видов возбудителей вирусных гепатитов, что сокращает список криптогенных заболеваний печени. Наиболее перспективными оказались исследования группы GB- вирусов (их наименование соответствует инициалам больного, 34-летнего хирурга, у которого впервые диагностирован данный гепатит). Позднее удалось выделить еще три новых вирусных агента, обзначенных как GBV-A , GBV-B, GBV-C. Геном вируса представлен одноцепочечной РНК, он близок по структуре к HCV. Эпидемиологическая характеристика гепатита HGV/GBV-C близка к другим сывороточным гепатитам, особенно С. Это касается источников заражения и путей передачи. Основным маркером данного гепатита является РНК HGV/GBV-C в сыворотке крови. Имеются сообщения о возможности развития хронического гепатита HGV, причем чаще выявляется его коинфекция с другими сывороточными гепатитами. Клинически могут быть сглаженные и манифестные формы, с развитием внепеченочных проявлений. ХРОНИЧЕСКИЙ ЛЕКАРСТВЕННЫЙ ГЕПАТИТ Его рассматривают как длительно протекающее воспалительное заболевание печени, обусловленное негативным эффектом медикаментов. Оно может быть связано как с прямым токсическим воздействием лекарств или их метаболитов, так и с идиосинкразией к ним. При этом идиосинкразия может проявляться метаболическими либо иммунологическими нарушения-ми. Поэтому, видимо, лекарственный гепатит (ЛГ) может быть подобен вирусному или аутоиммунному с антиядерными и антимикросомальными антителами. При аутоиммунном варианте ЛГ воспалительный процесс в печени быстро исчезает после отмены препаратов. ХРОНИЧЕСКИЙ КРИПТОГЕННЫЙ ГЕПАТИТ Под ним, согласно новой классификации 1994г., "следует понимать заболевание печени с характерными для ХГ морфологическими изменениями при исключении вирусной, аутоиммунной или лекарственной этиологии" (Desmet V. и соавт., 1994г.). СТЕПЕНЬ АКТИВНОСТИ ПРОЦЕССА является следующим после этиологии новым критерием ХГ. Ее установлению способствуют как лабораторные тесты, так и морфологическое исследование биоптатов печени. Морфологические критерии активности процесса новая классификация рекомендует определять с использованием полуколичественного метода и подсчетом гистологического индекса степени активности (ГИСА) по R.G.Knodell. ГИСА учитывает в баллах следующие морфологические компоненты ХГ:
ГИСА оценивается от 1 до 3 баллов как "минимальный" ХГ, от 4 до 8 баллов как "мягкий или слабовыраженный" ХГ от 9 до 12 баллов как "умеренный" ХГ, от 13 до 18 баллов как "тяжелый" ХГ. Новая классификация, к сожалению, не рассматривает проявления активности процесса за пределами печени, особенно при вирусном и АГ. Но все же внепеченочные (системные) проявления необходимо учитывать, поскольку они в значительной степени являются отражением активности гепатита. СТАДИЯ ЗАБОЛЕВАНИЯ (по V.Desmet et all, 1994) характеризует степень хронизации процесса и оценивается только гистологически по выраженности фиброза в печени, с подсчетом гистологического индекса стадии хронизации (ГИСХ). Варианты фиброза: портальный, перипортальный (включая порто-портальные, порто-центральные септы). Порто-центральные септы более важны для развития ЦП. Выделяют:
II стадию хронизации (умеренная степень фиброза: порто- портальные септы одна или более); III стадию хронизации (тяжелая степень фиброза: порто-центральные септы одна или более); IV стадия (цирроз). ПРИМЕРЫ ФОРМУЛИРОВКИ ДИАГНОЗА
АЛКОГОЛЬНОЕ ПОРАЖЕНИЕ ПЕЧЕНИ Алкогольный гепатит, как указано выше, сохраняет свое существование только в рамках МКБ-10. Причем наиболее частой формой поражения печени при алкоголизме является алкогольный стеатоз, далее - алкогольный гепатит с трансформацией в ЦП. Поражение печени возникает при ежедневном употреблении не менее 80 г этанола в течение 5-8 лет (10 г этанола содержатся в 25 мл водки или в 85 мл вина или в 230 мл пива). Факторами риска алкогольной болезни печени являются:
- злоупотребление алкоголем с молодого возраста
Алкогольная болезнь развивается в результате:
Клинические симптомы алкогольной болезни неспецифичны: диспепсия, боли в верхнем квадранте живота, энцефалопатия, гепатомегалия с преимущественным увеличением левой доли печени. При лабораторных исследованиях выделяют лейкоцитоз, соотношение АсАТ/АлАТ 2:1, снижение уровня гамма-глютамилтранспептидазы на фоне абстиненции. СОВРЕМЕННЫЕ ПОДХОДЫ К ЛЕЧЕНИЮ ХРОНИЧЕСКИХ ГЕПАТИТОВ С учетом классификации ХГ комплексная терапия заболевания должна учитывать степень активности патологического процесса в печени, ведущего синдрома болезни, наличия признаков цирротической стадии, фазы развития вирусной инфекции. ЛЕЧЕНИЕ АУТОИММУННОГО ГЕПАТИТА В лечении АГ используют 2 схемы: монотерапия преднизолоном и сочетание преднизолона с 6-меркаптопурином (азатиоприном). Комбинированное лечение предпочтительнее, так как дает значительно меньше побочных эффектов. Монотерапия преднизолоном проводится больным, имеющим противопоказания к назначению цитостатиков (цитопения, желтуха). Доза преднизолона - 30-40 мг/сут в течение месяца, далее ежемесячно суточную дозу снижают на 5 мг; поддерживающая доза составляет 10-15 мг/сут. Терапия длительная, не менее 2 лет. Комбинированную терапию преднизолоном и 6-меркаптопурином проводят при нарастании активности процесса на фоне уменьшения дозы преднизолона, а также при быстром развитии осложнений преднизолонотерапии, при учете отсутствия противопоказаний к цитостатикам. Чаще используют две схемы лечения. Одна из них предусматривает включение азатиоприна после предшествующего 1-2 месячного курса преднизолонотерапии при снижении дозы последнего до 15-20 мг/сут. Назначают азатиоприн из расчета 1,5 мг/кг, в среднем 50-100 мг/сут. Поддерживающие дозы преднизолона составляют 5-10 мг/сут., азатиоприна - 25 мг/сут. По другой схеме комбинированной терапии преднизолон и азатио-прин назначают одновременно. В течение первой недели преднизолон идет в дозе 30 мг/сут., 2-й - по 20 мг/сут., 3-й и 4-й - по 15 мг, а с 5-й недели переходят на прием поддерживающей дозы 10 мг/сут. Доза азатиоприна на всем протяжении составляет 50 мг/сут. Поддерживающая терапия независимо от избранной схемы должна проводиться в течение 1-2 лет после достижения стойкой клинико-морфологической ремиссии. ЛЕЧЕНИЕ ВИРУСНЫХ ХГ При любых синдромах и любой степени активности обязательна базисная терапия, которая включает:
Целесообразен прием лактулозы, нормазе, плохо всасывающихся антибиотиков, энтеродеза, энтерола, при необходимости - ферментов (панкреатин, фестал и др.). 4. Гепатопротекторы, обладающие некоторым метаболическим дей- ствием:
7. Психологические (психотерапия, гипноз и др.) и социально-профессиональные аспекты терапии. ЭТИОТРОПНАЯ И ИММУНОМОДУЛИРУЮЩАЯ ТЕРАПИЯ Наибольшее значение в терапии вирусных гепатитов имеют этиотропные препараты, основным из которых является интерферон (ИФН). Назначение ИФН и других противовирусных препаратов целесообразно только в репликативную фазу вирусной инфекции, ведущим маркером которой служит выявление в крови и ткани печени нуклеиновых кислот вирусов. Интерфероны представляют собой группу низкомолекулярных пептидов, обладающих противовирусной, противоопухолевой, иммунорегуля-торной активностью. В настоящее время выделяют два типа ИФН. I тип включает в себя альфа-ИФН и бета-ИФН, II тип – гамма-ИФН. Подразделение на типы обусловлено различной биологической ролью. Если альфа- и бета-ИФН свойственна в основном противовирусная активность, стимуляция выработки противовоспалительных цитокинов, экспрессия антигенов HLA I класса, то гамма-ИФН является универсальным эндогенным иммуностимулятором: под его воздействием усиливается связывание антигенов клетками, экспрессия антигенов HLA, повышается ответ лимфоцитов на митогены, лизис клеток-мишеней, продукция иммуноглобулинов, фагоцитарная активность макрофагов и их кооперативное взаимодействие с Т- и В-клетками; он ингибирует рост опухолевых клеток и подавляет внутриклеточное размножение бактерий и простейших, способствует дифференцировке Т-лимфоцитов. Кроме того, ИФН одного класса может потенцировать действие ИФН другого класса. Продукция ИФН осуществляется: Альфа - ИФН - В-лимфоцитами, нулевыми лимфоцитами, макрофагами; Бета - ИФН - фибробластами, эпителиальными клетками, макрофагами; Гамма – ИФН - NK-лимфоцитами и Т-лимфоцитами (субпопуляции CD3+, CD4+, CD8+, CD 11+) при наличии вспомогательных клеток (моноциты, макрофаги, дендритные клетки). На современном этапе ИФН являются основным средством этиотроп-ной терапии вирусных гепатитов. Широко используются как нативный (лейкоцитарный), т.е. получаемый из культуры лейкоцитов человека, так и синтезируемый при помощи рекомбинантной техники ИФН. Гамма -ИФН получил меньшее распространение. Различий в терапевтической эффективности нативного и рекомбинантного ИФН не выявлено. Применяются следующие препараты ИФН: Альфа - ИФН: nl, nЗ - из культуры лейкоцитов; 2а, 2Ь, 2с - рекомбинантные; Бета - ИФН : n - из культуры фибробластов, г, la, lb - рекомбинантные; Гамма -ИФН: r, lb - рекомбинантные. Все звенья противовирусного эффекта ИФН до конца не изучены. По современным представлениям, клетки под влиянием ИФН приобретают "противовирусное состояние" в результате связывания его со специфическим клеточным рецептором, что приводит к активации внутриклеточных ферментов, в частности 2′, 5′- олигоаденилсинтетазы и так называемых эф-фекторных белков. Это, в свою очередь, вызывает активацию нутриклеточ-ных рибонуклеаз, разрушающих вирусную транспортную РНК. Кроме того, ИФН ингибируют процесс "раздевания", трансляции, сборки вирусов в процессе репликации. В противовирусном эффекте играют также роль некоторые защитные иммунные механизмы: усиление экспрессии антигенов HLA I типа на поверхности инфицированных клеток, стимуляция макрофагов, узнающих вирус-НЬА-антигенный комплекс на поверхности клеточной мембраны, усиление активности цитотоксических Т- и NK-лимфоцитов. Уникальные свойства ИФН способствовали активной разработке различных технологий его производства и сделали препараты интерферона незаменимыми в терапии внутриклеточных инфекций. В таблице 1 представлены зарегистрированные в нашей стране препараты ИФН. |
