ответы экзамен. Эволюция пищеварительной системы и особенности питания у представителей разных классов позвоночных животных
 Скачать 7.56 Mb. Скачать 7.56 Mb.
|
|
Эволюционные аспекты формирования и закрепления гемоглобина и его модификаций в животном мире, а также закрепления за гемоглобином функции транспорта кислорода. Весьма любопытно, что имеющий столь сложное строение гемоглобин распространен так широко в животном и даже растительном мире и при этом встречается у совершенно разных систематических групп организмов. В добавление к тому, что он имеется почти у всех позвоночных, гемоглобин тут и там встречается и в ряде других типов, включая простейших, а также у растений и бактерий. Часто его находят только у одного или нескольких представителей какой-либо обширной группы; иногда он имеется у паразита, но отсутствует у родственных свободноживущих форм и т.д. Когда была установлена роль гемоглобина в ускорении диффузии кислорода, особенности его распространения сделались более понятными. Структурную основу гема — небелковой части молекулы гемоглобина — составляет порфириновое ядро, которое имеется у всех растений и животных в молекулах клеточных ферментов, принадлежащих к системе цитохромов. Относительно небольшие биохимические перестройки могут превратить эту исходную структуру в пигмент типа гемоглобина, обратимо связывающий кислород. Вместе с тем, для того, чтобы такие мутации прочно закрепились, они должны давать какое-то эволюционное преимущество, которое способствовало бы их сохранению. Самое очевидное и ближайшее преимущество — то, что гемоглобин и миоглобин улучшает доставку кислорода, облегчая его диффузию в тканях. После того как система синтеза гемоглобина сформировалась, дальнейшее улучшение транспорта кислорода может быть достигнуто путем добавления конвекционного транспорта (т.е. крови и циркуляторной системы, приводящей кровь в движение). Формирование полной циркуляторной системы — это сложное изменение, которое потребовало бы не только относительно небольших химических модификаций порфирина, но и сложных морфологических и физиологических изменений во всем организме. Такие радикальные изменения, конечно, возможны, но вряд ли они могут осуществиться в один или несколько этапов. Напротив, появление гемоглобина в любой ткани сразу же обеспечивает организму выгоду, связанную с облегченной диффузией, и обусловливает селективное преимущество для закрепления нового признака. Следующим шагом могло быть создание условий для включения гемоглобина в уже существующую кровеносную систему и тем самым — для дальнейшего улучшения доставки кислорода путем конвекции. Из этой гипотетической последовательности событий вытекает, что: разрозненные случаи появления гемоглобина в растительном и животном мире объясняются повсеместным присутствием железопорфириновых соединений, облегченная диффузия кислорода через растворы с гемоглобином дает первый толчок для сохранения биохимического механизма синтеза гемоглобина в клетках добавление гемоглобина к уже существовавшей конвекционной системе (циркуляторной системе) логически становится следующим шагом в эволюционной истории. Свертывание крови и гемостаз у беспозвоночных и позвоночных животных. Потерю крови при разрыве кровеносных сосудов у животных и человека помогают предотвращать несколько механизмов. Во-первых, большая кровопотеря ведет к снижению кровяного давления и тем самым сама по себе замедляет вытекание крови из поврежденного участка. Во-вторых, поврежденные сосуды сжимаются и таким образом уменьшают поток крови, что обуславливает уменьшение и дальнейшей кровопотери. И, наконец, в-третьих, самый важный механизм, предотвращающий кровотечение, — это закупорка кровеносных сосудов в месте повреждения временной пробкой (тромбом), состоящей из свернувшегося белка и клеточных элементов крови (рис). Такая пробка (кровяной сгусток, или тромб) полностью останавливает кровотечение при незначительных повреждениях, но если разорваны крупные сосуды, ее недостаточно. Для остановки кровотечения в крупных сосудах необходима активация ферментативного свертывания крови (или собственно гемокоагуляции), в результате которого образуется тромб, состоящий из нитей нерастворимого белка фибрина, задерживающих форменные элементы крови. Механизм свертывания, или коагуляции, крови хорошо изучен у млекопитающих, особенно у человека, так как этот процесс имеет большое значение в медицине. Для того чтобы механизм свертывания был эффективным, он должен действовать быстро, а в то же время кровь внутри сосудистой системы не должна загустевать. В связи с этим, крови, с одной стороны, должна быть внутренне присуща способность свертываться, и соответствующий механизм должен быть готовым включиться, как только это будет нужно. С другой стороны, иметь такой механизм — все равно что сидеть на бомбе, в связи с чем необходимы все предосторожности против его случайного срабатывания (наличие антикоагулянтов и других факторов, ограничивающих данный процесс на различных его этапах). У позвоночных кровяной сгусток состоит из белка фибрина — нерастворимого фибриллярного белка, образующегося из фибриногена— растворимого белка, который содержится в нормальной плазме в количестве около 0,3%. Для превращения фибриногена в фибрин необходим катализатор — фермент тромбин, и кровь не свертывается внутри сосудистой системы именно потому, что в циркулирующей крови этого фермента нет. Однако тромбин может быстро образовываться, так как его предшественник — протромбин— в плазме уже имеется. Для инициации свертывания необходимо, чтобы из протромбина образовался тромбин. Но это только последний шаг в сложной последовательности биохимических реакций, которую медленно расшифровывали, изучая больных с различными дефектами механизма свертывания (например, гемофилией). Всего идентифицировано 12 плазменных факторов свертывания крови, которым даны номера от I до XIII (термин «фактор VI» теперь не используется, поскольку он является активированной формой фактора V (проакцелератор-глобулина)). Биологическое значение ферментативного свертывания крови, по-видимому, состоит в том, что механизм свертывания крови работает как биохимический усилитель (MacFarlane, 1964). Он обычно приводится в действие при контакте крови с инородной поверхностью или поврежденными тканями. Это инициирует цепь ферментативных реакций, в которой фермент, образовавшийся на первом этапе, служит катализатором или активатором для следующего этапа, и т.д. Таким образом, собственно гемокоагуляция представляет собой «ферментативный каскад», завершающийся образованием кровяного сгустка, когда растворимый фибриноген переходит в нерастворимый фибрин. Такая цепь ферментативного усиления позволяет сгустку образовываться быстро и в то же время обеспечивает значительный порог безопасности, предотвращающий спонтанное свертывание крови внутри сосудистой системы. Аналогия с обычной электронной системой усиления здесь очевидна. Если нужен низкий уровень шума, используют несколько ступеней с малым усилением на каждой ступени, а не одну ступень с большим усилением. Это минимизирует вероятность того, что случайный шум в системе сможет запустить конечную ступень, и гарантирует достаточную степень безопасности. Для большинства беспозвоночных механизм гемостаза так же важен, как и для позвоночных. Тот факт, что многие из них имеют незамкнутые системы кровообращения, осложняет дело, поскольку в такой системе сжатие кровеносных сосудов ничем не может помочь. С другой стороны, в незамкнутой системе кровяное давление всегда ниже, и это уменьшает вероятность потери большого объема жидкости. Два гемостатических механизма позвоночных — свертывание крови и местное сужение сосудов — имеют свои аналоги и у беспозвоночных. Самый простой механизм у беспозвоночных — это агглютинация (склеивание) клеток крови без участия белков плазмы, в результате чего образует клеточный тромб, являющийся аналогом нашему тромбоцитарному тромбу (Gregoire, Tagnon, 1962). Вслед за агглютинацией начинается образование клеточных сетей, которые сжимаются и помогают затянуть рану. К этому часто добавляется сокращение мышц стенки тела, способствующее закрытию раны. У многих членистоногих, особенно у ракообразных, описано и настоящее свертывание, вызываемое ферментативными превращениями нестабильных белков крови. Механизм свертывания у беспозвоночных, там, где он есть, биохимически отличен от соответствующего механизма позвоночных. Например, у позвоночных свертывание тормозится гепарином — мукополисахаридом, который можно выделить из печени, а также тучных клеток и базофилов млекопитающих. Вместе с тем, гепарин не оказывает никакого влияния на систему свертывания крови мечехвоста (Limulus) и почти не влияет на кровь ракообразных (Needham, 1970). Сведения относительно механизмов свертывания крови у беспозвоночных очень неполны, но имеющиеся данные указывают на то, что такие механизмы, вероятно, возникали в ходе эволюции много раз независимо друг от друга. Особенности строения жаберного аппарата и системы кровообращения у двоякодышащих рыб в сравнении с рыбами, использующими только жаберное дыхание. Наземные позвоночные возникли от древних кистеперых рыб, обитавших в пресных мелководных, богатых растительностью тропических водоемах, отчасти заболоченных. В таких водоемах часто возникал дефицит растворенного в воде кислорода (в связи с усиленным гниением отмиравших растений). Важным приспособлением к жизни в этих условиях было развитие легких, позволявших при дефиците кислорода в воде дышать атмосферным воздухом. Среди современных костных рыб близкий образ жизни ведут родственные кистеперым рыбам двоякодышащие, тогда как единственный доживший до наших дней вид кистеперых — латимерия — обитает в морских глубинах и легкие для дыхания не использует. Морфо-физиологической особенностью рыб, дышащих и жабрами, и легкими (древние кистеперые и современные двоякодышащие), является решение проблемы рационального использования обоих органов газообмена. Дело в том, что при нормальном для рыб жаберном дыхании обогащенная кислородом кровь из передних жабр поступает в голову, тогда как из задних — в спинную аорту, несущую кровь назад по всему телу. Легкие сформировались позади глотки, т.е. позади самых задних жабр. И поэтому если кровь из легких, как из жабр, направить прямо в корни аорты, то эта артериальная кровь поступит в спинную аорту, а органы головы (и, в частности, головной мозг, особенно нуждающийся в постоянном поступлении кислорода) не смогут ее использовать. Поэтому возникает необходимость нового перераспределения крови. Эта проблема была решена возвращением артериальной крови из легких в сердце (т.е. образованием дополнительного легочного, или малого, круга кровообращения) и формированием в сердце особых приспособлений для перераспределения крови. Сердце двоякодышащих рыб состоит из венозного синуса (получающего, как обычно у рыб, венозную кровь), предсердия (разделенного перегородкой на 2 части), желудочка (частично разделенного на 2 части) и артериального конуса. В предсердии, желудочке и артериальном конусе имеются неполные внутренние перегородки (в частности, спиральный клапан артериального конуса), позволяющие разделить кровь, поступившую из левой и правой половин предсердия. Венозный синус впадает в правую половину предсердия, тогда как в левую его половину впадают легочные вены, приносящие артериальную кровь из легких. Из левой половины предсердия артериальная кровь поступает в нижнюю часть сильно укороченной брюшной аорты и по ней — к двум передним парам приносящих жаберных артерий; затем эта кровь поступает по сонным артериям в голову. Из правой половины предсердия венозная кровь направляется в верхнюю часть брюшной аорты и по ней — к двум задним (ближайшим к сердцу) парам жаберных артерий. Эта кровь при нормальном содержании кислорода в воде и соответственно функционирующем жаберном дыхании насыщается кислородом на уровне жабр, после чего по выносящим жаберным артериям частично попадает в спинную аорту (а по ней разносится по организму), а частично (от самой задней пары жабр) в легочные артерии, несущие ее к легким. Легочные артерии начинаются от четвертой (самой задней) пары выносящих жаберных артерий и направляются к легким, где образуют капиллярные сети, оплетающие альвеолярные мешки. Обогащенная кислородом артериальная кровь из легких по легочным венам возвращается к сердцу (к левой части предсердия). Эта кровь направляется в левую часть желудочка, а затем через артериальный конус и короткую брюшную аорту распределяется в передние приносящие жаберные артерии, которые доставляют ее в нефункционирующие передние жабры, откуда она попадает в переднюю часть спинной аорты, а затем по сонным артериям направляется к голове. Даже в случае нефункционирующего легочного дыхания, но при функционирующем жаберном, к голове все равно направляется оксигенированная кровь. Связано это с тем, что артериальная кровь, оттекающая от функционирующих задних двух пар жабр (ближних к сердцу) через легочные артерии направляется сначала в легкие (где в случае водного дыхания она не оксигенируется, чего и не требуется, поскольку она и так оксигенирована в задних жабрах), а затем по легочным венам доставляется к сердцу и выбрасывается в переднюю часть брюшной аорты, образующей передние приносящие жаберные артерии. После прохождения крови через передние жабры она попадает в переднюю часть спинной аорты, откуда по сонным артериям направляется к голове. Таким образом, организация циркуляторной системы у двоякодышащих рыб позволяет направлять к голове кровь богатую кислородом, как при легочном, так и при жаберном дыхании. Механизм распределения крови в сердце двоякодышащих рыб лабилен и позволяет направлять больше или меньше крови в передние или задние жаберные артерии в зависимости от физиологического состояния рыбы и от того, какой орган (легкие или жабры) в данный момент работают интенсивнее. В венозной системе у двоякодышащих рыб редуцирована правая задняя кардинальная вена, зато появился новый магистральный венозный ствол — задняя полая вена, несущая кровь из воротной системы почек прямо в венозный синус, минуя Кювьеровы протоки. 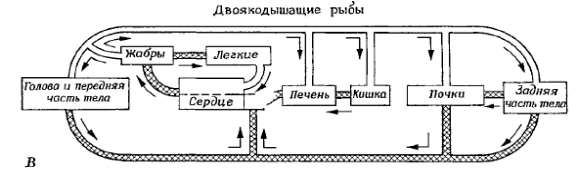 Рис. Схема строения системы кровообращения у двоякодышащих рыб 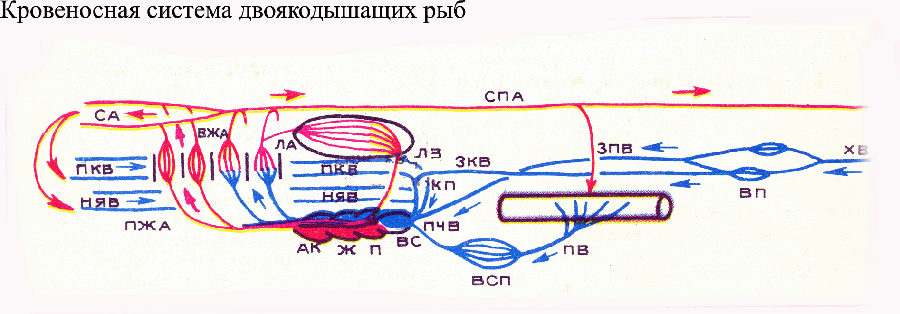 вс — венозный синус (принимает венозную кровь из магистральных вен), п — предсердие (разделено перегородкой на две части, левая его часть принимает кровь из легочных вен, а правая – из венозного синуса), ж — желудочек сердца (не полностью разделен перегородкой на 2 части, из левой части артериальная кровь через артериальный конус выбрасывается в передние приносящие жаберные артерии, которые идут к передним редуцированным жаберным дугам, через которые кровь течет, минуя жаберные лепестки, а, следовательно, не вступает в газообмен с омывающей жабры водой, которая может быть бедна кислородом; затем эта кровь по выносящим жаберным артериям попадает в головную часть спинной аорты, от которой отходят сонные артерии, кровоснабжающие голову), ак — артериальный конус, ба — брюшная аорта, пжа — приносящие жаберные артерии, вжа — выносящие жаберные артерии, са — сонная артерия, ла — легочная артерия (ответвляется от выносящих жаберных артерий, несущих кровь от задних жабр, направляются к легким), лв – легочные вены (несут оксигенированную кровь из легких в левую половину предсердия) спа — спинная аорта, хв — хвостовая вена (собирает кровь от задней части тела, направляется к почкам, образуя воротную систему почек), вп — воротная система почек, зпв — задняя полая вена (несет кровь от почек в венозный синус, минуя Кювьеровы протоки), зкв и пкв — задняя и передняя кардинальные вены, пв — подкишечная вена (собирает кровь от кишечника и селезенки и направляется к печени, образуя воротную систему печени), всп — воротная система печени, пчв — печеночная вена, Кп — Кювьеров проток, няв — нижняя яремная вена. Все магистральные вены впадают в правую часть венозного синуса. Таким образом, жабры двоякодышащих рыб частично получают кровь, которая уже прошла через легкие. Если бы жабры были такими же, как у обычных рыб, это могло бы быть невыгодным, так как двоякодышащая рыба, плавающая в бедной кислородом воде, тогда отдавала бы кислород из крови в воду, омывающую жабры. Однако у двоякодышащих рыб жабры частично подверглись дегенерации (особенно передние 2 пары), и некоторые из жаберных дуг пропускают прямой сквозной поток крови. Предсердие разделено перегородкой на две камеры, и желудочек тоже частично разделен. В этом отношении сердце двоякодышащих рыб несколько напоминает полностью разделенное сердце млекопитающих, птиц и крокодилов. В сердце двоякодышащих рыб даже больше структурных подразделений, чем у амфибий. Из легких кровь возвращается в левое предсердие, а правое предсердие получает кровь из главного круга кровообращения (через венозный синус). Частичное разделение желудочка не позволяет двум потокам крови сильно перемешиваться, так что оксигенированная кровь направляется главным образом в две первые жаберные дуги и голова относительно хорошо снабжается кислородом. Менее насыщенная кислородом кровь из правой половины сердца течет через задние жаберные дуги (не редуцированные и вступающие в газообмен с водой) и попадает в спинную аорту и частично в легкие. Двоякодышащие рыбы сделали первый шаг к полному разделению легочного круга циркуляции крови и круга циркуляции через остальные части тела. Из анатомии двоякодышащих рыб не ясно, каким же образом в действительности течет кровь. Исследования на живой африканской рыбе Protopterus показали, что легочная циркуляция и общий круг кровообращения функционально в большой мере разделены, причем бедная кислородом кровь преимущественно направляется в легкие, а богатая кислородом — в сосуды всего тела. Особенно важно то, что это функциональное разделение достигает наивысшей степени непосредственно после вдыхания воздуха, когда содержание кислорода в легких максимально, тогда как позднее, в промежутке между вдохами, степень разделения уменьшается. Для эффективности газообмена в легких, которые наполняются свежим воздухом лишь через определенные интервалы времени, значение этого обстоятельства очевидно. |
