Фармацевтической химии. Фармацевтической химии
 Скачать 2.17 Mb. Скачать 2.17 Mb.
|
На экспертизу поступил лекарственный препарат из группы пуринового ряда. Представляет собой белый мелкокристаллический порошок. В холодной воде медленно растворим (1:10), растворим в этаноле при кипячении. При кипячении с раствором гидроксида натрия выделяется аммиак.
На экспертизу поступил лекарственный препарат из группы пиримидинотиазолового ряда, который является двойной солью. Представляет собой белый кристаллический порошок со слабым характерным запахом, напоминающим запах дрожжей. Легко растворим в воде и практически не растворим в эфире и хлороформе. Легко подвергается окислению в щелочной среде. Общеалкалоидные реакции, реакции на ион хлора и тиохромная проба положительны.
Для проведения контроля качества субстанции никотиновой кислоты фармацевт-аналитик приготовил раствор в соответствии с частной статьей. К 2 мл полученного раствора прибавил 2 мл раствора цианобромида, 3 мл раствора 25г/л анилина и встряхивал до появления желтого окрашивания.
На экспертизу поступил лекарственный препарат - раствор кислоты никотиновой 1%, для инъекций, в состав которого входит стабилизатор гидрокарбонат натрия.
Химико-фармацевтическое предприятие закупило субстанцию фторурацила для производства инъекционного раствора препарата. При анализе субстанции для ее идентификации фармацевт-аналитик провел минерализацию со смесью для спекания. Полученный остаток растворил в хлороводородной кислоте и добавили раствор кальция хлорида, в результате появилась белая опалесценция.
В соответствии с требованиями нормативного документа количественное определение субстанции барбитала проводят методом кислотно-основного титрования. Препарат растворяют в диметилформамиде и титруют до эквивалентной точки раствором гидроксида натрия в смеси бензола и метанола, используя индикатор тимоловый синий.
Химико-фармацевтическое предприятие закупило субстанцию для производства таблеток фенобарбитала 0,1г. При анализе качества установ-лено, что результаты испытаний на прозрачность и степень окраски раствора не соответствуют требованиям нормативного документа. Испытания на чистоту показали завышенное содержание примеси, определенной потенциометрическим методом, значение рН водного раствора составило 3,8.
Химико-фармацевтическое предприятие закупило субстанцию токоферола ацетата для производства инъекционного раствора препарата. При анализе субстанции для ее идентификации фармацевт-аналитик провел щелочной гидролиз, к продуктам которого добавил кислоту серную концентрированную и вылил полученную смесь в колбу с водой, при этом появился характерный запах этилацетата.
Химико-фармацевтическое предприятие закупило субстанцию для производства таблеток эфедрина. При анализе качества субстанции фармацевт-аналитик для идентификации провел нагревание с раствором гексацианоферрата калия (III), при этом выделяется продукт, который обнаруживают по запаху горького миндаля.
Химико-фармацевтическое предприятие закупило субстанцию для производства таблеток «Прозерин». При анализе качества действующего компонента таблеток неостигмина метилсульфата для идентификации использовалось нагревание с 30% раствором гидроксида натрия. При этом выделяется продукт, который далее обнаруживают по запаху и окрашиванию влажной лакмусовой бумаги в синий цвет.
В испытательной лаборатории при анализе субстанции метронидазола для ее идентификации использовалась реакция гидрирования нитрогруппы до аминогруппы по реакции, приведенной ниже.
При проведении фармакопейного анализа таблеток индометацина 0,025 г фармацевт-аналитик определил методом тонкослойной хроматографии содержание посторонних примесей по совокупности величины и интенсивности окраски их пятен на хроматограмме, суммарное количество которых составило 1,5%; содержание индометацина в одной таблетке в граммах, определенное методом УФ-спектрофотометрии, составило 0.022, что не соответствует требованиям нормативного документа.
При определении количественного содержания субстанции викасола фармацевт-аналитик в колбу для титрования добавил цинковую пыль, хлороводородную кислоту и другие компоненты, согласно методики нормативного документа.
Химико-фармацевтическое предприятие закупило субстанцию для производства таблеток метронидазола 0,25 г. При анализе качества установлено, что субстанция представляет собой белый с розоватым оттенком кристаллический порошок. При испытании на цветность интенсивность окраски полученного раствора превышает интенсивность окраски эталона GY6, температура плавления в интервале от 160 до 163°С, что не соответствует требованиям нормативного документа.
При анализе субстанций норсульфазола и стрептоцида растворимого было обнаружено, что препараты не соответствует требованиям фармакопейной статьи по разделу «Описание»: представляют собой аморфные порошки жёлтого цвета. |
Какие нежелательные процессы явились причиной изменения стабильности препаратов?
|гидролиз и окисление с образованием азосоединений
|полимеризация с образованием комплексных соединений
|восстановление препаратов
|пиролиз с образованием газообразных продуктов
|возгонка препаратов
Какие оптимальные условия хранения необходимы для поддержания стабильности субстанции?
|в защищенном от света месте
|при температуре не ниже 0°С
|при температуре не выше 25°С
|без доступа двуокиси углерода воздуха
|во флаконе, залитом парафином
С какой целью фармацевт-аналитик использовал цинковую пыль?
|для восстановления препарата
|для окисления препарата
|для выделения сульфита натрия
|для образования β-метилнафталина
|для образования сульфоната натрия
Какие нежелательные процессы явились причиной изменения стабильности препарата?
|гидролиз препарата при температуре выше 25˚С
|полимеризация препарата на свету и температуре выше 25˚С
|окисление препарата при контакте с окислителями
|нарушены условия синтеза
|гидролиз препарата при температуре ниже 0˚С
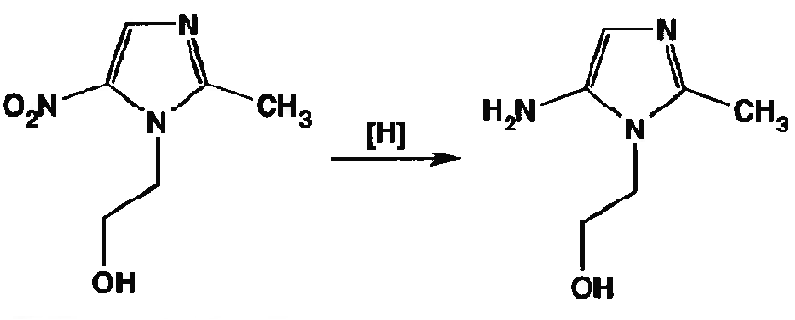
По какой реакции идентифицируют образовавшийся продукт?
|образование азокрасителя
|образование каролина
|выделение аммиака
|образование эфира
|образование этилового спирта
Какой продукт образовался в результате расщепления исследуемого препарата в щелочной среде?
|диметиламин
|метанол
|изонитрил
|формальдегид
|этилацетат
Какой продукт образовался в результате расщепления эфедрина?
|бензальдегид
|ацетальдегид
|этилацетат
|формальдегид
|изонитрил
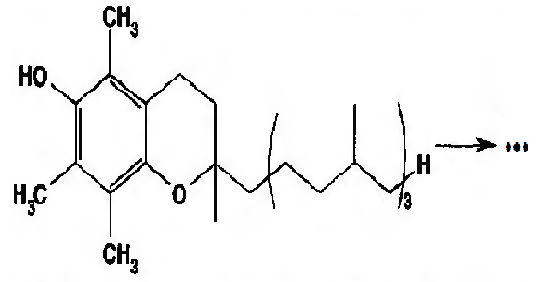
По какой функциональной группе фармацевт-аналитик идентифицировал лекарственный препарат?
|остаток уксусной кислоты
|сложноэфирную группу
|фенольный гидроксил
|фитольный радикал
|ядро хромана
Какая примесь явилась причиной несоответствия препарата требованиям нормативного документа?
|фенилбарбитуровая кислота
|этилбарбитуровая кислота
|диэтиловый эфир фенилэтилмалоновой кислоты
|этиловый эфир фенилуксусной кислоты
|этиловый эфир фенилмалоновой кислоты
С какой целью фармацевт-аналитик растворяет препарат в диметилформамиде?
|для усиления кислотных свойств
|для усиления основных свойств
|для нейтрализации кислотных свойств
|для улучшения растворимости субстанции
|для катализирования реакции
По какой функциональной группе фармацевт-аналитик идентифицировал лекарственный препарат?
|фторид-ионы
|метильный радикал
|пиримидиновый цикл
|амидная группа
|кето-группа
Каким методом количественного анализа целесообразно определить кислоту никотиновую в данной лекарственной форме?
|куприметрия
|ацидиметрия
|алкалиметрия
|йодометрия
|цериметрия.
Какой показатель качества субстанции никотиновой кислоты определил фармацевт-аналитик?
|идентификация
|предельное содержание хлоридов
|количественное определение
|предельное содержание тяжелых металлов
|родственные примеси
На какой лекарственный препарат следует провести дополнительные испытания подлинности?
|тиамина хлорид
|тиамина бромид
|бенфотиамин
|фосфотиамин
|кокарбоксилаза