Физиология дыхания
 Скачать 1.59 Mb. Скачать 1.59 Mb.
|
|
Комплекс Бетцингера. Данный отдел дыхательного центра расположен в области n. retrofacialis. Большинство клеток комплекса Бетцингера относится к экспираторным нейронам. Функционально нейроны этого отдела неоднородны. Здесь обнаружены экспираторные нейроны, дающие проекции в каудальные отделы дыхательного центра и характеризующиеся нарастающим паттерном активности. Аксоны нейронов отдают множество коллатералей, большинство которых идет в направлении других вентральных отделов дыхательного центра. Экспираторные нейроны этого комплекса образуют моносинаптические тормозные проекции в направлении бульбоспинальных инспираторных нейронов дорсальной и вентральной дыхательных групп, каудальной группы ядер шва и других образований ствола. В вентральной части комплекса Бетцингера описана группа мелких нейронов с экспираторной активностью. Дендриты этих нейронов образуют широкие разветвления вблизи вентральной поверхности продолговатого мозга. Предполагают, что эта группа нейронов принимает участие в механизме центральной хеморецепции. Вышеописанные структуры, собственно, и образуют дыхательный центр продолговатого мозга. По современным представлениям, их вполне достаточно для генерации дыхательного ритма. На уровне организма как системы в регуляции дыхания принимают участие и другие структуры центральной нервной системы. Среди них особое место с давних пор занимают структуры варолиева моста. В настоящее время известно, что в процессе регуляции дыхания принимают участие нейроны группы А5 и А6, содержащие катехоламины, межтройничная область, а также каудальная часть ретикулярной формации моста. Наибольшее количество нейронов, разряжающихся синхронно с дыхательными фазами, обнаружено в области между парабрахиальными ядрами и ядрами Келликера-Фузе. Эта область получила название пневмотаксического центра, а совокупность находящихся здесь нейронов – понтинной дыхательной группы. Отличительной особенностью этой группы является присутствие высокого процента нейронов с пиком активности, приходящимся на момент перехода фаз дыхательного цикла. Поэтому допускается, что нейроны данной группы принимают непосредственное участие в механизмах переключения дыхательных фаз. Нейроны понтинной дыхательной группы дают широкие проекции к клеткам всех отделов бульбарного дыхательного центра (бульбоспинальным, глоточным, подъязычным мотонейронам, к спинальным мотонейронам дыхательных мышц). Получены данные, что нейроны промежуточной части ядра Келликера-Фузе контролируют постинспираторную моторную активность. Нейроны понтинной дыхательной группы получают афферентацию от различных популяций нейронов бульбарного дыхательного центра. Предполагается, что одной из важных функций нейронов этой группы является адаптация респираторных рефлексов (рефлекс Геринга-Брейера) и дыхательных рефлексов с каротидных хеморецепторов. Из этого следует, что структуры варолиева моста могут играть более значительную роль в формировании нормального и патологического паттернов дыхания, чем предполагалось ранее. Необходимо также отметить, что конкретные отношения между структурами варолиева моста и бульбарного дыхательного центра, определяющие генерацию и контроль дыхательного паттерна, остаются пока неизвестными. Несмотря на достаточно обширные сведения о нейронном составе дыхательного центра, механизмы автоматической генерации дыхательного ритма до настоящего времени остаются невыясненными. Отсутствует интегральная теория ритмогенеза дыхания. В настоящее время предлагаются три модели генерации ритма дыхания: модель нейронных сетей, пейсмекерная модель и гибридная модель. Согласно модели нейронных сетей, для генерации дыхательного ритма необходима сеть дыхательных нейронов с различными функциональными свойствами, взаимодействующих между собой с помощью возбуждающих и тормозных синаптических связей. Кроме того, сетевой пейсмекер требует обязательного притока самой разнообразной афферентации, которая на выходе из сети становится ритмической. Данная модель совпадает по сути с существующим мнением о рефлекторной природе автоматии дыхательного центра. Недостатком этой модели является отсутствие экспериментального подтверждения тормозных проекций от ранних инспираторных к постинспираторным. В пейсмекерных моделях основой генерации ритма являются функции нейронов с пейсмекерными свойствами, которые обусловлены особенностями мембранной проводимости. В истинных пейсмекерах мембрана спонтанно с определенной периодичностью становится проницаема для ионных деполяризующих токов. На сегодня, пейсмекерные клетки были найдены в основном в условиях in vitro у плодов или новорожденных животных. В гибридных моделях клетки с пейсмекерными свойствами являются составной частью нейронной сети, синаптические взаимодействия внутри которой в комбинации со свойствами отдельных нейронов регулируют паттерн активности моторных респираторных нейронов. 4.2. Нервная регуляция дыхания. Регуляция дыхания является рефлекторной. Важный принцип, который лежит в основе системы управления дыханием – принцип управления с самоадаптацией. Задача полной системы управления дыханием – согласование и объединение трех подсистем (химической, мышечной и управления воздухоносными путями) таким образом, чтобы обеспечить равенство вентиляционного и метаболического газообмена при минимальном расходе энергии на дыхание. Самоадаптация дыхательной системы предполагает взаимодействие всех контуров управления в ответ на возмущающие факторы в соответствии с заданной «уставкой». Дыхательную систему рассматривают как систему автоматического регулирования по отклонению. Управление дыханием осуществляется по принципу обратной связи: отклонение регулируемых параметров (PаCO2 и PaO2) от требуемых значений воздействует через рецепторы на дыхательный центр так, что происходят изменения МОД, приводящие к компенсаторному уменьшению возникающих отклонений. Кроме того, в системе управления дыханием используется и регулирование по возмущению. Так, увеличение МОД при мышечной деятельности возникает под влиянием импульсации, приходящей от работающих мышц и сигналов, которые поступают из высших отделов ЦНС. Эта информация о предстоящих отклонениях в газовом составе артериальной крови вызывает ответ ДЦ, который обеспечивает упреждающее увеличение МОД, что предупреждает последующие изменения газового состава крови. Оценка значения сигналов о возмущении и выработка адекватного по величине ответного изменения МОД происходят путем самообучения, которое направлено на предупреждение и уменьшение отклонений в газовом составе артериальной крови. При неадекватном изменении МОД наступает отклонение газового состава артериальной крови. Путем обратной связи происходит приближение МОД к должной величине и выработка более точного условно-рефлекторного ответа на сигнал о возмущении. Таким образом, управление внешним дыханием осуществляется самообучающейся комбинированной системой, которая основана на регуляции как по отклонению, так и по возмущению. Нервная регуляция дыхания начинается с раздражения специфических и неспецифических рецепторов и сигналов из супрабульбарных отделов. Выделяют хеморецепторный и механорецепторный контуры регулирования. Каждый дыхательный рефлекс реализуется в структурах одного из основных контуров управления дыхательной системой. Хеморецепторный контур регулирования включает периферические (артериальные) (рис.10) и центральные хеморецепторы. Периферические хеморецепторы расположены в месте бифуркации общих сонных артерий и в дуге аорты, а также в каротидных и аортальных тельцах в непосредственной близости с артериальными барорецепторами, но раздельно от них. Периферические хеморецепторы – это специализированные рецепторные клетки, которые возбуждаются в основном при снижении артериального рО2 и увеличении в артериальной крови рСО2. Эффекты уменьшения рО2 и увеличения рСО2 в артериальной крови опосредуются на уровне 1 типа клеток каротидных или аортальных телец. Периферические хеморецепторы иннервированы волокнами нейронов, тела которых расположены в солитарном комплексе и ретроамбигуальном ядре. При возбуждении периферических хеморецепторов сигналы по волокнам синокаротидного нерва передаются к инспираторным нейронам дорсальной дыхательной группы дыхательного центра, активация которого вызывает увеличение вентиляции легких и усиление поступление кислорода в организм человека. Увеличение вентиляции легких при стимуляции периферических хеморецепторов низким рО2 и повышенным рСО2 называется периферическим хеморефлексом, функция которого заключается в поддержании нормального уровня напряжения кислорода в артериальной крови посредством регуляции вентиляции легких. Выраженное проявление этого рефлекса наблюдается только при уменьшении содержания кислорода во вдыхаемом воздухе ниже 60 мм рт. ст. Центральные хеморецепторы представляют собой нейроны, которые расположены в ростральных вентро-латеральных отделах продолговатого мозга, в частности в позадитрапециевидном ядре, а также в области ядер шва и голубого пятна. При увеличении концентрации Н+ ионов внеклеточной жидкости мозга происходит закрытие специфических калиевых каналов мембраны хеморецепторных нейронов, что вызывает деполяризацию мембранного потенциала. В результате деполяризации происходит высвобождение медиатора АТФ в синаптическую щель, что вызывает в дальнейшем генерацию потенциалов действия в афферентных чувствительных волокнах, которые передаются к нейронам дыхательного центра и обусловливают активацию генерации дыхательного ритма. В результате происходит увеличение вентиляции легких и восстановление нормальной величины рН внеклеточной жидкости мозга. При уменьшении рН внеклеточной жидкости мозга на 0,01 единицы величина вентиляции легких возрастает в среднем на 4л/мин. 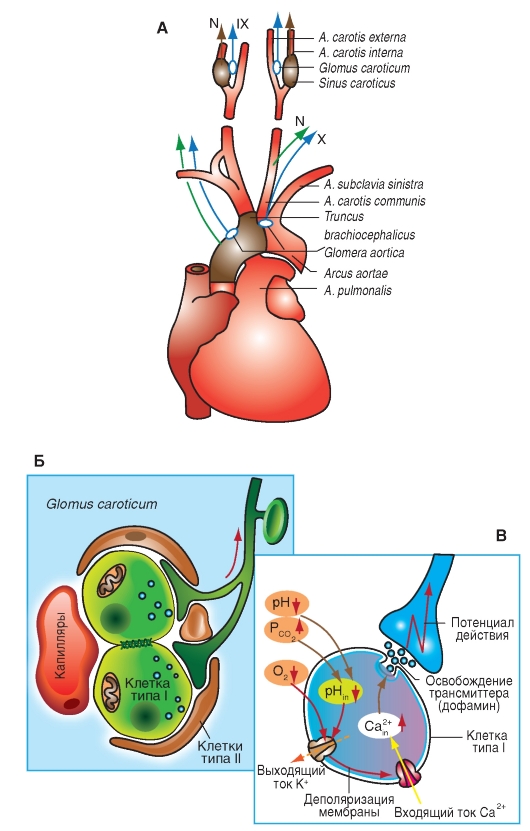 Рис.10. Периферические хеморецепторы. А – каротидные тельца (glomera carotica) в месте бифуркации сонной артерии получают кровь из наружной сонной артерии (a.carotis externa) и иннервируются языкоглоточным нервом (IX пара). По аортальным тельцам циркулирует кровь из аорты и они иннервируются ветвями блуждающего нерва (n.vagus, X пара). Б – показаны две клетки типа I с их синапсами на афферентных волокнах синусного нерва сонной артерии, причем обе клетки окутаны глиаподобными клетками типа II и имеют тесный контакт с открытыми капиллярами. В – схематически представлены механизмы передачи сигнала с помощью медиатора (трансмиттера). Рис. взят из кн. .А.К.Камкин, И.С.Киселева «Атлас по физиологии», т.2, 2012. Изменения рН в области центральных хеморецепторов обусловлены изменениями рСО2 в артериальной крови. Увеличение вентиляции легких при стимуляции центральных хеморецепторов Н+ - ионами водорода называется центральным хеморефлексом. Функция этого рефлекса заключается в поддержании значения рН внеклеточной жидкости мозга в пределах физиологической нормы. Механорецепторный контур регулирования осуществляется при участии трех типов механорецепторов легких: 1) быстро адаптирующихся рецепторов растяжения легких; 2) медленно адаптирующихся рецепторов легких; 3) J-рецепторов. От быстро адаптирующихся рецепторов (ирритантные) начинаются рефлекторные дуги защитных дыхательных рефлексов. Ирритантные рецепторы расположены в эпителии и субэпителиальном слое от верхних дыхательных путей до альвеол. Эти рецепторы стимулируются механическими или химическими раздражителями (пыль, слизь, табачный дым, пары едких веществ, например, аммиак, эфир). Раздражение рецепторов слизистой носовой полости посредством афферентных нервных волокон тройничного нерва вызывает рефлекс чихания; рецепторов эпифаренгиальной области – через волокна языкоглоточного нерва - нюхательный или аспирационный рефлекс; раздражение рецепторов слизистой гортани и трахеи – через волокна блуждающего нерва – кашлевой рефлекс. Эти рецепторы отвечают за рефлекторные изменения типа дыхания при большом количестве легочных заболеваний и являются также причиной сужения бронхов и спазма гортани. При стимуляции медленно адаптирующихся рецепторов легких, локализованных в гладких мышцах бронхов и трахеи, в экспериментах на животных возникает рефлекс Геринга-Брейера. Данный тип рецепторов связан афферентными нервными волокнами блуждающего нерва с нейронами дорсальной дыхательной группы дыхательного центра. Стимуляция этих рецепторов при увеличении объема легких на вдохе вызывает прекращение фазы вдоха и начинается фаза выдоха. Во время сна у человека рефлекторное выключение вдоха с помощью рефлекса Геринга - Брейера обусловливает периодическую смену фаз вдоха и выдоха. Современные исследования показали, что у человека саморегуляция дыхания через блуждающие нервы (рефлекс Геринга-Брейера) не имеет такого значения как у животных. У человека тормозный рефлекс Геринга-Брейера не возникает при нормальном дыхательном объеме. Для его возникновения требуется растяжение легких, превышающее обычный дыхательный объем. Активация рецепторов растяжения легких вызывает также рефлекторное расширение бронхов (бронходилятацию) и стимуляцию сердечной активности, что имеет значение при физической работе. В настоящее время считается, что отсутствие тормозного дыхательного рефлекса у человека является результатом возросшей у него в процессе эволюции активностью мозга и развитием речи, которые приводят к подавлению поступающих в нервную систему импульсов с рецепторов легких. J-рецепторы формируются окончаниями немиелизированных (С-волокна) и тонких миелизированных афферентных волокон блуждающего нерва. Они находятся в области стенки альвеолярных легочных капилляров или в интерстиции легочной ткани. Они возбуждаются при скоплении жидкости в альвеолярной стенке (отек) и под влияние ряда биологически активных веществ (гистамина, брадикинина, простагландина), которые освобождаются при заболеваниях и травмах легкого. Возбуждение этих окончаний ведет к апное, снижению частоты сердечных сокращений и артериального кровяного давления, а также к спазму гортани и уменьшению активности скелетной мускулатуры в связи с торможением α-мотонейронов. Это комплексный соматический и висцеральный рефлекторные ответы. В формировании дыхания широко участвуют собственные спинальные рефлексы дыхательных мышц. За исключением диафрагмы, дыхательные мышцы, так же как и другие поперечно полосатые мышцы, содержат мышечные веретена (рецепторы растяжения), которые передают их афферентное влияние не только спинальным мотонейронам самих дыхательных мышц, но и респираторным нейронам продолговатого мозга. На этой основе деятельность дыхательных мышц может приспосабливаться к сопротивлению легких и грудной клетки. Функции мотонейронов дыхательных мышц. Электрические импульсы от инспираторных и экспираторных бульбоспинальных нейронов дыхательного центра передаются по аксонам к мотонейронам сегментов спинного мозга: С3-С5 и Т1-Т12. Аксоны мотонейронов С3-С5 образуют диафрагмальные нервы, которые иннервируют мышечные волокна диафрагмы, а аксоны мотонейронов сегментов Т1- Т12 иннервируют наружные и внутренние межреберные мышцы. Активация электрической активности этих мотонейронов под влиянием команд из дыхательного центра вызывает сокращение диафрагмы, наружных или внутренних межреберных мышц, что приводит к изменениям грудной полости в фазу вдоха или выдоха. При глубоком дыхании у человека становится активной фаза выдоха за счет активации экспираторных нейронов вентральной дыхательной группы дыхательного центра Нисходящие команды от экспираторных нейронов дыхательного центра через мотонейроны, иннервирующих мышцы живота и внутренние межреберные мышцы вызывают сокращение экспираторных мышц. Это дает возможность увеличить глубину или частоту дыхания, и в целом, увеличить вентиляцию легких 4.3. Роль супрабульбарных структур головного мозга в регуляции дыхания. Дыхание осуществляется автоматически во время бодрствования, сна и бессознательного состояния. Автоматическая система регулирования поддерживает оптимальное для текущего момента напряжение газов в крови и тканях в соответствии с интенсивностью метаболизма и участвует в обеспечении постоянства внутренней среды организма. В зависимости от энергетических затрат определяется характер дыхания. Автоматическая (метаболическая) система регуляции дыхания осуществляется ДЦ без непосредственного и детального управления со стороны вышестоящих по иерархии структур ЦНС. Человек может и произвольно изменять частоту и глубину дыхательных движений. Без целенаправленного управления дыхательными движениями невозможна речь, пение и тренировка дыхания. Но такое сознательное вмешательство происходит на фоне автоматически регулируемого ритма дыхания, а не вопреки ему (Сафонов В.А., 2000). История изучения роли коры головного мозга в регуляции дыхания длится более века. Давно известны изменения дыхания при различных эмоциональных состояниях у людей: радостное известие сопровождается учащением дыхания, при плаче делается быстрый и сравнительно глубокий вдох, а затем продолжительный выдох. При страхе дыхание становится ускоренным, поверхностным. Во время умственной работы дыхание учащается. При решении математических задач было отмечено замедление дыхательных движений и пульса. Целый ряд исследователей, начиная с В.Я. Данилевского (1874,1876), применяя метод электростимуляции различных зон коры головного мозга, наблюдали многообразную картину изменений дыхания. На основании экспериментальных данных сложилось два взгляда на значение коры мозга в регуляцию дыхания. По одному мнению, в коре больших полушарий мозга имеются «специфические дыхательные центры», которые ответственны либо за активацию, либо за угнетение дыхания. Согласно второй точке зрения в коре нет никаких дыхательных центров. В 50-х годах двадцатого столетия М.В. Сергиевский на основе своих работ и работ своих учеников выдвинул положение о том, что между дыхательным центром и супрабульбарными структурами устанавливаются «функциональные подвижные созвездия» или «констелляции». Основой для формирования таких констелляций является наличие многообразных связей дыхательного центра с супрабульбарными структурами мозга. М.В.Сергиевский впервые указал на то, что формирование связей дыхательного центра с супрабульбарными структурами является механизмом приспособления дыхания к изменяющимся условиям внешней и внутренней среды. Более высокая степень адаптации дыхания осуществляется с участием коры головного мозга. Дальнейшие исследования подтвердили теоретическое предположение М.В.Сергиевского. Так, Асратян заключил, что кора мозга в регуляции дыхания принимает значительное участие, которое сравнимо с регуляцией соматических функций. Была установлена тесная функциональная связь различных областей коры с ядрами дыхательного центра. Важные сведения о корковой регуляции дыхания были получены методом условных рефлексов. К.М.Быков экспериментально установил условнорефлекторное изменение дыхания у собак. Отметил при этом, что одномоментное выключение зрительных, слуховых и обонятельных рецепторов у собак приводило к утрате способности животных образовывать условные дыхательные рефлексы. К настоящему времени накоплен достаточный экспериментальный материал, который убедительно показал, что влияния коры больших полушарий головного мозга реализуются через ядра дыхательного центра. Так, сенсомоторная кора при электрической стимуляции вызывала активацию инспираторных и ретикулярных нейронов ретикулярного гигантоклеточного ядра, в электрофизиологических исследованиях установлены функциональные связи коры мозга с дорсальным и вентральным дыхательными ядрами. Следует заметить, что большой вклад в изучение роли супрабульбарных структур в регуляции деятельности дыхательного центра внесли работы Н.А.Меркуловой и ее учеников. Кроме новой коры, в организации и регуляции дыхания большое значение имеет лимбическая система. Многие исследователи, изучая роль лимбических структур в регуляции висцеральных функций, отмечали самые разнообразные изменения дыхания при изменении функций передней области поясной извилины, миндалины. Отмечены функционально асимметричные влияния 24 поля лимбической коры правой и левой гемисфер на паттерн дыхания, на активность дыхательных мышц правой и левой половин грудной клетки (Михайлова Н.Л., Ведясова О.А.). Были получены экспериментальные данные о влияниях на дыхательный центр красных ядер и черной субстанции (Н.А.Меркулова и др.). Выяснено, что указанные структуры реализуют свои влияния на уровне структур бульбарного дыхательного центра. Наиболее выраженными были изменения биоэлектрической активности экспираторных нейронов амбигуального ядра и ретикулярных нейронов гигантоклеточного ядра. Большинство известных анатомических путей из красного ядра и черной субстанции имеют проекции на гигантоклеточное ретикулярное ядро. Гигантоклеточное ядро считается структурой, которая воспринимает периферические и центральные афферентные сигналы и передает их в другие структуры бульбарного дыхательного центра. Красные ядра и черная субстанция являются своеобразными коллекторами сенсомоторной информации от вышележащих отделов головного мозга и афферентации, идущей с периферии. Это позволяет красным ядрам и черной субстанции обеспечивать изменения дыхания, адекватное выполнению двигательных реакций. Самые разнообразные изменения дыхательных нейронов и дыхания в целом наблюдались при стимуляции ядер гипоталамуса. Гипоталамус является ядерным образованием и высшим вегетативным центром. Вместе с этим гипоталамус принимает участие в образовании мотиваций и эмоций, которые лежат в основе различных типов поведения. Дыхательный центр автоматически регулирует ритм и глубину дыхательных движений. Однако можно вмешаться в его работу, произвольно меняя объем легочной вентиляции или даже на некоторое время задерживая дыхательные движения. Сознательное регулирование акта дыхания осуществляется с обязательным участием высшего отдела нервной системы – коры больших полушарий. При организации различных типов поведения формируется соответствующее функциональное состояние мозга с обязательным участием тех или иных областей новой коры, структур лимбики, ядер гипоталамуса, структур ствола мозга, мозжечка и др. образований, которое и обеспечит адаптивные изменения соматических и вегетативных образований, в том числе и дыхательного центра. Дыхательный центр, интегрируя информацию с различных рецепторов и структур мозга, обеспечит тот паттерн дыхания, который будет эффективным при данном типе поведения и в данных условиях. |
