Патфиз ч.2. Патфиз ч. Гл. 11 Нарушения водного обмена Гл. 12 Нарушения ионного обмена
 Скачать 7.84 Mb. Скачать 7.84 Mb.
|
|
Термин «гипоксия» этимологически и содержательно трактуют двояко. • Одни авторы за основу берут терминологический элемент oxy как относящийся к кислороду — oxygenium (кислород). В такой трактовке термин «гипоксия» определяют следующим образом:
Синонимами понятия «гипоксия» в такой трактовке являются «кислородное голодание» и «кислородная недостаточность». •Другие автры терминологический элемент oxy трактуют как относящийся к окислению (от англ. oxydation — окисление). В этом варианте термин «гипоксия» применяют в более широком смысле:
Такая трактовка термина «гипоксия» означает абсолютную или относительную недостаточность уровня реального энергообеспечения по сравнению с уровнем функциональной активности и интенсивности пластических процессов в органе, ткани, организме. Это состояние приводит к нарушению жизнедеятельности организма в целом, расстройствам функций органов и тканей. Морфологические изменения в них имеют различный масштаб и степень, вплоть до гибели клеток и деструкции неклеточных структур. ГИПОКСЕМИЯ Гипоксия (в любом варианте трактовки) нередко сочетается с гипоксемией.
АНОКСИЯ И АНОКСЕМИЯ В связи с разработкой проблемы гипоксии в эксперименте (например, при работе с препаратами изолированных органов, фрагментов тканей или клеток) создают условия аноксии — отсутствия кислорода и, как правило, прекращения процессов биологического окисления — или аноксемии — отсутствия кислорода в крови, применяемой для перфузии отдельных органов, тканей, клеток или субклеточных структур. В целостном живом организме формирование этих состояний невозможно. КРИТЕРИИ КЛАССИФИКАЦИИ ГИПОКСИЙ Гипоксические состояния классифицируют с учётом различных критериев: этиологии, выраженности расстройств, скорости развития и длительности гипоксии. ЭТИОЛОГИЯ По этиологии выделяют несколько типов гипоксии (рис. 15–1), условно объединяемых в две группы: экзогенные (нормо и гипобарическую гипоксию) и эндогенные. 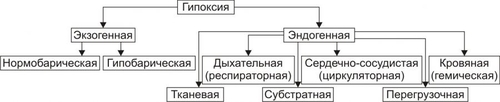 Рис. 15–1. Типы гипоксии по этиологии. ВЫРАЖЕННОСТЬ РАССТРОЙСТВ По критерию выраженности расстройств жизнедеятельности организма различают следующие виды гипоксии: лёгкую, среднюю (умеренную), тяжёлую, критическую (опасную для жизни, летальную). В качестве основных признаков той или иной выраженности (тяжести) гипоксии используют следующие: • степень нарушения нервнопсихической деятельности, • выраженность расстройств функций ССС и дыхательной систем, • величину отклонений показателей газового состава и КЩР крови, а также некоторых других показателей. СКОРОСТЬ ВОЗНИКНОВЕНИЯ И ДЛИТЕЛЬНОСТЬ По критериям скорости возникновения и длительности гипоксического состояния выделяют несколько его разновидностей. МОЛНИЕНОСНАЯ Молниеносная (острейшая) гипоксия развивается в течение нескольких секунд. Как правило, через несколько десятков секунд (в пределах первой минуты) после действия причины гипоксии выявляется тяжёлое состояние пациента, нередко служащее причиной его смерти (например, при разгерметизации летательных аппаратов на большой (более 9000–11 000 м) высоте или в результате быстрой потери большого количества крови (например, при ранениях крупных артериальных сосудов или разрыве аневризмы их стенки). ОСТРАЯ Острая гипоксия развивается через несколько минут (как правило, в пределах первого часа) после воздействия причины гипоксии (например, в результате острой кровопотери или острой дыхательной недостаточности). ПОДОСТРАЯ Подострая гипоксия формируется в течение нескольких часов (но в пределах первых суток). Примерами такой разновидности могут быть гипоксические состояния, развивающиеся в результате попадания в организм метгемоглобинообразователей (нитратов, окислов азота, бензола), венозной кровопотери, медленно нарастающей дыхательной или сердечной недостаточности. ХРОНИЧЕСКАЯ Хроническая гипоксия развивается и/или длится более чем несколько суток (недели, месяцы, годы), например, при хронической анемии, сердечной или дыхательной недостаточности. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ РАЗЛИЧНЫХ ТИПОВ ГИПОКСИИ ЭКЗОГЕННЫЙ ТИП ГИПОКСИИ К экзогенным типам гипоксии относят нормо и гипобарическую гипоксию. Причина их развития: уменьшение парциального давления кислорода (pO2) в воздухе, поступающем в организм. • При нормальном барометрическом давлении говорят о нормобарической экзогенной гипоксии. • При снижении барометрического давления экзогенную гипоксию называют гипобарической. НОРМОБАРИЧЕСКАЯ ЭКЗОГЕННАЯ ГИПОКСИЯ Причины нормобарической экзогенной гипоксии: ограничение поступления в организм кислорода с воздухом при нормальном барометрическом давлении. Такие условия складываются при: • Нахождении людей в небольшом и/или плохо вентилируемом пространстве (помещении, шахте, колодце, лифте). • При нарушениях регенерации воздуха и/или подачи кислородной смеси для дыхания в летательных и глубинных аппаратах, автономных костюмах (космонавтов, лётчиков, водолазов, спасателей, пожарников). • При несоблюдении методики ИВЛ. ГИПОБАРИЧЕСКАЯ ЭКЗОГЕННАЯ ГИПОКСИЯ Причины гипобарической экзогенной гипоксии: снижение барометрического давления при подъёме на высоту (более 3000–3500 м, где pO2 воздуха снижено примерно до 100 мм рт.ст.) или в барокамере. В этих условиях возможно развитие либо горной, либо высотной, либо декомпрессионной болезни. • Горная болезнь наблюдается при подъёме в горы, где организм подвергается воздействию не только пониженного содержания кислорода в воздухе и пониженного барометрического давления, но также более или менее выраженной физической нагрузки, охлажения, повышенной инсоляции и других факторов средне и высокогорья. • Высотная болезнь развивается у людей, поднятых на большую высоту в открытых летательных аппаратах, на креслахподъёмниках, а также — при снижении давления в барокамере. В этих случаях на организм действуют в основном сниженные pO2 во вдыхаемом воздухе и барометрическое давление. • Декомпрессионная болезнь наблюдается при резком снижении барометрического давления (например, в результате разгерметизации летательных аппаратов на высоте более 10 000–11 000 м). При этом формируется опасное для жизни состояние, отличающееся от горной и высотной болезни острым или даже молниеносным течением. ПАТОГЕНЕЗ ЭКЗОГЕННЫХ ГИПОКСИЙ К основным звеньям патогенеза экзогенной гипоксии (независимо от её причины) относятся артериальная гипоксемия, гипокапния, газовый алкалоз, сменяющийся ацидозом; артериальная гипотензия, сочетающаяся с гипоперфузией органов и тканей. • Снижение напряжения кислорода в плазме артериальной крови (артериальная гипоксемия) — инициальное и главное звено экзогенной гипоксии. Гипоксемия ведёт к уменьшению насыщения кислородом Hb, общего содержания кислорода в крови и как следствие — к нарушениям газообмена и метаболизма в тканях. • Снижение напряжения в крови углекислого газа (гипокапния). Она возникает в результате компенсаторной гипервентиляции лёгких (в связи с гипоксемией). • Газовый алкалоз является результатом гипокапнии. Вместе с тем, следует помнить, что при наличии во вдыхаемом воздухе высокого содержания углекислого газа (например, при дыхании в замкнутом пространстве или в производственных условиях) экзогенная гипоксемия может сочетаться с гиперкапнией и ацидозом. Умеренная гиперкапния (в отличие от гипокапнии) не усугубляет влияний экзогенной гипоксии, а напротив — способствует увеличению кровообращения в сосудах мозга и сердца. Однако значительное увеличение рCO2 в крови приводит к ацидозу, дисбалансу ионов в клетках и биологических жидкостях, гипоксемии, снижению сродства Hb к кислороду и ряду других патогенных эффектов. • Снижение системного АД (артериальная гипотензия), сочетающееся с гипоперфузией тканей в значительной мере являются следствием гипокапнии. CO2 относится к числу основных факторов регуляции тонуса сосудов мозга. Выраженное снижение раCO2 является сигналом к сужению просвета артериол мозга, сердца и уменьшения их кровоснабжения. Эти изменения служат причиной существенных расстройств жизнедеятельности организма, включая развитие обморока и коронарной недостаточности (проявляющейся стенокардией, а иногда — инфарктом миокарда). Параллельно с указанными отклонениями выявляются нарушения ионного баланса как в клетках, так и в биологических жидкостях: межклеточной, плазме крови (гипернатриемия, гипокалиемия и гипокальциемия), лимфе, ликворе. Описанные выше отклонения могут быть уменьшены или устранены путём добавления к вдыхаемому воздуху необходимого (расчётного) количества углекислого газа. ЭНДОГЕННЫЕ ТИПЫ ГИПОКСИИ Эндогенные гипоксические состояния в большинстве случаев являются результатом патологических процессов и болезней, приводящих к недостаточному транспорту к органам кислорода, субстратов обмена веществ и/или использования их тканями. Гипоксия различной выраженности и длительности может также развиться в результате резкого увеличения потребности организма в энергии в связи со значительно возросшими нагрузками (например, при резком повышении физической нагрузки). При этом даже максимальная активация кислородтранспортных и энергопродуцирующих систем не способна ликвидировать энергодефицита (перегрузочная гипоксия). ДЫХАТЕЛЬНАЯ ГИПОКСИЯ Причина дыхательной (респираторной) гипоксии — недостаточность газообмена в лёгких — дыхательная недостаточность. Патогенез Развитие дыхательной недостаточности может быть обусловлено альвеолярной гиповентиляцией, сниженной перфузией кровью лёгких, нарушением диффузии кислорода через аэрогематический барьер, диссоциацией вентиляционноперфузионного соотношения (причины и механизмы развития дыхательной недостаточности см. в главе 23). Вне зависимости от происхождения дыхательной гипоксии, инициальным патогенетическим звеном является артериальная гипоксемия, обычно сочетающаяся с гиперкапнией и ацидозом. Изменения газового состава и рН крови Изменения газового состава и рН крови при дыхательном типе гипоксии представлены на рис. 15–2. 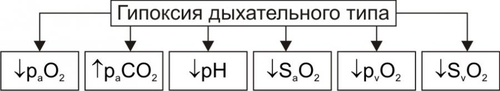 Рис. 15–2. Типичные изменения газового состава и рН крови при гипоксии дыхательного типа. • Снижение раО2 и рvО2 (артериальная и венозная гипоксемия). • Как правило, увеличение раCO2 (гиперкапния). • Ацидоз (на раннем этапе острой дыхательной недостаточности — газовый, а затем и негазовый). • Снижение показателей SaO2 и SvO2 (насыщения Hb, соответственно, артериальной и венозной крови). ЦИРКУЛЯТОРНАЯ ГИПОКСИЯ Причина сердечнососудистой (циркуляторной, гемодинамической) гипоксии: недостаточность кровоснабжения тканей и органов. Патогенез. Недостаточность кровоснабжения формируется на основе гиповолемии, сердечной недостаточности, снижения тонуса стенок сосудов, расстройств микроциркуляции, нарушений диффузии кислорода из капиллярной крови к клеткам. • Гиповолемия — уменьшение общего объёма крови в сосудистом русле и полостях сердца. Это один из важных механизмов развития недостаточности кровообращения и циркуляторной гипоксии. Причины гиповолемии: † Большая кровопотеря. † Гипогидратация организма (например, при хронических поносах, ожоговой болезни, массивном длительном потоотделении). • Сердечная недостаточность проявляется снижением выброса крови из желудочков сердца и как следствие — уменьшением ОЦК. Причины: † Прямое повреждение миокарда (например, кардиотропными токсинами, при его инфаркте, диффузном кардиосклерозе). † Перегрузка миокарда (например, увеличенной массой крови или повышенным сосудистым сопротивлением её току), † Нарушение диастолического расслабления сердца (например, при его сдавлении — тампонаде экссудатом или кровью, накопившимися в полости перикарда). • Снижение тонуса стенок сосудов Снижение тонуса стенок сосудов (как артериальных так и венозных). Это приводит к увеличению ёмкости сосудистого русла и уменьшению ОЦК. Причины: † Снижение адренергических влияний на стенки сосудов (например, при надпочечниковой недостаточности, повреждении нейронов кардиовазомоторного центра). † Доминирование холинергических воздействий (например, при невротических состояниях, на торпидной стадии шока, при отклонениях показателей электролитного баланса и КЩР). † Дефицит минералокортикоидов в организме. Гипотония стенок сосудов любого происхождения обусловливает снижение артериального и перфузионного давлений, а также объёма кровотока в сосудах тканей и органов. • Расстройства микроциркуляции (см. главу 22). • Нарушение диффузии кислорода через стенку микрососудов, в межклеточной жидкости, через плазмолемму и цитозоль к митохондриям. В конечном итоге это приводит к дефициту кислорода в матриксе митохондрий и, следовательно, к снижению интенсивности тканевого дыхания. Причины: † Уплотнение стенок микрососудов (например, при дистрофиях их стенок, васкулитах, артериолосклерозе, интерстициальном отёке, микседеме). † Мембранопатии клеток (например, при активации липопероксидного процесса, клеточных дистрофиях, опухолевом росте). Циркуляторная гипоксия часто является результатом комбинации указанных выше механизмов (например при коллапсе, шоке, надпочечниковой недостаточности и гиперкортицизме различного генеза, артериальной гипер и гипотензии). Виды циркуляторной гипоксии Важной особенностью гипоксии циркуляторного типа является возможность развития локальной и системной её форм. • Локальная гипоксия Причины † Местные расстройства кровообращения (венозная гиперемия, ишемия, стаз). † Регионарные нарушения диффузии кислорода из крови к клеткам и их митохондриям. • Системная гипоксия Причины † Гиповолемия. † Сердечная недостаточность. † Генерализованные формы снижения тонуса сосудов. Изменения газового состава и рН крови Изменения газового состава и рН крови при гипоксии циркуляторного типа представлены на рис. 15–3. 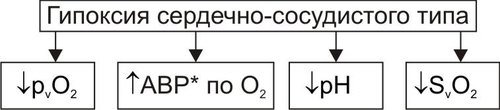 Рис. 15–3. Типичные изменения газового состава и рН крови при гипоксии сердечнососудистого типа. *АВР — артериовенозная разница по кислороду. • Снижение рvО2 (венозная гипоксемия). • Нормальное (как правило) раО2. • Увеличение артериовенозной разницы по кислороду (за исключением вариантов с масштабным «сбросом» крови по артериовенозным шунтам минуя капиллярную сеть). • Негазовый ацидоз. • Снижение SvО2 (исключение — гипоксия при артериовенозном шунтировании). ГЕМИЧЕСКИЙ ТИП ГИПОКСИИ Причина кровяной (гемической) гипоксии: снижение эффективной кислородной ёмкости крови и, следовательно, её транспортирующей кислород функции. Hb является оптимальным переносчиком кислорода. Транспорт кислорода от лёгких к тканям почти полностью осуществляется при участии Hb. Наибольшее количество кислорода, которое способен переносить Hb, равно 1,39 мл газообразного O2 на 1 г Hb. Реально транспортная способность Hb определяется количеством кислорода, связанного с Hb, и количеством кислорода, отданного тканям. При насыщении Hb кислородом в среднем на 96% кислородная ёмкость артериальной крови (VaO2) достигает примерно 20% (объёмных). В венозной крови этот показатель приближается к 14 % (объёмным). Следовательно, артериовенозная разница по кислороду составляет 6%. Патогенез. Главными звеньями механизма снижения кислородной ёмкости крови являются уменьшение содержания Hb в единице объёма крови (и, как правило, в организме в целом) и нарушения транспортных свойств Hb — т.е. анемия (см. гл. 22). В целом гемический тип гипоксии характеризуется снижением способности Hb эритроцитов связывать кислород (в капиллярах лёгких), транспортировать и отдавать оптимальное количество его в тканях. При этом реальная кислородная ёмкость крови может снижаться до 5–10 % (объёмных). • Уменьшение содержания Hb в единице объёма крови Ведущее к гипоксии уменьшение содержания Hb в единице объёма крови и в организме в целом наблюдается при: † Весьма существенном уменьшении числа эритроцитов и/или † снижении содержания Hb (иногда до 40–60 г/л), т.е. при выраженных анемиях. • Нарушения транспортных свойств Hb Нарушения транспортных свойств Hb (гемоглобинопатии) обусловлены изменением его способности к оксигенации в крови капилляров альвеол и дезоксигенации в капиллярах тканей. Эти изменения могут быть наследуемыми или приобретёнными. † Наследуемые гемоглобинопатии. Причиной наследуемого снижения свойства Hb транспортировать кислород к тканям чаще всего являются мутации генов, сопровождающиеся нарушением аминокислотного состава глобинов. Существует множество наследственных гемоглобинопатий. Так, в каталоге OMIM наследственных болезней человека (каталог проф. Виктора МакКьюсика) зарегистрировано не менее 700 аллелей глобинов. См. также статьи «Гемоглобин» и «Гемоглобинопатии» в приложении «Справочник терминов». † Приобретённые гемоглобинопатии. Причинами приобретённых гемоглобинопатий чаще всего является повышенное содержание в крови метгемоглобинообразователей, окиси углерода, карбиламингемоглобина, нитроксигемоглобина. ‡ Метгемоглобинообразователи — группа веществ, обусловливающих переход иона железа из закисной формы (Fe2+) в окисную (Fe3+). Последняя форма обычно находится в связи с OН–. К метгемоглобинообразователям относятся нитраты, нитриты, хиноны, соединения хлорноватистой кислоты, некоторые ЛС (сульфаниламиды, фенацетин, амидопирин), эндогенные перекисные соединения. Образование метгемоглобина (MetHb) — обратимый процесс. Устранение метгемоглобинообразователя из организма сопровождается переходом (в течение нескольких часов) железа Hb в закисную форму. Участвующая в этом процессе МК дегидрируется в пировиноградную. MetHb не способен переносить кислород. В связи с этим кислородная ёмкость крови снижается. Учитывая, что MetHb имеет тёмнокоричневую окраску, кровь и ткани организма также приобретают соответствующий оттенок. ‡ Окись углерода обладает высоким сродством (почти в 300 раз больше по сравнению с кислородом) к Hb. Окись углерода содержится в достаточно высокой концентрации в выхлопных газах двигателей внутреннего сгорания, работающих на бензине или керосине; в бытовом газе; в составе многих газов, образующихся в литейном производстве; при обжиге кирпича; при получении ацетона, метанола, аммиака и ряда других веществ. При взаимодействии окиси углерода с Hb образуется карбоксигемоглобин (HbCO), теряющий способность транспортировать кислород к тканям. Количество образующегося HbCO прямо пропорционально рCO и обратно пропорционально рО2 в воздухе. Выраженные нарушения жизнедеятельности организма развиваются при увеличении содержания HbCO в крови до 50% (от общей концентрации Hb). Повышение его уровня до 70–75% приводит к выраженной гипоксемии и смерти. Устранение CO из вдыхаемого воздуха обусловливает диссоциацию HbCO, но этот процесс протекает медленно и занимает несколько часов. HbCO имеет яркокрасный цвет. В связи с этим при его избыточном образовании в организме кожа и слизистые оболочки становятся красными. ‡ Другие соединения Hb (например, карбиламингемоглобин, нитроксигемоглобин) образующиеся под влиянием сильных окислителей, также снижают транспортную способность Hb и вызывают развитие гемической гипоксии. ‡ Образование и диссоциация HbO2 во многом зависят от физикохимических свойств плазмы крови. Изменения рН, осмотического давления, содержания 2,3дифосфоглицерата, реологических свойств снижает транспортные свойства Hb и способность HbO2 отдавать кислород тканям. Изменения газового состава и рН крови Изменения газового состава и рН крови при гемической гипоксии представлены на рис. 15–4. 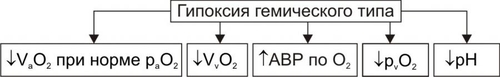 Рис. 15–4. Типичные изменения газового состава и рН крови при гипоксии гемического типа. АВР — артериовенозная разница по кислороду. • Снижение объёмного содержания кислорода в артериальной крови (VaO2 в норме равно 19,5–21 объёмных %). • Нормальное (!) парциальное напряжение кислорода в артериальной крови. • Снижение рvO2 (венозная гипоксемия). • Уменьшение VvO2. • Негазовый ацидоз. • Снижение артериовенозной разницы по кислороду. ТКАНЕВАЯ ГИПОКСИЯ Причины тканевой гипоксии: факторы, снижающие эффективность утилизации кислорода клетками тканей и/или сопряжения окисления и фосфорилирования. Патогенез • Снижение эффективности усвоения кислорода клетками наиболее часто является результатом ингибирования активности ферментов биологического окисления, значительного изменения физикохимических параметров в тканях, торможения синтеза ферментов биологического окисления и повреждения мембран клеток. † Подавление активности ферментов биологического окисления наблюдается при: ‡ Специфическом ингибировании ферментов. Примером могут служить ионы циана (CN–), препятствующие окислению цитохрома. В результате блокируется восстановление железа дыхательного фермента и транспорта кислорода к цитохрому. При этом реакции тканевого дыхания, активируемые другими агентами (не содержащими железо), не ингибируются. Однако, эффективность этих реакций весьма мала и не предотвращает развития гипоксии и нарушений жизнедеятельности. Аналогичные последствия вызывает блокада активных центров ферментов тканевого дыхания антимицином А, соединениями, содержащими сульфидион S2– и некоторыми другими веществами. ‡ Неспецифическом ингибировании ферментов биологического окисления ионами металлов (Ag2+, Hg2+, Cu2+). При этом указанные металлы обратимо взаимодействуют с SH–группами фермента с образованием его неактивной меркаптоидной формы. ‡ Конкурентном ингибировании ферментов биологического окисления. Оно заключается в блокировании активного центра фермента веществом, имеющим структурную аналогию с естественным субстратом реакции. Эффект конкурентного ингибирования фермента может быть устранён или снижен при возрастании содержания в клетке истинного субстрата. В роли конкурентных ингибиторов могут выступать оксалат и малонат, блокирующие взаимодействие сукцината с сукцинатдегидрогеназой в цикле трикарбоновых кислот; фторлимонная кислота, конкурирующая за активный центр аконитазы с цитратом. † Изменения физикохимических параметров в тканях (температуры, электролитного состава, рН, фазового состояния мембранных компонентов) в более или менее выраженной мере снижают эффективность биологического окисления. Отклонение от нормы указанных и других параметров наблюдается при многих болезнях и патологических состояниях: гипертермиях и гипотермиях, недостаточности различных органов (сердца, почек, печени), анемиях и ряде других). † Торможение синтеза ферментов биологического окисления может наблюдаться при общем или частичном (особенно белковом) голодании; при большинстве гипо и дисвитаминозов; нарушении обмена минеральных веществ, необходимых для синтеза ферментов. † Повреждение мембран. В наибольшей мере это относится к мембранам митохондрий. Важно, что выраженная гипоксия любого типа сама по себе активирует многие механизмы, приводящие к повреждению мембран и ферментов клеток с развитием тканевой гипоксии. • Снижение степени сопряжения окисления и фосфорилирования макроэргических соединений в дыхательной цепи. † В этих условиях увеличиваются расход кислорода тканями и интенсивность функционирования компонентов дыхательной цепи. Однако, большая часть энергии транспорта электронов трансформируется в тепло и не используется для ресинтеза макроэргов. Эффективность биологического окисления снижается. Клетки не получают энергетического обеспечения. В связи с этим нарушаются их функции и нарушается жизнедеятельность организма в целом. † Выраженной способностью разобщать процессы окисления и фосфорилирования обладают многие эндогенные агенты (например, избыток Ca2+, H+, ВЖК, йодсодержащие гормоны щитовидной железы), а также экзогенные вещества (2,4динитрофенол, дикумарин, пентахлорфенол, грамицидин и другие). Изменения газового состава и рН крови Изменения газового состава и рН крови при тканевой гипоксии представлены на рис. 15–5. 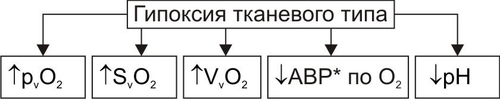 Рис. 15–5. Типичные изменения газового состава и рН крови при гипоксии тканевого типа. *При действии разобщающих агентов может меняться незначительно. • Увеличение парциального напряжения кислорода в венозной крови. • Повышение сатурации Hb кислородом в венозной крови. • Увеличение объёмного содержания кислорода в венозной крови. • Нормальный диапазон рО2, SO2 и VO2 в артериальной крови (в типичных случаях). • Уменьшение артериовенозной разницы по кислороду (исключение — тканевая гипоксия, развившаяся при действии разобщителей окисления и фосфорилирования). • Негазовый ацидоз. СУБСТРАТНЫЙ ТИП ГИПОКСИИ Причины: дефицит в клетках субстратов биологического окисления. В клинической практике речь чаще всего идёт об глюкозе. При этом доставка к клеткам кислорода существенно не нарушена. Патогенез субстратной гипоксии заключается в прогрессирующем торможении биологического окисления. В связи с этим в клетках быстро снижается уровень АТФ и креатинфосфата, величина МП. Изменяются и другие электрофизиологические показатели, нарушаются различные пути метаболизма и пластические процессы. Изменения газового состава и рН крови при субстратной гипоксии представлены на рис. 15–6. 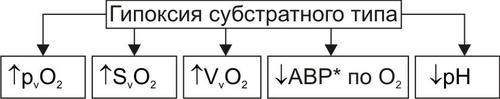 Рис. 15–6. Типичные изменения газового состава и рН крови при гипоксии субстратного типа *АВР — артериовенозная разница по кислороду. • Увеличение парциального напряжения кислорода в венозной крови. • Повышение сатурации кислородом Hb эритроцитов венозной крови. • Возрастание объёмного содержания кислорода в венозной крови. • Уменьшение артериовенозной разницы по кислороду. • Нормальные значения paO2, SaO2, VaO2. • Ацидоз, развивающийся в результате нарушений обмена веществ, гемодинамики, внешнего дыхания и других изменений, обусловленных болезнью или патологическим процессом, вызвавшим гипоксию субстратного типа. Например, при СД — дефицит глюкозы в клетках, в организме накапливаются КТ, лактат, пируват (в связи с нарушением липидного и углеводного обмена), что приводит к метаболическому ацидозу. ПЕРЕГРУЗОЧНЫЙ ТИП ГИПОКСИИ Причины перегрузочной гипоксии: значительное и/или длительное увеличение функции тканей, органов или их систем. При этом интенсификация доставки к ним кислорода и субстратов метаболизма, обмена веществ, реакций сопряжения окисления и фосфорилирования не способны устранить дефицита макроэргических соединений, развившегося в результате гиперфункции клетки. Наиболее часто речь идёт о ситуациях, вызывающих повышенное и/или продолжительное функционирование скелетных мышц и миокарда. Патогенез. Чрезмерная по уровню и/или длительности нагрузка на мышцу (скелетную или сердца) обусловливает: • Относительную (по сравнению с требуемым при данном уровне функции) недостаточность кровоснабжения мышцы. • Дефицит кислорода в миоцитах. Последнее вызывает недостаточность процессов биологического окисления в них. Изменения газового состава и рН крови при перегрузочной гипоксии приведены на рис. 15–7. 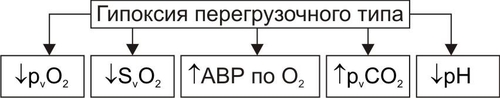 Рис. 15–7. Типичные изменения газового состава и рН крови при гипоксии перегрузочного типа. АВР — артериовенозная разница по кислороду. • Снижение парциального напряжения кислорода в венозной крови (венозная гипоксемия), оттекающей от гиперфункционирующей мышцы. • Уменьшение степени сатурации Hb эритроцитов в венозной крови. • Увеличение артериовенозной разницы по кислороду. • Увеличение парциального напряжения углекислого газа (гиперкапния) в венозной крови, что является результатом активированного метаболизма в ткани мышцы. • Ацидоз в пробах крови, взятой из вены гиперфункционирующей мышцы. СМЕШАННЫЙ ТИП ГИПОКСИИ Смешанный тип гипоксии является результатом сочетания нескольких разновидностей гипоксии. Причины • Факторы, нарушающие два и более механизмов доставки и использования кислорода и субстратов метаболизма в процессе биологического окисления. † Примером могут служить наркотические вещества, способные в высоких дозах угнетать функцию сердца, нейронов дыхательного центра и активность ферментов тканевого дыхания. В результате развивается смешанная гипоксия гемодинамического, дыхательного и тканевого типов. † Острая массивная кровопотеря приводит как к снижению кислородной ёмкости крови (в связи с уменьшением содержания Hb), так и к расстройству кровообращения: развивается гемический и гемодинамический типы гипоксии. • Последовательное влияние факторов, ведущих к повреждению различных механизмов транспорта кислорода и субстратов метаболизма, а также процессов биологического окисления. Такая картина наблюдается при развитии тяжёлой гипоксии любого происхождения. Например, острая массивная потеря крови приводит к гемической гипоксии. Снижение притока крови к сердцу ведёт к уменьшению выброса крови, расстройствам гемодинамики, в том числе — коронарного и мозгового кровотока. Ишемия ткани мозга может обусловить расстройство функции дыхательного центра и вызвать респираторный тип гипоксии. Взаимное потенцирование нарушений гемодинамики и внешнего дыхания приводит к значительному дефициту в тканях кислорода и субстратов метаболизма, к грубым повреждениям мембран клеток, а также ферментов биологического окисления и, как следствие — к гипоксии тканевого типа. Патогенез гипоксии смешанного типа включает звенья механизмов развития разных типов гипоксии. Смешанная гипоксия часто характеризуется взаимопотенцированием отдельных её типов с развитием тяжёлых экстремальных и даже терминальных состояний. Изменения газового состава и рН крови при смешанной гипоксии определяются доминирующими расстройствами механизмов транспорта и утилизации кислорода, субстратов обмена веществ, а также процессов биологического окисления в разных тканях. Характер изменений при этом может быть разным и весьма динамичным. АДАПТИВНЫЕ РЕАКЦИИ ОРГАНИЗМА ПРИ ГИПОКСИИ Действие на организм фактора, вызывающего гипоксию любого типа, сопровождается включением взаимосвязанных процессов двух категорий: • обусловливающих развитие гипоксии и • обеспечивающих адаптацию организма к гипоксии и направленных на поддержание гомеостаза в данных условиях. Процессы первой категории описаны выше. Ниже характеризуются общие механизмы адаптации организма к гипоксии. ОБЩАЯ ХАРАКТЕРИСТИКА ПРОЦЕССА АДАПТАЦИИ К ГИПОКСИИ • При действии даже умеренной гипоксии сразу формируется поведенческая реакция, направленная на поиск среды существования, оптимально обеспечивающая уровень биологического окисления. Человек может направленно менять условия жизнедеятельности с целью устранения состояния гипоксии. • Возникшая гипоксия служит системообразующим фактором: в организме формируется динамичная функциональная система по достижению и поддержанию оптимального уровня биологического окисления в клетках. † Система реализует свои эффекты за счёт активации доставки кислорода и субстратов метаболизма к тканям и включения их в реакции биологического окисления. † В структуру системы входят лёгкие, сердце, сосудистая система, кровь, системы биологического окисления и регуляторные системы. Условно адаптивные реакции подразделены на две группы: экстренной адаптации и долговременной адаптации. ЭКСТРЕННАЯ АДАПТАЦИЯ Механизмы экстренной адаптации к гипоксии рассмотрены на рис. 15–8. 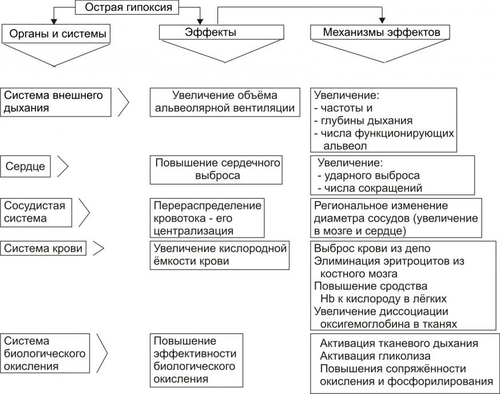 Рис. 15–8. Механизмы экстренной адаптации организма к гипоксии. • Причина активации механизмов срочной адаптации организма к гипоксии: недостаточность биологического окисления. Как следствие, снижается содержание АТФ в тканях, необходимого для обеспечения оптимального уровня жизнедеятельности. • Ключевой фактор процесса экстренной адаптации организма к гипоксии — активация механизмов транспорта O2 и субстратов обмена веществ к тканям и органам. Эти механизмы предсуществуют в каждом организме. В связи с этим они активируются сразу (экстренно, срочно) при возникновении гипоксии и снижении эффективности биологического окисления. • Повышенное функционирование систем транспорта кислорода и субстратов метаболизма к клеткам сопровождается интенсивным расходом энергии и субстратов обмена веществ. Таким образом, эти механизмы имеют высокую «энергетическую и субстратную цену». Именно это является (или может стать) лимитирующим фактором уровня и длительности гиперфункционирования. СИСТЕМА ВНЕШНЕГО ДЫХАНИЯ Недостаточность биологического окисления при гипоксии ведёт к гипервентиляции — возрастанию объёма альвеолярной вентиляции. Причины: активация афферентной импульсации от хеморецепторов (аорты, каротидной зоны сонных артерий, ствола мозга и других регионов организма) в ответ на изменение показателей газового состава крови (снижение раО2, увеличение раCO2 и др.). Механизмы: увеличение частоты и глубины дыхательных движений и числа раскрывшихся резервных альвеол. В результате минутный объём дыхания (МОД) может возрасти более чем на порядок: с 5–6 л в покое до 90–110 л в условиях гипоксии. СЕРДЦЕ При острой гипоксии функция сердца значительно интенсифицируется. Причина: активации симпатикоадреналовой системы. Механизмы • Тахикардия. • Увеличение ударного выброса крови из сердца. • Возрастание интегративного показателя функции сердца — минутного объёма кровообращения (сердечного выброса крови). Если в покое он равен 4–5 л, то при гипоксии может достигать 30–40 л; • Повышение линейной и объёмной скорости кровотока в сосудах. СОСУДИСТАЯ СИСТЕМА В условиях гипоксии развивается феномен перераспределения, или централизации кровотока. Причины и механизмы феномена централизации кровотока • Активация в условиях гипоксии симпатикоадреналовой системы и высвобождение катехоламинов. Последние вызывают сужение артериол и снижение притока крови по ним к большинству тканей и органов (мышцам, органам брюшной полости, почкам, подкожной клетчатке и др.). • Быстрое и значительное накопление в миокарде и ткани мозга метаболитов с сосудорасширяющим эффектом: аденозина, простациклина, ПгЕ, кининов и других. Эти вещества не только препятствуют реализации вазоконстрикторного действия катехоламинов, но и обеспечивают расширение артериол и увеличение кровоснабжения сердца и мозга в условиях гипоксии. Последствия • Расширение артериол и увеличение кровоснабжения мозга и сердца. • Одновременное сужение просвета артериол и уменьшение объёма кровоснабжения в других органах и тканях: мышцах, подкожной клетчатке, сосудах брюшной полости, почках. СИСТЕМА КРОВИ Острая гипоксия любого генеза сопровождается адаптивными изменениями в системе крови: • Активацией выброса эритроцитов из костного мозга и депо крови (в последнем случае — одновременно с другими форменными элементами крови). Причина: высокая концентрация в крови катехоламинов, тиреоидных и кортикостероидных гормонов. В результате при острой гипоксии развивается полицитемия. Следствие: повышение кислородной ёмкости крови. • Повышением степени диссоциации HbO2 в тканях. Причины † Гипоксемия, особенно в капиллярной и венозной крови. В связи с этим именно в капиллярах и посткапиллярных венулах происходит возрастание степени отдачи кислорода HbO2. † Ацидоз, закономерно развивающийся при любом типе гипоксии. † Повышенная в условиях гипоксии концентрация в эритроцитах 2,3дифосфоглицерата, а также других органических фосфатов: АДФ, пиридоксальфосфата. Эти вещества стимулируют отщепление кислорода от HbO2. • Увеличением сродства Hb к кислороду в капиллярах лёгких. Этот эффект реализуется при участии органических фосфатов, в основном — 2,3дифосфоглицерата. При этом важное значение имеет свойство Hb связывать значительное количество кислорода даже в условиях существенно сниженного pО2 в капиллярах лёгких. При pО2 равном 100 мм рт.ст. образуется 96% HbO2, при pО2 80 и 50 мм рт.ст. — 90 и 81% соответственно. СИСТЕМЫ БИОЛОГИЧЕСКОГО ОКИСЛЕНИЯ Активация метаболизма — важное звено экстренной адаптации организма к острой гипоксии. Это обеспечивает: • Повышение эффективности процессов усвоения кислорода и субстратов окисления тканями организма и доставки их к митохондриям. • Активацию ферментов окисления и фосфорилирования, что наблюдается при умеренном повреждении клеток и их митохондрий. • Увеличение степени сопряжения процессов окисления и фосфорилирования адениннуклеотидов: АДФ, АМФ, а также креатина. • Активацию гликолитического пути окисления. Этот феномен регистрируется при всех типах гипоксии, особенно на ранних её этапах. Причины активации гликолиза † Снижение внутриклеточного уровня АТФ и его ингибирующего влияния на ферменты гликолиза. † Увеличение содержания в клетках продуктов гидролиза АТФ (АДФ, АМФ, неорганического фосфата), активирующих ключевые гликолитические ферменты. ДОЛГОВРЕМЕННАЯ АДАПТАЦИЯ Причина включения механизмов долговременной адаптации к гипоксии: повторная или продолжающаяся недостаточность биологического окисления умеренной выраженности. Условия включения механизмов долговременной адаптации к гипоксии • Повторное или длительно продолжающееся воздействие умеренной гипоксии, вызывающее многократную активацию срочных механизмов адаптации. Это обеспечивает формирование структурнофункциональной основы для процессов долговременного адаптации к гипоксии. При этом существенно, чтобы интервал между эпизодами умеренной гипоксии не был слишком велик или мал. † Большой интервал приведёт к ликвидации структурных (субклеточных, клеточных, органнотканевых) адаптивных изменений. † Малый интервал — будет недостаточен для их развития и закрепления. • Выраженность умеренной гипоксии † Гипоксия слишком малой выраженности не активирует механизмов срочной и долговременной адаптации. Регистрируются лишь преходящие реакции в диапазоне физиологического ответа на снижение биологического окисления. † Гипоксия чрезмерной выраженности вызывает срыв процесса адаптации, расстройства функций, обмена веществ и повреждение структур организма. • Оптимальное состояние жизнедеятельности организма. Это позволяет развить механизмы срочной адаптации и закрепить структурнофункциональные изменения, лежащие в основе долговременной адаптации к гипоксии. Недостаточность какихлибо систем организма (дыхательной, ССС, крови, тканевого метаболизма) и/или пластических процессов делают невозможным осуществление адаптивных процессов к гипоксии (как и к другим экстремальным факторам). МЕХАНИЗМЫ ДОЛГОВРЕМЕННОЙ АДАПТАЦИИ Долговременная адаптация к гипоксии реализуются на всех уровнях жизнедеятельности: от организма в целом до клеточного метаболизма. • Особенности механизмов долговременной адаптации к гипоксии † Процессы приспособления к повторной и/или длительной гипоксии формируются постепенно в результате многократной и/или продолжительной активации срочной адаптации к гипоксии. † Переход от несовершенной и неустойчивой экстренной адаптации к гипоксии к устойчивой и долговременной адаптации имеет существенное биологическое (жизненно важное) значение: это создаёт условия для оптимальной жизнедеятельности организма в новых, часто экстремальных условиях существования. † Основой перехода организма к состоянию долговременной адаптированности к гипоксии является активация синтеза нуклеиновых кислот и белков. † Синтетические процессы доминируют в органах, обеспечивающих транспорт кислорода и субстратов обмена веществ, а также в тканях, интенсивно функционирующих в условиях гипоксии. † В отличие от экстренной адаптации к гипоксии, при которой ведущее значение имеет активация механизмов транспорта O2 и субстратов обмена веществ к тканям, основным звеном долговременного приспособления к гипоксии является существенное повышение эффективности процессов биологического окисления в клетках. † Системы, обеспечивающие доставку кислорода и продуктов обмена веществ к тканям (внешнего дыхания и кровообращения), при устойчивой адаптации к гипоксии также приобретают новые качества: повышенные мощность, экономичность и надёжность функционирования. • Системы и главные процессы реализации механизма долговременной адаптации к гипоксии представлены на рис. 15–9. 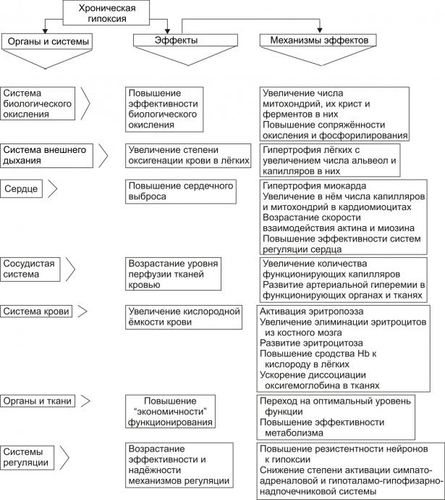 Рис. 15–9. Механизмы долговременной адаптации организма к гипоксии. Системы биологического окисления Системы биологического окисления в тканях обеспечивают оптимальное энергетическое обеспечение функционирующих структур и уровень пластических процессов в них в условиях гипоксии. Это достигается благодаря увеличению: † числа митохондрий и количества крист митохондрий, † числа молекул ферментов тканевого дыхания в каждой митохондрии, а также активности ферментов, особенно — цитохромоксидазы, † эффективности процессов биологического окисления и сопряжения его с фосфорилированием, † эффективности механизмов анаэробного ресинтеза АТФ в клетках. Система внешнего дыхания Система внешнего дыхания обеспечивает уровень газообмена, достаточный для оптимального течения обмена веществ и пластических процессов в тканях. Это достигается благодаря: † Гипертрофии лёгких и увеличению в связи с этим: |
