Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
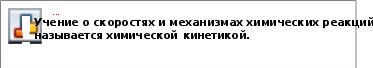
§27. Скорость химических реакций. Химическое равновесиеПрочитайте слова и словосочетания, переведитеих. скорость изменение концентраци медленные реакции природа реагентов быстрые реакции катализатор механизм реакции кинетическое уравнение химическая кинетика внешние факторы  Прочитайте текст 1, придумайте название длянего. Известно, что скорость химических реакций изменяется в широких пределах. Одни реакции происходят мгновенно, например, взаимодействие водорода с кислородом при нагревании. Другие реакции происходят очень медленно, например, окисление железа кислородом воздуха (коррозия). Знание скоростей химических реакций имеет очень большое научное и практическое значение. Большой вклад в развитие химической кинетики внёс советский учёный  Николай Николаевич Семёнов (l896 – 1987). Николай Николаевич Семёнов (l896 – 1987).
  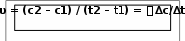 Концентрацию вещества обычно выражают в моль/литр, а время – в с или мин. Измерим концентрацию вещества А в реакции А+B = AB. В начале реакции в некоторый момент времени t1 концентрация вещества А максимальна и равна с1, скорость химической реакции также максимальна. Через некоторое время ∆t = t2 – t1 уменьшится концентрация вещества А и скорость химической реакции также уменьшится. Концентрация вещества А станет с2 (с2 < с1). Средняя скорость химической реакции за указанный промежуток времени Концентрацию вещества обычно выражают в моль/литр, а время – в с или мин. Измерим концентрацию вещества А в реакции А+B = AB. В начале реакции в некоторый момент времени t1 концентрация вещества А максимальна и равна с1, скорость химической реакции также максимальна. Через некоторое время ∆t = t2 – t1 уменьшится концентрация вещества А и скорость химической реакции также уменьшится. Концентрация вещества А станет с2 (с2 < с1). Средняя скорость химической реакции за указанный промежуток времениСкорость химической реакции – величина положительная. Если в уравнении скорости химической реакции учитываются изменения концентрации исходных веществ, то в правой части уравнения ставят знак минус, так как концентрация реагирующих веществ уменьшается. Если же в уравнении учитывается изменение концентраций продуктов реакции, то в правой части уравнения ставят плюс, так как концентрации этих веществ увеличиваются. Одна и та же реакция протекает по-разному, в зависимости от условий её осуществления. Скорость реакции зависит от многих факторов: от природы реагирующих веществ, от их агрегатного состояния, от концентрации реагентов, от температуры, от присутствия катализаторов.   Напишите ответы навопросы. Что называется химической кинетикой? Чем определяется скорость химической реакции? От чего зависит скорость химической реакции?  Прочитайте текст 2, ответьте на вопросы сначала устно,потом письменно.Норвежские учёные К. М. Гульберг и П. Вааге в 1867 (тысячавосемьсотшестьдесятседьмом) году сформулировали закон химической  кинетики – закон действующих масс:
  Для реакции А + В = АВ этот закон выражается уравнением Для реакции А + В = АВ этот закон выражается уравнением где [A] и [B] – молярные концентрации веществ А и В; k – константа скорости реакции. При [A] = [B] = 1 моль/л υ = k.  Константа скорости зависит от природы реагентов и не зависит от их концентрации. Скорость химической реакции при повышении температуры увеличивается согласно правилу Вант-Гоффа: при повышении температуры на 10°С (десять градусов Цельсия) скорость химических реакций возрастает в 2 – 4 раза. 
  Математическая запись правила Вант-Гоффа такая: Математическая запись правила Вант-Гоффа такая: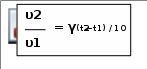 Уравнения, которые показывают зависимость скорости реакций от концентраций исходных веществ, называются кинетическими уравнениями.  Напишите ответы навопросы. Сформулируйте закон действующих масс. Сформулируйте правило Вант-Гоффа.  Во сколько раз изменится скорость прямой реакции N2(г) + 3Н2(г)2NH3(г), если давление в системе увеличить в 2раза? В реакции С(т)+2H2(г) CH4(г) концентрацию водорода уменьшили в 3 раза. Как изменится скоростьреакции? Во сколько раз увеличится скорость реакции при повышении температуры с 10 до 30oС (γ = 3)?  Прочитайте текст 3, подготовьтесь отвечать навопросы.  До сих пор мы рассматривали химические реакции, которые идут до конца. Это значит, что исходные вещества полностью превращаются в продукты реакции. Большинство химических процессов являются обратимыми. До сих пор мы рассматривали химические реакции, которые идут до конца. Это значит, что исходные вещества полностью превращаются в продукты реакции. Большинство химических процессов являются обратимыми.Примером обратимой реакции можег быть взаимодействие водорода с йодом H2 + I2 = 2HI (реакцию, которая идёт слева направо, принято называть прямой, а справа налево – обратной). Скорость прямой реакции H2 + I2 → 2HI; υ пр = k1[H2][I2]. Скорость обратной реакции 2HI → H2 + I2; υ обр = k2[HI]2. В начале обратимой реакции скорость прямой реакции больше, чем скорость обратной реакции: υ пр > υ обр. Затем с уменьшением концентрации исходных соединений и с увеличением концентрации продуктов скорость реакции возрастает. Через некоторое время скорости прямой и обратной реакции будут равны: υ пр = υ обр .    В 1884 (тысяча восемьсот восемьдесят четвёртом) году французский учёный Анри Луи Ле Шателье установил влияние внешних условий на положение равновесия обратимых реакций – принцип смещения равновесия (принцип Ле Шателье): В 1884 (тысяча восемьсот восемьдесят четвёртом) году французский учёный Анри Луи Ле Шателье установил влияние внешних условий на положение равновесия обратимых реакций – принцип смещения равновесия (принцип Ле Шателье):
Рассмотрим, как смещается химическое равновесие при изменении: а) концентрации реагирующих веществ, б) температуры, в) давления на примере реакции синтеза аммиака из азота и водорода: N2 + 3H2 ⇄ 2NH3; ∆H = –92 кДж/моль. При увеличении концентрации N2 и H2 равновесие будет смещаться в сторону уменьшения этих концентраций (в сторону образования NH3). При повышении температуры равновесной системы равновесие смещается в сторону эндотермической реакции, а при понижении температуры – в сторону экзотермической реакции. В реакциях, которые протекают без тепловых эффектов, изменение температуры не вызывает смещения равновесия. В этом случае повышение температуры приводит только к более быстрому установлению равновесия. Изменение давления смещает равновесие системы, если реакция идёт между газами, и при этом изменяются объёмы газообразных веществ. Например, прямая реакция синтеза NH3 протекает с уменьшением объёма газов, а обратная – с увеличением объёма. Повышение давления смещает равновесие системы в сторону образова- ния меньших объемов. Если в процессе обратимой реакции объёмы газов не изменяются, то изменение давления не влияет на состояние равновесия системы. Катализаторы не смещают химическое равновесие, так как они одинаково влияют на скорость прямой и обратной реакции. В присутствии катализаторов равновесие наступает быстро. Применение принципа Ле Шателье к обратимым реакциям даёт воз- можность управлять химическими процессами.  Напишите ответы навопросы. Какие реакции называют обратимыми? Что называется химическим равновесием? Сформулируйте принцип Ле Шателье. Как изменяется химическое равновесие при изменении внешних условий?  Определите, при каких условиях равновесие реакции 2H2(г) + O2(г)2H2O(г); H < 0 смещаетсявправо: 1) при повышении температуры; 2) при уменьшении давления; 3) при увеличении давления? В какую сторону сместится равновесие реакции 2SO2(г) + O2(г)2SO3(г); H < 0 при повышениитемпературы? ☻Задание для любознательных: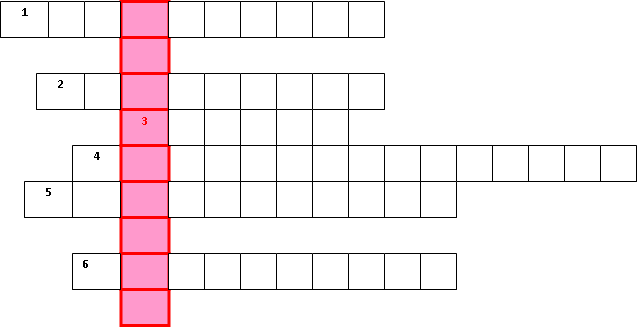 Отгадайте зашифрованное слово. Guess encrypted word. Devinez le mot crypté. Отгадайте зашифрованное слово. Guess encrypted word. Devinez le mot crypté.Название реакции, в которой из одного реагента образуется несколько продуктов. Название реакции, в которой атомы простого вещества замещают атомы одного из элементов в сложном веществе. Название реакции, в которой два сложных вещества обмениваются своими частями. Название реакции, в результате которой теплота поглощается. Название реакции, которая в данных условиях идет только в одном направлении. Название реакции, в которой несколько реагентов соединяются в один продукт. (Если вы правильно напишите ответы, то в выделенном столбце вы сможете прочитать фамилию великого русского учёного).  Что такое растворы? Из каких компонентов состоит раствор? Какие явления происходят при растворении? Что такое растворимость? Как изменяется растворимость веществ при изменении температуры и давления? На какие группы по растворимости делятся вещества? Какой раствор называется ненасыщенным (насыщенным, пересыщенным)? Что такое степень диссоциации? От чего она зависит? На какие группы условно делят электролиты по степени диссоциации? Что такое ионные реакции? Какие реакции называются необратимыми? Как характеризуется реакция среды при помощи водородного показателя? Что называется гидролизом? Что происходит с солями, которые образуются сильным основанием и сильной кислотой при их растворении в воде? Что происходит с солями, которые образуются сильным основанием и слабой кислотой, при их растворении в воде? Что происходит с солями, которые образуются слабым основанием и сильной кислотой, при их растворении в воде? Что происходит с солями, которые образуются слабым основанием и слабой кислотой, при их растворении в воде? Назовите основные классификации химических реакций. Что называется химической кинетикой? Чем определяется скорость химической реакции? Сформулируйте закон действующих масс. Сформулируйте правило Вант-Гоффа. Что называется химическим равновесием? Сформулируйте принцип Ле Шателье. Как изменяется химическое равновесие при изменении внешних условий?    | |||||||||||||||||||||||||||||||||||||





