Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§24. Диссоциация воды. Водородный показательПрочитайте слова и словосочетания, переведитеих. произведение концентраций нейтральная среда ионное произведение воды кислая среда водородный показатель щелочная среда отрицательный десятичный логарифм лакмус гидролиз метилоранж индикатор фенолфталеин  Прочитайте текст 1, придумайте название длянего. Известно, что вода очень слабо проводит электрический ток. Эта проводимость образуется за счёт диссоциации молекул воды: H2O ⇄ H+ + OH‾.  Измерения показали, что при 22°С (двадцати двух градусах Цельсия) степень диссоциации воды = 1,810–9 (альфа равна одна целая восемь десятых на десять в минус девятой степени). Так как в 1 л (одном литре) воды содержится 55,5 (пятьдесят пять целых пять десятых) моль воды Н2О, то концентрация ионов (моль/л) будет равна десять в минус седьмой степени: [H+] = [OHˉ] =1,8 10–9 55,5 = 10–7. При определённой температуре Кв – величина постоянная, численно равная при 22°С (двадцати двух градусах Цельсия) десяти в минус четырнадцатой степени: Кв = [H+] [OHˉ] = 10ˉ7·10‾7 = 10ˉ14 моль2/л2.  В химии концентрацию водородных ионов принято выражать через водородный показатель, обозначаемый символом рН (пэ-аш). В химии концентрацию водородных ионов принято выражать через водородный показатель, обозначаемый символом рН (пэ-аш).При помощи рН реакции растворов характеризуются так:   Напишите ответы навопросы. Что называется ионным произведением воды? Что такое водородный показатель? Как характеризуется реакция среды при помощи водородного показателя?  Прочитайте текст 2, ответьте на вопросы сначала устно, потомписьменно. Известно, что средняя соль состоит из атомов металла и кислотного остатка. При растворении в воде соли диссоциируют на ионы. Например: Na2CO3 ⇄ 2Na+ + CО32– ZnCl2 ⇄ Zn2+ + 2Cl– Н+-ионов или ОН–-ионов в составе этих солей нет, и реакция среды должна быть нейтральной. Однако, если водные растворы натрий карбоната и цинк хлорида испытать индикатором, то в растворе Nа2CО3 фенолфталеин окрашивается в малиновый цвет, а метилоранж в растворе ZnCl2 – в красный. Опыт показывает, что в зависимости от химического состава солей их водные растворы могут иметь нейтральную, кислую или щелочную реакцию среды. Это объясняется тем, что при растворении многих солей в воде происходит не только диссоциация веществ на ионы, но и химическое взаимодействие между ионами соли и ионами Н+ и ОН– воды.  Соль можно представить как продукт взаимодействия гидроксида с кислотой. В зависимости от степени диссоциации гидроксидов и кислот соли могут быть образованы: а) сильным основанием и сильной кислотой; б) сильным основанием и слабой кислотой; в) слабым основанием и сильной кислотой; г) слабым основанием и слабой кислотой. В зависимости от состава солей их гидролиз протекает полностью, частично или совсем не происходит. Соли, которые образуются сильным основанием и сильной кислотой (NаСl, KNO3), гидролизу не подвергаются. Ионы таких солей не могут образовать с ионами воды слабых электролитов. NаОH и НCl, KOH и HNO3 – сильные электролиты, хорошо растворяются в водe и практически полностью диссоциируют на ионы. В этом случае ионы соли не взаимодействуют с ионами воды, и поэтому раствор будет иметь нейтральную реакцию среды, рН = 7 (пэ-аш равно семь). Соли, которые образуются сильным основанием и слабой кислотой, подвергаются гидролизу. Реакция среды будет щелочной, рН > 7 (пэ-аш больше семи). Соли, которые образуются слабым основанием и сильной кислотой, подвергаются гидролизу. Реакция среды будет кислой, рН < 7 (пэ-аш меньше семи). Соли, которые образуются слабой кислотой и слабым основанием, подвергаются гидролизу по обоим ионам. Реакция среды нейтральная, рН = 7.  Напишите ответы навопросы. Что называется гидролизом? Что происходит с солями, которые образуются сильным основанием и сильной кислотой при их растворении в воде? Что происходит с солями, которые образуются сильным основанием и слабой кислотой, при их растворении в воде? Что происходит с солями, которые образуются слабым основанием и сильной кислотой, при их растворении в воде? Что происходит с солями, которые образуются слабым основанием и слабой кислотой, при их растворении в воде?  Какие из следующих солей подвергаются гидролизу. Составьте уравнения гидролиза и укажите реакциюсреды. NaCN; KNО3; ZnBr2; NH4Сl; CaCl2; CH3COONH4; KBr; K2S 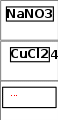   Установите соответствие между формулой соли, количеством ионов, образованных при ёё диссоциации в растворе и кислотно-основным характером этогораствора. Установите соответствие между формулой соли, количеством ионов, образованных при ёё диссоциации в растворе и кислотно-основным характером этогораствора.☻Задание для любознательных:Отгадайте закодированное слово. Guess encoded word. Devinez le mot codé.  Вещества, которые образуются в результате реакции. Группа явлений, к которым принадлежит таяние льда. Название веществ – участников реакции. Числа, которые указывают на количество атомов в молекуле. Число, которое показывает количество молекул вещества, которые реагируют с определённым количеством молекул другого вещества. Группа явлений, к которым принадлежит горение дров. Наука, которая изучает превращение веществ. |
