Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§26. Окислительно-восстановительные реакцииПрочитайте слова и словосочетания, переведитеих. окислитель электронно-ионный метод восстановитель метод электронного баланса окисление отдача электронов 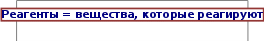  восстановление присоединение электронов электронное уравнение Прочитайте текст 1, придумайте для негоназвание. Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Например: Al0 – 3ē = Al3+; 2Cl− – 2ē = Cl20. Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Например: Р+3 + 6ē = Р–3; N0 + 3ē = N–3. Атомы, молекулы или ионы, которые отдают электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, которые присоединяют электроны, называются окислителями. Во время реакции они восстанавливаются. Окисление всегда связано с восстановлением, и наоборот, восстановление всегда связано с окислением. Поэтому эти реакции и называются окислительно - восстановительными. Применяют два метода составления уравнений ОВР: метод электронного баланса и метод полуреакций. Метод электронного балансаСравнивают степени окисления атомов в реагентах и продуктах в соответствии с правилом: число электронов, которые отдаёт восстановитель, должно равняться числу электронов, которые присоединяет окислитель. Например, HCl + MnO2 = Cl2+ MnCl2 + H2O. Покажем изменение степеней окисления атомов до и после реакции: 1– 4+ 0 2+ HCl + MnO2 = Cl2 + MnCl2+ H2O. Эта реакция окислительно-восстановительная, так как изменяются степени окисления атомов хлора и мангана. Составляем электронные уравнения 2 2Cl–1 – 2 ē = Cl 0 Mn+4 + 2 ē = Mn+2 1 (восстановитель)  1 (окислитель) 1 (окислитель)и находим коэффициенты при восстановителе и окислителе. Они равны соответственно 2 и 1. Коэффициент 2 (а не 1) ставится потому, что 2 атома хлора со степенью окисления –1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении. HCl – восстановитель, MnO2 – окислитель. 2HCl + MnO2 = Cl2 + MnCl2 + H2O. Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль HCl приходится 1 моль MnO2. Для связывания двухзарядного иона марганца, который образуется нужно ещё 2 моль кислоты, поэтому перед восстановителем следует поставить коэффициент 4. Тогда воды получится 2 моль. Окончательное уравнение имеет вид MnO2 + 4HCl = Cl2 + MnCl2 + 2H2O. Проверку правильности написания уравнения можно ограничить подсчётом числа атомов одного какого-либо элемента, например, хлора: в левой части 4 и в правой 2 +2 = 4.  Укажите соединение, в котором манган может быть только восстановителем. Mn MnO MnO2 KMnO4 Укажите реакцию, в которой происходит только снижение степени окисленияхлора: t, кат. Cl2 + KOH → KCl + KClO + H2O KClO3 → KClO4 + KCl HCl + Zn → ZnCl2 + H2 Cl2 + H2 → HCl  Прочитайте текст 2, ответьте на вопросы сначала устно, потомписьменно. Метод полуреакций является универсальным методом составления ОВР. Так как именно в форме полуреакций записаны справочные данные по стандартным электродным потециалам, большинство необходимых полуреакций можно брать прямо из справочников. Рассмотрим пример H2O2 + KMnO4 + H2SO4 = O2 + K2SO4 + MnSO4 + H2O. Полуреакция восстановления составляется таким образом, чтобы MnO4–- ион превратился в Mn2+-ион. Избыточный оксиген из иона-окислителя должен оказаться в правой части полуреакции в виде воды: 4 2 MnO – → Mn2+ + H O. Превращение происходит в кислой среде, поэтому следует добавить необходимое количество протонов: 4 2 MnO – + 8H+ → Mn2+ + 4H O. По разнице зарядов в левой и правой частях находим число электронов. Сумма зарядов слева равна +7, сумма зарядов справа равна +2, следовательно, в левую часть нужно добавить 5 электронов, что соответствует переходу мангана из степени окисления +7 в степень окисления +2: 4 2 MnO – + 8H++ 5e– = Mn2+ + 4H O. Аналогично с полуреакцией окисления. Следует помнить понятие силы электролита. Слабые электролиты, такие как H2O2, в растворе будут находиться в молекулярном виде. Избыточный гидроген превращается в протоны, а недостаток оксигена восполняется из воды, которая также превращается в протоны. H2O2 = O2 + 2H+ + 2e–. Для избавления от электронов умножим полуреакцию восстановления на 2, а полуреакцию окисления на 5.  MnO4– + 8H+ + 5e–= Mn2+ + 4H2O 2 (окислитель) H2O2 = O2 + 2H+ + 2e– 5 (восстановитель) MnO4– + 8H+ + 5e–= Mn2+ + 4H2O 2 (окислитель) H2O2 = O2 + 2H+ + 2e– 5 (восстановитель)5H2O2 + 2MnO4– + 16H+ +10e– = 5O2 + 2Mn2+ + 8H2O + 10H+ +10e– В обоих частях уравнения оказались протоны, но это легко исправить.  5H2O2 + 2MnO4– + 6H+ = 5O2 + 2Mn2+ + 8H2O. 5H2O2 + 2MnO4– + 6H+ = 5O2 + 2Mn2+ + 8H2O.146 Мы получили краткое ионное уравнение ОВР. Теперь добавим противоионы так, чтобы суммарный заряд в обоих частях уравнения был равен нулю, и получим полное ионное уравнение ОВР: 4 5H2O2 + 2K++ 2MnO4– + 6H+ + 3SO42– = 5O2 + 2Mn2+ + 2K+ + 3SO 2– + 8H2O. 5H2O2 + 2KMnO4 + 3H2SO4 = 5O2 + K2SO4 + 2MnSO4 + 8H2O. Теперь необходимо проверить правильность уравнивания реакций. Для этого надо посчитать количество атомов Оксигена в левой (5∙2+2∙4+3∙4=30) и правой (5∙2+4+2∙4+8=30) частях уравнения и убедиться, что они равны. Для полной уверенности можно пересчитать и атомы гидрогена: (5∙2+3∙2=16=8∙2).  Напишите ответы навопросы. Какой процесс называется: а) окислением? б) восстановлением? Что такое окислители и восстановители? Почему следующие реакции относятся к ОВР: а) Mg + O2 = 2MgO; в) Fe2O3 + 3CO = 2Fe + 3CO2; б) 2HCl + Zn = ZnCl2 + Н2; г) CuO + H2 = Cu + H2O?  Расставьте коэффициенты методом электронного баланса: NaCrO2 + Br2 + NaOH = Na2CrO4 + NaBr + H2O; (NH4)2Cr2O7 = N2 + Cr2O3 + H2O; K2МnO4 + H2O = KMnO4 + MnO2 + KOH. Расставьте коэффициенты методомполуреакций: FeSO4 + K2Cr2O7 + H2SO4 = Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O; K2S + KBrO4 + H2O = S + KBr + KOH; C + H2SO4 + K2Cr2O7 = CO2 + K2SO4 + Cr2(SO4)3 + H2O. ☻Задание для любознательных: Напишите, как читаются по-русски химические элементы и отгадайте закодированное слово. Write how to read in Russian chemical elements and guess encoded word. Ecrire à lire en éléments chimiques russes et devinez le mot codé.  |
