Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§25. Типы химических реакцийПрочитайте слова и словосочетания, переведитеих. направление реакции каталитические реакции тепловой эффект некаталитические реакции катализатор гетерогенные реакции реакции соединения гомогенные реакции реакции разложения экзотермические реакции реакции замещения эндотермические реакции реакции обмена реакции ионного обмена обратимые реакции окислительно-восстановительные реакции необратимые реакции ядерные реакции  Прочитайте текст, ответьте на вопросы сначала устно, потомписьменно. 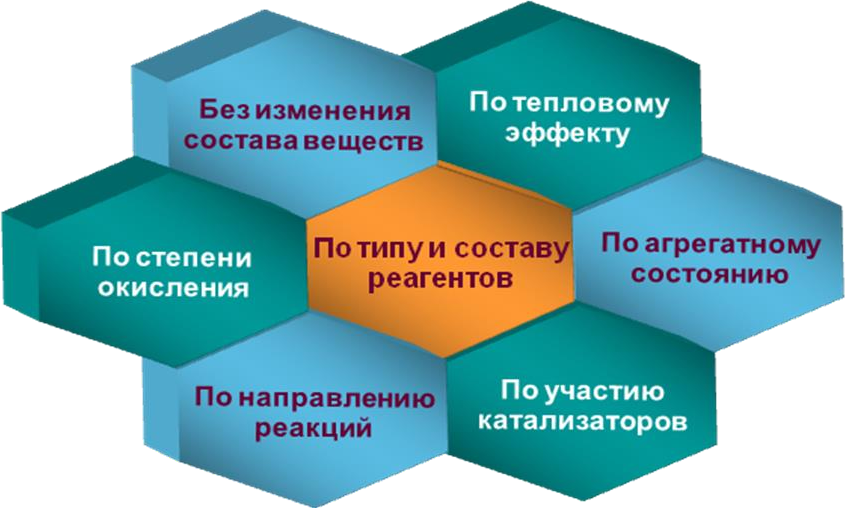 Главным признаком химической реакции является образование новых веществ с другими свойствами. Существуют разные классификации химических реакций в зависимости от признаков, которые вкладываются в их основу: Главным признаком химической реакции является образование новых веществ с другими свойствами. Существуют разные классификации химических реакций в зависимости от признаков, которые вкладываются в их основу:Примером реакций, которые идут без изменения состава веществ, служит получение аллотропных модификаций веществ. При этом изменяются строение и свойства этих веществ. Например, получение белого фосфора из красного фосфора. По типу и составу реагирующих веществ химические реакции делятся на реакции присоединения, реакции разложения, реакции замещения и реакции обмена. Реакции присоединения – это реакции, при которых из двух и более веществ образуется одно сложное вещество. Например, SO2+ H2O = H2SO3. Реакции разложения – это реакции, при которых из сложного вещества образуется несколько новых веществ. Например, 2KNO3 = 2KNO2 + O2↑(t). Реакции замещения – это реакции, при которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе. Например, Zn + 2HCl = ZnCl2 + H2↑. Реакцииобмена– это реакции, при которых два сложных вещества обмениваются своими составными частями. Например, NaOH + HCl = NaCl + H2O. По направлению протекающих реакций различают необратимые (протекают в данных условиях только в одном направлении) и обратимые(протекают одновременно в двух противоположных направлениях) химические реакции. Например, S + O2 = SO2↑, 2SO2 + O2 ↔ 2SO3↑. По участию катализаторов различают каталитическиеи некаталитические реакции. Например, Cu(OH)2 = CuO + H2O (t), 2KClO3 = 2KCl + 3O2↑(MnO2, t). По агрегатному состоянию реагентов различают гетерогенные (реакции, в которых реагенты находятся в разных агрегатных состояниях) и гомогенные реакции (реакции, в которых реагенты находятся в одинаковых агрегатных состояниях). Например, 2Al(т) + 3CuCl2(ж) = 3Cu(т) + 2AlCl3(ж), H2(г) + Cl2(г) = 2HCl(г). По тепловому эффекту реакции делят на экзотермические (протекают с выделением энергии) и эндотермические (протекают с поглощением энергии). Например, H2 + Cl2 = 2HCl + Q, СаСО3 = CaO + CO2 – Q. Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например: H2(г)+ Cl2(г) = 2HCl(г) + 92.3 кДж, N2(г) + O2(г) = 2NO – 90.4 кДж. По изменению степени окисления атомов реагентов и продуктов реакции делятся на реакции ионного обмена (РИО) и окислительно- восстановительные реакции (ОВР). Реакции ионного обмена протекают без изменения степеней окисления атомов реагентов. Их протекание возможно, если в результате реакции: выделяется газ; выпадает осадок; образуется малодиссоциирующее вещество. Например, Ag+N+5O3–2 + Na+Cl– = Ag+Cl–↓ + Na+N+5O3–2. Реакции, которые протекают с изменением степеней окисления атомов реагентов, называются окислительно-восстановительными. Например, 2 2 5 4Р0 + 5О 0 = 2Р +5О –2. Обратите внимание!!! 1 1 2 При протекании химических реакций не изменяется число участвующих в них атомов, не происходит образование новых атомов. В этом их основное отличие от ядерных реакций, в которых из одних атомов образуются другие атомы. Например, 3H + 1p = 4He.  Напишите ответы навопросы. Назовите основные классификации химических реакций. Вспомните, что называется аллотропией? Что такое реакции присоединения? Какие реакции называются реакциями разложения? Реакциями замещения называются реакции, … . Реакции, в которых два сложных вещества обмениваются своими частями, называются … . Какие реакции называются гомогенными? Что называется гетерогенными реакциями? Реакции, которые протекают одновременно в обоих направлениях (прямом и обратном) называются … . Что такое катализатор?  Поставить коэффициенты в схемах реакции. Указать типреакций. 1) K + H2O → KOH + H2 +Q 5) H2 + N2 ⇄ NH3 – Q Li2S + H2O ⇄ LiHS + LiOH 6) H2 + Cl2 → HCl + Q N2O5 + H2O → HNO3 7) Mn3O4 + Al → Mn + Al2O3 HMnO4 → MnO2 + H2O + O2 8) H3BO3 ⇄ H2O + HBO2 Какой объем аммиака (при н.у.) можно получить из азота и водорода, если объем исходного водорода равен 300 л, а практический выход – 43%? Приведите примеры образования купрум (II) оксида в результатереакции: 1. присоединения, 2. разложения. Приведите два примера реакций присоединения, которые сопровождаются окислением – восстановлением участвующих в реакциивеществ. ☻Задание для любознательных:Отгадайте закодированное слово. Guess encoded word. Devinez le mot codé.  Реакции, во время которых выделяется тепло. Реакции, во время которых поглощается тепло. Как читается буква, которой обозначают тепловой эффект химической реакции. Тепловой … – это теплота, которая выделяется или поглощается при реакции. Тепловой эффект реакции – это … между количеством энергии у реагентов и конечных продуктов реакции. Одна из единиц выражения теплового эффекта. Во время химических процессов изменяется внутренняя … вещества. |
