Posibnyk_chimiya_ingener-конвертирован. Харьковский национальный автомобильно дорожный университет
 Скачать 4.12 Mb. Скачать 4.12 Mb.
|
§23. Электролитическая диссоциацияПрочитайте слова и словосочетания, переведитеих. электрический ток электролиты направленное движение неэлектролиты хаотическое движение расплав  электрический заряд катод – анод проводить электрический ток электрический заряд катод – анод проводить электрический ток Прочитайте текст 1, подготовьтесь отвечать навопросы. Известно, что электрический ток – это направленное движение электрических зарядов. Переносить их могут электроны или ионы.  Известно, что одни вещества в растворённом состоянии проводят электрический ток, другие – ток не проводят. По способности проводить электрический ток вещества делятся на электролиты и неэлектролиты. Известно, что одни вещества в растворённом состоянии проводят электрический ток, другие – ток не проводят. По способности проводить электрический ток вещества делятся на электролиты и неэлектролиты.К электролитам относятся многие соли, щёлочи, кислоты.  Неэлектролитами являются большинство органических соединений. Многие явления, связанные со свойствами растворов электролитов, объяснила теория электролитической диссоциации (Сванте Аррениус, 1887):    Учение о химической связи помогает ответить на вопрос, почему электролиты диссоциируют на ионы. Диссоциация является результатом взаимодействия полярных молекул растворителя с молекулами или кристаллической решёткой растворяемого вещества. Легче всего диссоциируют вещества с ионной связью. Эти вещества состоят из ионов. При их растворении диполи воды ориентируются вокруг положительного и отрицательного ионов. Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ними ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, то есть ионы, химически связанные с молекулами воды. Аналогично диссоциируют электролиты, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). При взаимодействии диполей воды полярная связь (например, в HCl) ещё больше поляризуется и, в конце концов, происходит ионизация. Таким образом, электролитами являются соединения с ионной или полярной ковалентной связью – соли, кислоты и основания. И диссоциировать на ионы они могут только в полярных растворителях.  Напишите ответы навопросы. Что такое электролиты (неэлектролиты)? Сформулируйте положения теории электролитической диссоциации. Что такое диссоциация электролитов? Соединения с какой химической связью диссоциируют в водных растворах?  Прочитайте текст 2, придумайте название длянего.  С точки зрения теории электролитической диссоциации можно дать определения кислот, оснований и солей: С точки зрения теории электролитической диссоциации можно дать определения кислот, оснований и солей:Кислоты в водных растворах диссоциируют на гидроген-ионы и ионы кислотного остатка: HCl ⇄ H+ + Cl‾. Основность кислот определяется числом катионов гидрогена, которые образуются при диссоциации. Многоосновные кислоты диссоциируют ступен- чато (постепенно): H2SO4 ⇄ H+ + HSO4‾ 1 ступень HSO4‾ ⇄ H+ + SO42‾ 2 ступень  Диссоциация многоосновных кислот протекает главным образом по первой ступени. Диссоциация многоосновных кислот протекает главным образом по первой ступени.Основания в водных растворах диссоциируют на гидроксид-ионы и катионы металла: NaOH ⇄ Na+ + OH‾. Кислотность гидроксидов определяется числом его гидроксильных групп. Многокислотные гидроксиды диссоциируют ступенчато: Ca (OH) 2 ⇄ CaOH+ + OH‾ 1 ступень CaOH+ ⇄ Ca2+ + OH‾ 2 ступень  Диссоциация многокислотных гидроксидов протекает главным образом по первой ступени. Диссоциация многокислотных гидроксидов протекает главным образом по первой ступени.Средние соли диссоциируют в одну ступень Na3PO4 ⇄ 3Na+ + PO43‾. Кислые соли диссоциируют ступенчато: KHSO4 ⇄ K+ + HSO4‾ 1 ступень HSO4‾ ⇄ H+ + SO42‾ 2 ступень У основных солей вначале отщепляются ионы кислотных остатков, а затем гидроксид-ионы: MgOHCl ⇄ MgOH+ + Cl‾ 1 ступень MgOH+ ⇄ Mg2+ + OH‾ 2 ступень  Напишите ответы навопросы. Что такое кислоты (основания, соли) с точки зрения теории электролитической диссоциации? Как диссоциируют многоосновные кислоты? Как диссоциируют многокислотные основания? Как диссоциируют соли: средние, кислые и основные?  Напишите уравнения электролитическойдиссоциации: Ba(OH)2 ⇄ CaCl2 ⇄ H2SO4 ⇄ Al2(SO4)3 ⇄ Zn(NO3)2 ⇄ Al(OH)3 ⇄ Na2CO3 ⇄ H3BO3 ⇄ Какие из следующих электролитов при диссоциации образуют: а) катионы гидрогена; б) анионы гидроксильной группы. Написать уравнениядиссоциации. KOH, HNO3, NaHSO4, ZnOHCl, CH3COOH, Ba(OH)2, HMnO4?  Прочитайте текст 3, придумайте название кнему.  Поведение водных растворов электролитов в химических реакциях зависит от того, насколько полно они распадаются на ионы. Для количественной оценки диссоциации важное значение имеет степень диссоциации. Поведение водных растворов электролитов в химических реакциях зависит от того, насколько полно они распадаются на ионы. Для количественной оценки диссоциации важное значение имеет степень диссоциации.Степень диссоциации определяется опытным путём и выражается в долях единицы или процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 (или α = 100% – сто процентов), то электролит полностью распадается на ионы. Если же α = 0,2 (или 20% – двадцать процентов), то это означает, что из 100 (ста) растворённых молекул данного электролита 20 (двадцать) распались на ионы. Различные электролиты имеют различную степень диссоциации. Она зависит от природы электролита и растворителя, от концентрации электролита и от температуры раствора. С уменьшением концентрации электролита (при разбавлении его водой) степень диссоциации увеличивается. Повышение температуры увеличивает степень диссоциации. По степени диссоциации электролиты условно делят на три группы: сильные, средние и слабые. Сильные электролиты имеют степень диссоциации α > 0,3 (альфа больше ноль целых три десятых) (или α > 30% – альфа больше тридцати процентов). К ним относятся: а) почти все растворимые соли; б) многие неорганические кислоты (HCl, HBr, HI, HNO3, H2SO4, HMnO4, HClO3, HClO4, HIO3, HBrO3); в) гидроксиды щелочных и щёлочноземельных металлов. Слабые электролиты имеют степень диссоциации α < 0,03 (альфа меньше ноль целых три сотых) (или α < 3% – альфа меньше трёх процентов). К ним относятся: а) почти все органические кислоты; б) некоторые неорганические кислоты (H2CO3, HF, H2S, HNO2, H2SO3, H2SiO3, H3PO3, HClO, H3BO3, HCN); в) многие гидроксиды амфотерных металлов (нерастворимые в воде гидроксиды), аммоний гидроксид, вода. Вещества, у которых степень диссоциации находится в интервале 0,03 < α < 0,3 (от ноль целых трёх сотых до ноль целых трёх десятых) (или 3% < α < 30% – от трёх до тридцати процентов), относятся к электролитам средней силы. К ним относятся: неорганические кислоты (HPO3, H3PO4, H4P2O7, HClO2), гидроксид Fe(OH)2. Реакции между ионами называются ионными реакциями. Различают обратимые и необратимые реакции. 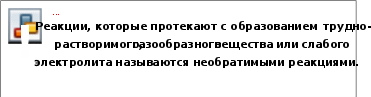  Напишите ответы навопросы. Что такое степень диссоциации? От чего зависит степень диссоциации? На какие группы условно делят электролиты по степени диссоциации? Приведите примеры сильных электролитов (слабых электролитов). Что такое ионные реакции? Какие реакции называются необратимыми?  Закончите в молекулярном и написать в ионном виде уравненияреакций:
Ba(NO3) 2 + Na2SO4 → Na2CO3 + HCl → Имеются растворы: натрий карбоната, кальций нитрата, соляной кислоты, калий сульфата. Между какими из этих веществ могут происходить реакции? Составьте уравнения реакций в молекулярном и ионномвиде. Определите с помощью таблицы растворимости нерастворимое в воде вещество: AgCl; AgOH; AgNO3; AgF. ☻Задание для любознательных:Отгадайте названия солей. Guess the name of salts. Devinez le nom de sels.  Название солей, если формула кислоты HI. Название солей, если формула кислоты HI.Название солей, если формула кислоты H2S. Название солей, если формула кислоты HNO3. 7 Название солей, если формула кислоты H2CO3. Название солей, если формула кислоты H3PO4. Название солей, если формула кислоты HNO2. Название солей, если формула кислоты HBr. |
