хроматография-лекции. Хроматографические методы. Общая характеристика методов
 Скачать 6.82 Mb. Скачать 6.82 Mb.
|
Силы индукционного взаимодействияЕсли одна из взаимодействующих частиц неполярна, а вторая обладает дипольным моментом , между ними возникает индукционное взаимодействие, энергия которого описывается уравнением: 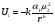 . (86) . (86)Обычно энергия индукционного взаимодействия составляет не более 5 % от общей энергии ван-дер-ваальсового взаимодействия. Так же, как и уравнение (84), последнее соотношение может применяться только в случае, когда расстояния между частицами намного больше, чем их ковалентные радиусы. Необходимо рассматривать взаимодействие лишь между двумя атомными группами, находящимися на минимальном расстоянии, принимается во внимание лишь диполь атомной группы или двух химически связанных атомов (диполь связи), поскольку суммарный дипольный момент молекулы относится к диполю, обладающему большим размером, чем ван-дер-ваальсов радиус атомной группы. Силы ориентационного взаимодействия Наконец, для двух частиц, обладающих дипольными моментами, возникает ориентационное взаимодействие, энергия которого описывается уравнением: 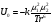 . (87) . (87)Под взаимодействующими частицами в данном случае подразумеваются химически связанные атомы (микродиполи связей). В отличие от дисперсионных и индукционных сил для ориентационных сил характерна векторная природа, т.е. энергия взаимодействия двух диполей зависит от их взаимной ориентации. Максимальная энергия ориентационного взаимодействия реализуется тогда, когда микродиполи связей расположены параллельно и положительный полюс одного микродиполя расположен над отрицательным полюсом другого микродиполя. Практически такое оптимальное расположение взаимодействующих микродиполей не достигается в реальных газохроматографических системах: микродиполи жестко фиксированы в молекулах взаимодействующих веществ, а взаимная ориентация молекул далеко не всегда зависит от расположения и наличия в них микродиполей. Кроме того, с увеличением температуры возрастает кинетическая энергия молекул, вследствие чего возможность оптимальной ориентации микродиполей снижается. Эти два обстоятельства приводят к тому, что при реализации ориентационного взаимодействия большую роль приобретает стерический фактор, т.е. возможность встречи двух микродиполей и оптимального их взаимного расположения. Силы полухимического и химического взаимодействий Еще более прочные адсорбционные связи полухимического характера образуются либо при возникновении водородных связей, либо за счет образования комплексов переноса заряда. Образование водородных связей имеет место в том случае, когда молекулы, находящиеся на поверхности адсорбента, имеют, например, протоно-донорные атомы. Тогда при адсорбции веществ, имеющих, например, эфирную группировку, образуются водородные связи, энергия которых порядка 34 тысячи калорий, гораздо больше, чем энергия ван-дер-ваальсовых взаимодействий. Образование комплексов переноса заряда происходит тогда, когда адсорбируемая молекула отдает электрон адсорбционным центрам адсорбента. Тогда адсорбируемая молекула приобретает положительный заряд, адсорбционный центр приобретает заряд отрицательный и образуется комплекс переноса заряда. Эта связь по прочности уже близка к химической. И, наконец, хемосорбция – процесс адсорбции, протекающий за счет образования прочной химической связи – ковалентной связи. 12.2. КЛАССИФИКАЦИЯ РАЗДЕЛЯЕМЫХ СОЕДИНЕНИЙ ПО ИХ СПОСОБНОСТИ К РАЗЛИЧНЫМ ТИПАМ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ Исходя из способности разделяемых веществ к различным видам межмолекулярного взаимодействия в условиях хроматографии, весьма полезной оказывается следующая их классификация, предполагающая существование четырех групп – А, В, С, Д. К группе А относятся неполярные молекулы благородных газов и насыщенных углеводородов, атомы углерода, в которых связаны только -связями. Межмолекулярные взаимодействия молекул группы А с любыми другими молекулами или адсорбентами обусловлены, в основном, универсальным неспецифическим дисперсионным притяжением. В группу В входят полярные молекулы, включающие фрагменты с неподеленными электронными парами или - связями. Это, например, квадрупольные молекулы азота, ненасыщенные и ароматические углеводороды, а также молекулы с такими дипольными функциональными группами, как, например, кислород в эфирах и кетонах, азот в третичных аминах и нитрилах. Полярные связи или функциональные группы должны быть расположены в периферических частях таких молекул, т.е. быть доступными периферическим полярным группам других взаимодействующих с ними молекул. Молекулы группы В способны проявлять наряду с универсальным неспецифическим также и более специфическое направленное межмолекулярное взаимодействие. Поэтому межмолекулярное взаимодействие молекул группы В с молекулами группы А остается неспецифическим; межмолекулярное же взаимодействие молекул группы В между собой, помимо универсального неспецифического, может включать значительный вклад специфических взаимодействий, связанных с отмеченными особенностями распределения электронной плотности. Сюда относится, например, диполь-дипольное взаимодействие молекул кетонов или нитрилов. К группе С относятся молекулы, на периферических фрагментах которых сосредоточен положительный заряд, как, например, на атоме металла в молекуле LiCH3. Молекулы группы С взаимодействуют с молекулами группы А неспецифически, а с молекулами группы В и друг с другом – специфически. В группу Д объединяются молекулы, в функциональных группах которых электронная плотность сконцентрирована на одном из центров и понижена на другом. К ним относятся вода, спирты, первичные и вторичные амины. Межмолекулярное взаимодействие молекул группы Д с молекулами группы А остается неспецифическим (дисперсионное и отчасти индукционное). Межмолекулярное же взаимодействие молекул группы Д с молекулами групп В и С, а также друг с другом включает обычно значительный вклад специфического взаимодействия: диполь-дипольного, диполь-квадрупольного, а также еще более специфические направленные межмолекулярные взаимодействия, такие, как водородная связь и другие взаимодействия донорно-акцепторного типа, а также комплексообразование. 12.3. АДСОРБЕНТЫ В ГАЗО-АДСОРБЦИОННОЙ ХРОМАТОГРАФИИ Классификация адсорбентов по способности к различным типам межмолекулярных взаимодействий Адсорбенты можно рассматривать как большие молекулы, поэтому их удобно классифицировать по такому же принципу, как и разделяемые соединения, т.е. рассматривать их как соответствующих партнеров в межмолекулярном взаимодействии с адсорбатами. В этой связи специфичность взаимодействия адсорбентов с молекулами разделяемых соединений связана прежде всего с химией поверхности адсорбентов. Таким образом, целесообразно, также в некоторой степени условно, выделить три основных типа адсорбентов: 1 тип – неспецифические неполярные адсорбенты – насыщенные углеводороды (кристаллические, полимерные), а также химически инертные поверхности атомных решеток (в частности, базисная грань графита); 2 тип – специфические адсорбенты с локализованными на поверх-ности положительными зарядами или другими электроно-акцепторными центрами. Это, например, адсорбенты, на поверхность которых выходят функциональные группы протонных кислот (например, гидроксилированная поверхность кремнезема), а также адсорбенты с апротонными кислотными центрами. На таких адсорбентах молекулы группы А в отсутствии химических реакций адсорбируются неспецифически, а молекулы групп В и С адсорбируются специфически. 3 тип – специфические адсорбенты, несущие на поверхности отри-цательные заряды: грани кристаллов, образованные преимущественно анионами, или поверхности пористых полимеров с выходящими наружу нитрильными, карбонильными или эпоксигруппами. Классификация адсорбентов по особенностям внутренней геометрической структуры Кроме химической структуры следует учитывать и особенности внутренней геометрической структуры адсорбентов. С этой точки зрения адсорбенты делятся на две группы: первая группа непористые адсорбенты; вторая группа пористые адсорбенты, подразделяющиеся на однородно пористые и неоднородно пористые. Пористые адсорбенты отличаются от непористых наличием системы пор, имеющих характерную структуру. Форма и ширина пор могут быть самыми разными: это могут быть и микроскопические углубления, и бороздки глубиной порядка 1 мкм, и пустоты, диаметр которых близок к диаметру молекулы адсорбируемого соединения. Структура пустот играет важную роль в адсорбции. Размеры отверстий пор влияют на массообмен, т.е. на скорость переноса вещества к внутренней поверхности, на которой происходят процессы адсорбции и десорбции, наиболее важные для осуществления процесса газохроматографического разделения. Независимо от химического состава адсорбента его внутреннюю структуру принято оценивать следующими параметрами:
Если рассматривать важное для процессов адсорбции на пористых материалах отношение среднего диаметра пор к диаметру молекул разделяемых соединений, то следует отметить две крайние ситуации:
В этом случае скорость процесса адсорбции зависит от размеров адсорбируемых молекул и формы пор адсорбента. В узких порах адсорбированные молекулы одновременно взаимодействуют с адсорбционными центрами, расположенными на противоположных стенках пор. Такой подход приводит к делению пористых адсорбентов на три группы:
Для того чтобы массообмен проходил достаточно быстро, адсорбент должен быть преимущественно макропористым. В то же время большая удельная поверхность обуславливает высокий коэффициент емкости, а следовательно, и критерий разделения. В этой связи приходится искать оптимальные соотношения между желаемым временем анализа и степенью разделения. Таким образом, если сформулировать основные требования, которые предъявляются к адсорбентам, то следует отметить следующие:
12.4. ВАЖНЕЙШИЕ АДСОРБЕНТЫ И ХАРАКТЕРИСТИКА ИХ СВОЙСТВ Наиболее часто используемые в газовой хроматографии твердые адсорбенты целесообразно разделить на четыре группы:
Углеродные адсорбенты Основными представителями этой группы адсорбентов являются:
Графитированная термическая сажа представляет собой непористый, инертный и устойчивый к высокой температуре адсорбент с физически и химически однородной поверхностью и высокой удельной поверхностной энергией. Поверхность сажи состоит только из атомов углерода и имеет структурные параметры графита. Расстояние между соседними атомами углерода в гексагональном слое составляет 0.1418 нм, а между слоями 0.3385 нм. При адсорбции на базисной плоскости графита электроны проводимости существенной роли не играют, так что адсорбция любых молекул осуществляется в основном за счет дисперсионных сил. Графитированную термическую сажу получают нагреванием сажи до 3000 оС в отсутствие кислорода и других окислителей. В процессе графитирования происходит рост кристаллов до размеров примерно 500 нм, а также удаление летучих веществ. При этом доля водорода и кислорода, содержащихся на поверхности в составе осмолившихся веществ и свободных радикалов, падает до 0.4 %. Оставшиеся загрязнения являются причиной асимметрии пиков и необратимой адсорбции полярных соединений. Большую часть загрязнений можно удалить в процессе обработки сажи водородом при 1100 оС после графитирования. Графитированная термическая сажа представляет собой тонкий порошок, непригодный для непосредственного заполнения насадочных хроматографических колонок. В результате длительного встряхивания, которое проводится без добавления связующего, сажа скатывается в маленькие шарики, которые можно осторожно рассеять на фракции и заполнить выбранной фракцией колонку. Из-за небольшой механической прочности этих частиц, обращаться с колонками, заполненными графитированной термической сажей, следует достаточно осторожно. Добавлением небольших количеств вязких полимеров (0.01 % апиезона L) можно улучшить механическую стабильность частиц графитированной термической сажи. Известно, что интенсивность дисперсионного взаимодействия зависит от величины, формы и поляризуемости взаимодействующих частиц. В этой связи на графитированной термической саже при разделении методом газо-адсорбционной хроматографии циклические углеводороды элюируются из колонки раньше н-алкана с тем же числом атомов углерода, так как они не могут расположиться копланарно по отношению к поверхности графита и соответственно имеют меньшее число взаимодействующих с поверхностью атомов водорода. Благодаря своей высокой чувствительности к геометрии молекулы, графитированная термическая сажа особенно хорошо подходит для разделения структурных и стереоизомеров, которые вследствие малых различий в их физических свойствах на жидких неподвижных фазах можно разделить лишь при очень высокой эффективности колонки. Еще одно преимущество графитированной термической сажи состоит в том, что она легко модифицируется различными жидкими и твердыми фазами, а это позволяет производить селективное разделение самых различных соединений. Активные угли представляют собой неспецифические адсорбенты с сильно развитой пористой структурой, образованной главным образом макро- и мезопорами различного диаметра. Большая удельная поверхность (8001000 м2/г) обуславливает высокую адсорбционную емкость. Получают активный уголь пиролизом различных углеродсодержащих материалов: дерева, торфа, бурого угля, фенолформальдегидных смол. В зависимости от типа исходного материала и методики его обработки различные сорта активного угля содержат различного рода загрязнения (золу, серу, азот). На адсорбирующей поверхности угля имеются следы неорганических оксидов, а также функциональные кислородсодержащие группы. Вследствие очень большой геометрической и химической неоднородности поверхности регистрируемые на хроматограмме пики даже низкокипящих газов обнаруживают асимметрию (“хвосты”). Углеродные молекулярные сита. Термическим разложением виниленхлорида при соответствующих условиях можно получить микропористый углерод с удельной поверхностью 10001200 м2/кг и структурой молекулярного сита. Эти углеродные молекулярные сита поставляются в виде гранул или сферических частиц с улучшенными механическими свойствами. Молекулярно-ситовой эффект обусловлен наличием системы пор со средним диаметром 11.5 нм. Углеродные молекулярные сита обладают следующими важными для хроматографии свойствами:
Удерживание на углеродных молекулярных ситах, как и удерживание на графитированной термической саже, зависит от числа атомов углерода в молекуле и степени насыщенности связей. Первыми элюируются соединения с меньшим числом ненасыщенных связей, что очень важно при выявлении следов ненасыщенных соединений в насыщенных и менее ненасыщенных соединениях. Типичным примером является определение микропримесей метана и ацетилена в этилене. |
