Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Рассмотрите механизм реакции нитрования бензола. Какую роль играет серная кислота? Опыт 5. Образование и разложение фенолятов Реактивы и оборудование: Фенол, 10%-ный раствор гидроксида натрия, 10%-ный раствор серной кислоты, пробирки. Осторожно! Фенол вызывает ожоги кожи. Порядок проведения опыта: К 2 мл смеси фенола с водой прибавляют по каплям при перемешивании 10%-ный раствор гидроксида натрия до полного растворения фенола: 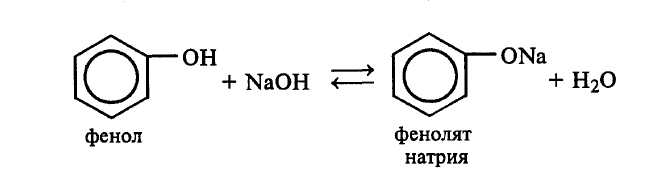 К полученному раствору фенолята натрия по каплям приливают 10%-ный раствор серной кислоты. Наблюдают помутнение раствора в результате разложения фенолята натрия серной кислотой и выделения малорастворимого в воде фенола:  Опыт 6. Взаимодействие фенола с бромной водой Реактивы и оборудование: 5%-ный раствор фенола, бромная вода; пробирки. Порядок проведения опыта: В пробирку наливают 1 мл 5%-ного раствора фенола и по каплям приливают бромную воду. Наблюдают образование белого осадка. При добавлении избытка бромной воды осадок становится желтым.  Почему реакция бромирования фенола (механизм SE) идет в более мягких условиях по сравнению с толуолом и бензолом? Какой продукт образуется при действии избытка бромной воды на трибромфенол? Опыт 7. Окисление фенола Реактивы и оборудование: 5%-ный раствор фенола, 5%-ный раствор карбоната натрия, 1%-ный раствор перманганата калия; пипетки, пробирки. Порядок проведения опыта: В пробирке смешивают 1 мл 5%-ного раствора фенола и 1 мл 5%-ного раствора карбоната натрия. По каплям при перемешивании приливают 1%-ный раствор перманганата калия. Наблюдают обесцвечивание раствора и выпадение бурого осадка оксида марганца (IV). Объясните наблюдаемое изменение окраски. Опыт 8. Цветная реакция на фенол Реактивы и оборудование: 1%-ный раствор фенола (свежеприготовленный), 2%-ный раствор хлорида железа (III); пипетки. Порядок проведения опыта: В пробирку наливают 1 мл 1%-ного раствора фенола и добавляют 3–4 капли 2%-ного раствора хлорида железа (III). В результате образования комплексного соединения в пробирке появляется сине–фиолетовая окраска: 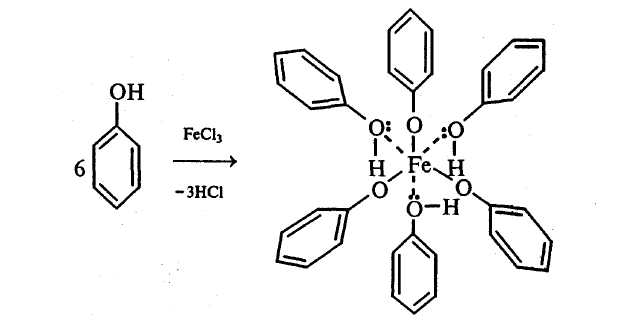 Следует помнить, что раствор фенола должен быть приготовлен не ранее, чем за 1–2 дня до проведения реакции, так как фенол легко окисляется и его растворы темнеют. Опыт 9. Взаимодействие бензойной и салициловой кислот с бромной водой Реактивы и оборудование: Насыщенные растворы бензойной и салициловой кислот, бромная вода (насыщенная); пипетки, пробирки. Порядок проведения опыта: В две пробирки наливают по 1–2 мл насыщенных растворов бензойной и салициловой кислот. В каждую пробирку добавляют по несколько капель насыщенной бромной воды. Обесцвечивание бромной воды происходит только в пробирке с салициловой кислотой:  Напишите механизм данной реакции. Объясните, почему бензойная кислота не взаимодействует с бромом при данных условиях. Опыт 10. Реакции бензойной и салициловой кислот с хлоридом железа (III) Реактивы и оборудование: Насыщенные растворы бензойной и салициловой кислот, 1%-ный раствор хлорида железа (III); пипетки, пробирки. Порядок проведения опыта: В две пробирки наливают по 1 мл насыщенных растворов бензойной и салициловой кислот, добавляют по 1 мл воды, а затем по 1–2 капли 1%-ного раствора хлорида железа (III). Бензойная кислота не взаимодействует с хлоридом железа (III), а в пробирке с салициловой кислотой появляется фиолетовая окраска. Объясните изменение окраски. ЗАДАЧИ И УПРАЖНЕНИЯ 1. Составьте структурную формулу бензола, предложенную Кекуле. В чем заключаются ее недостатки? Какие имеются доказательства равноценности всех шести углерод–углеродных связей? 2. Какие свойства бензола и его производных подразумевают под термином «ароматические свойства»? Приведите пояснения. 3. Какова общая формула углеводородов гомологического ряда бензола? Напишите структурные формулы гомологов бензола состава: 1) С8Н10, 2) С6Н12. Назовите их. 4. Напишите структурные формулы следующих соединений: 1) симметричного триэтилбензола, 2) м-метилостирола, 3) трет-бутилбензола, 4) 3-этил-5-пропилтолуола, 5) 1,2-диметил-4-изопропилбензола, 6) гексаметилбензола. 5. Какие продукты образуются при коксовании каменного угля? В каких условиях его проводят? Какие ароматические соединения содержатся в коксовом газе? Какие фракции выделяют при перегонке каменноугольной смолы и какие ароматические соединения получают из каждой фракции? 6. Основными процессами, протекающими при ароматизации нефти (каталитическом риформинге), являются: 1) дегидрирование шестичленных циклоалканов, 2) изомеризация пятичленных циклоалканов в шестичленные с последующей дегидрогенизацией, 3) дегидроциклизация алканов и алкенов. Составьте схемы образования этими способами толуола. 7. Приведите схемы получения бензола из ацетилена: 1) стирола, 2) этилбензола. Отметьте условия реакций. 8. Составьте структурные формулы гомологов бензола, образующихся при действии металлического натрия на смеси: 1) бромбензола и бромэтана, 2) хлорбензола и изопропилхлорида, 3) хлорбензола и трет-бутилхлорида, 4) n-бромтолуола и втор-бутилхлорида. Какие побочные продукты при этом образуются? 9. Как можно получить бензол, исходя из следующих веществ: 1) циклогексана, 2) циклогексадиена, 3) гексана, 4) бензоата натрия, 5) ацетилена, 6) фенола? Напишите уравнения реакций. 10. Какие вещества образуются при взаимодействии в присутствии хлорида алюминия (реакция Фриделя–Крафтса): 1) толуола и бромэтана, 2) о-ксилола и изопропилхлорида, 1,3,5-триметилбензола и метанбромида? Какую роль в этих реакциях играет хлорид алюминия? Приведите схемы активирования алкилгалогенидов катализатором и рассмотрите механизмы реакций (SЕ2). Почему в реакции Фриделя–Крафтса реакционная способность алкилгалогенидов уменьшается в ряду: RF, RCl, RBr, RI? 11. Приведите уравнения реакций: 1) получения этилбензола алкилированием бензола этиленом (в присутствии H3PO4), 2) получения этилбензола алкилированием бензола хлорэтаном (в присутствии AlCl3). 3) Превращения этилбензола в стирол, 4) полимеризации стирола, 5) сополимеризации стирола бутандиеном-1,3, 6) сополимеризации стирола с акрилонитрилом. 12. Какие вещества получатся при каталитическом гидрировании: 1) толуола, 2) стирола, 3) фенилацетилена, 4) 1-метил-4-изопропилбензола? Укажите условия реакций. Почему нельзя получить циклогексен и циклогексадиен каталитическим гидрированием бензола? 13. Какие вещества образуются при действии на бензол: 1) бромной воды, 2) хлора (на солнечном свету), 3) хлороводорода, 4) брома (в присутствии FeBr3)? Во всех ли случаях пойдет реакция? Напишите уравнения реакций, назовите полученные вещества и рассмотрите механизмы первой и четвертой реакций. 14. Напишите уравнения реакций согласно схеме: HBr KCNS H2O (H+) С    тирол А В С тирол А В СНазовите все продукты. Объясните механизм первой реакции и ответьте на вопрос, почему реакции присоединения галогеноводородов у стирола идут легче, чем у этилена. 15. Какие вещества образуются при действии хромовой смеси на следующие вещества: 1) этилбензол, 2) изопропилбензол, 3) втор-бутилбензол, 4) о-ксилол? Напишите уравнения реакций и подберите коэффициенты. 16. Как будет реагировать стирол со следующими веществами: 1) бромной водой, 2) водным раствором перманганата калия на холоде, 3) водным раствором перманганата калия при кипячении, 4) бромоводородом, 5) водородом в присутствии платины на холоде? Напишите уравнения реакций. 17. Установите строение углеводородов состава: 1) С8Н6 и 2) С9Н8, если известно, что они обесцвечивают бромную воду, дают осадок с аммиачным раствором хлорида меди (I), а при окислении образуют бензойную кислоту. 18. Какие реакции называют реакциями электрофильного замещения? Пользуясь современными представлениями о строении бензола, объясните, почему для него характерны реакции электрофильного замещения, а не реакции присоединения 19. На примере реакций этилена и бензола с бромом сравните механизмы: 1) электрофильного присоединения (АЕ) к этилену и 2) электрофильного замещения (SE2) у бензола. На какой стадии наблюдается различие и почему? 20. Рассмотрите механизм электрофильного замещения в молекуле бензола на примерах: 1) нитрования, 2) сульфирования, хлорирования (в присутствии FeCl3). Какие частицы в каждом случае играют роль электрофильного реагента. 21. Напишите уравнения реакций электрофильного замещения в молекулах: 1) толуола, 2) фенола, 3) хлорбензола, применяя условное обозначение электрофильного реагента (Е+). 22. В каких соединениях, приведенных ниже, наблюдается согласованная ориентация заместителей, а в каких — несогласованная: 1) м-динитробензоле, 2) п-дибромбензоле, 3) м-крезоле, 4) о-бромтолуоле, 5) м-нитробензолсульфокислоте? 23. Предложите схемы получения: а) из толуола всех изомерных нитробензойных кислот; б) из бензола всех изомерных хлорбензойных кислот. 24. Установите строение соединения С8Н9NO2, которое не реагирует с водным раствором щелочи, а при бромировании в присутствии железа дает только одно монобромпроизводное. 25. Соединение состава С8Н10О2 не растворяется в щелочи и не дает окрашивания с FeCl3. При нагревании с иодистоводородной кислотой образует вещество С6Н6О2, которое легко окисляется до 1,4-бензохинона. Установите строение исходного соединения. ……только идеи имеют непреходящую ценность Альберт Эйнштейн ЛАБОРАТОРНАЯ РАБОТА № 5. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ Продолжительность работы — Общее представление о полимерах. Элементарное звено. Степень полимеризации. Период идентичности. Линейные, разветвленные и пространственные полимеры. Химическая классификация полимеров. Карбоцепные и гетероцепные полимеры. Общие свойства высокомолекулярных соединений. Понятие о средней массе полимеров. Гибкость макромолекул. Различия понятий «полимер» и «пластмасса». Физические состояния полимеров. Понятие о кристалличности полимеров. Методы синтеза высокомолекулярных соединений. Мономер — структурная единица полимера. Функциональность полимера. Связь между строением мономера и его способностью к образованию полимеров. Реакция полимеризации. Элементарные акты радикальной полимеризации: инициирование, рост цепи и ее обрыв. Ионная полимеризация. (катионная и анионная). Анионно–координационная полимеризация. Катализаторы Циглера–Натта и стереорегулярные полимеры. Полимераналогичные превращения и макромолекулярные реакции. Деструкция полимеров. Стабилизация полимеров. ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ Высокомолекулярные соединения (ВМС) — это химические вещества, которые состоят из большого числа повторяющихся группировок (мономерных звеньев), соединенных между собой химическими связями. Молекулы высокомолекулярных соединений (полимеров) имеют высокую молекулярную массу (от нескольких тысяч до многих миллионов) и называются макромолекулами. Согласно способам получения все органические ВМС делят на три группы: природные (белки, нуклеиновые кислоты, целлюлоза, натуральный каучук и др.), синтетические (полиэтилен, поливинилхлорид, полистирол и др.) и искусственные, которые получают путем химической модификации природных полимеров (эфиры целлюлозы, хлорированный натуральный каучук и др.). Подавляющее большинство синтетических полимеров обладает лучшими эксплуатационными свойствами по сравнению с природными полимерами. Это позволяет использовать их в качестве конструктивных материалов, с успехом заменять ими даже некоторое металлы. Появились полимеры, способные выдерживать высокие температуры, противостоять различным излучениям. Полимеры широко проникают в машиностроение, авто- и авиационную промышленность, радиоэлектронику, медицину, космическую технологию. Все более крупным потребителем полимерных материалов становится строительство. Использование различных полимеров позволило резко расширить ассортимент и улучшить качество строительных материалов и изделий. Современные исследования в области полимеров направлены на создание синтетических материалов, обладающих нетрадиционными свойствами. Большое внимание при этом уделяется таким полимерам, которые не ухудшали бы экологическую обстановку. Опыт 1. Получение мочевино–формальдегидной смолы Реактивы и оборудование: Мочевина, формалин, 25%-ный раствор аммиака, насыщенный раствор щавелевой кислоты; пробирки, кипятильники, водяные бани. Порядок проведения опыта: В пробирку вносят 1 г мочевины, 4 мл формалина, 0,5 мл 25%-ного раствора аммиака и кипятильник. Смесь кипятят несколько минут, а затем после охлаждения разливают в две пробирки. В одну из них добавляют 1–2 капли насыщенного раствора щавелевой кислоты и перемешивают. Обе пробирки нагревают на кипящей водяной бане несколько минут, охлаждают и добавляют к содержимому по 1–2 мл воды. В какой из пробирок произошло отвердение массы? Сравните растворимость полученных веществ в воде. Опыт 2. Получение новолачной смолы Реактивы и оборудование: 40%-ный раствор формальдегида (формалин), фенол, концентрированная соляная кислота; пробирки, стекло, водяные бани. Порядок проведения опыта: В пробирку вносят 1,5 мл 40%-ного раствора формальдегида (формалина) и 1 г фенола. Смесь нагревают до получения однородного раствора, добавляют несколько капель соляной кислоты и нагревают 5–10 мин до помутнения и расслоения содержимого пробирки. Верхний водный слой сливают, заливают в пробирку немного воды и нагревают еще 1–2 мин. Затем воду снова сливают, а смолу переносят на стекло, где через некоторое время она затвердевает. Опыт 3. Отношение каучука и пластмасс к растворителям Реактивы и оборудование: Кусочки натурального каучука, полистирола, поливинилхлорида, полиэтилена, аминопласта; ацетон; пробирки. Порядок проведения: В пять пробирок вносят по кусочку натурального каучука, полистирола, поливинилхлорида, полиэтилена и аминопласта. В каждую пробирку добавляют по 1–2 мл ацетона и выдерживают 30 мин. Сделайте вывод о растворимости каучука и пластмасс. Опыт 4. Отношение пластмасс к щелочам и кислотам Реактивы и оборудование: Кусочки полистирола, полиэтилен, фенопласта, аминопласта; концентрированная серная кислота, 20%-ный раствор гидроксида натрия; пробирки. Порядок проведения опыта: В четыре пробирки вносят по кусочку полистирола, полиэтилена, фенопласта и аминопласта. В каждую пробирку добавляют по 1–2 мл концентрированной серной кислоты и осторожно встряхивают. Через несколько минут сливают кислоту и промывают пластмассу водой. Сравните стойкость пластмасс к действию кислоты. Опыт повторяют с теми же образцами пластмасс, заменив кислоту на 20%-ный раствор гидроксида натрия. Сравните стойкость пластмасс к действию щелочи. Опыт 5. Отношение пластмасс к нагреванию и горению Реактивы и оборудование: Кусочки полиэтилена, полистирола, поливинилхлорида, аминопласта, фенопласта; фарфоровые чашки, электроплитки, стеклянные палочки, проволока, продетая через корковую пробку. Порядок проведения опыта: В фарфоровую чашку помещают поочередно по кусочку полиэтилена, полистирола, поливинилхлорида, аминопласта и фенопласта и нагревают на электроплитке. Через несколько минут образцы проверяют, прикасаясь к ним стеклянной палочкой. Отметьте скорость размягчения образцов и характер этого размягчения в зависимости от степени нагревания. Кусочки этих же пластмасс закрепляют в проволоке (продетой через корковую пробку, чтобы было удобно держать в руке) и вносят в пламя спиртовки. Отметьте характер горения. Опыт 6. Характер продуктов, образующихся при разложении пластмасс Реактивы и оборудование: Образцы пластмасс, используемые в опыте 49, разбавленный раствор перманганата калия, бромная вода; лакмусовая бумага. Порядок проведения опыта: Образцы пластмасс, используемые в опыте 49, вносят в отдельные пробирки, закрывают их пробкой с газоотводной трубкой и поочередно нагревают в пламени спиртовки. Выделяющиеся при разложении газообразные продукты пропускают через раствор перманганата калия или бромную воду, а также испытывают на лакмусовую бумажку. |
