Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Строение карбоксильной группы. Одноосновные предельные кислоты. Изомерия и номенклатура. Способы получения. Физические и химические свойства. Индуктивный эффект. Функциональные производные карбоновых кислот: галогенангидриды, ангидриды, сложные эфиры, амиды, гидропероксиды и пероксиды. Высшие жирные кислоты (ВЖК). Мыла. Одноосновные непредельные кислоты и их свойства. Двухосновные предельные и непредельные карбоновые кислоты. Сложные эфиры. Получения и свойства. Реакция этерификации. Жиры. Олифа. Воски. ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ Муравьиная кислота НСООН — жидкость с резким запахом, t. кип. 100,8°С. Образует с водой азеотропную смесь, содержащую 77,5% кислоты и кипящую при 107°С. При попадании на кожу вызывает ожоги. Вдыхание ее паров вызывает сильное раздражение дыхательных путей. В промышленности муравьиную кислоту получают из ее натриевой соли (формиата натрия), которая образуется при пропускании оксида углерода через раствор гидроксида натрия: 125–150°C, 0,5–1,0 MПа СО + NaOH ————————→ НСООNa Полученную соль действием серной кислоты переводят в свободную кислоту: 2НСООNa + H2SO4 ———→ Na2SO4 + 2HCOOH Муравьиная кислота применяется (вместо уксусной кислоты) при крашении тканей, в кожевенном производстве, в консервном, спиртовом и пивоваренном производствах. Она применяется также в медицине, для приготовления катализаторов и в ряде синтезов. Уксусная кислота СН3СООН (безводная) при +16,6 °С застывает в кристаллическую массу, напоминающую кристаллы льда, поэтому такую кислоту называют ледяной. Она обладает характерным острым (уксусным) запахом, смешивается с водой в любом соотношении и кипит при нормальном давлении без разложения при 118,5°С. В промышленных маштабах ее получают рядом способов: 1) из ацетилена через уксусный альдегид; 2) при окислении предельных углеводородов; 3) при окислении спирта. В США уксусную кислоту получают главным образом окислением бутана. Ледяная уксусная кислота является прекрасным растворителем для многих органических веществ. Водные растворы кислоты поступают в продажу под названием столового уксуса (3–5%-ный раствор) и уксусной эссенции (70–80%-ный раствор). Ледяная и концентрированная уксусная кислота вызывают ожоги на коже. Уксусная кислота широко применяется при крашении и ситцепечатании, в кожевенном производстве, для получения сложных эфиров, используемых в лакокрасочной (растворители), пищевой (эссенции) и других отраслях промышленности. Пропионовая кислота С2Н5СООН плавится при –22°С и кипит при 141°С. Ее получают преимущественно окислением пентана. Она находит применение в синтезе гербицидов, консервантов, полимерных материалов. Высшие жирные кислоты. В природе в свободном состоянии и в составе жиров обнаружено несколько предельных жирных кислот. Низшие члены ряда (С4–С10) входят в состав липидов молока. Кислоты с промежуточной длиной цепи (С8–С14) содержатся в маслах некоторых семян. Наиболее распространены в природе пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты. В промышленности их получают гидролизом (омылением) жиров, а также каталитическим окислением парафинов. Соли этих кислот называют мылами. Натриевые и калиевые мыла растворимы в воде и хорошо «мылятся». Соли магния, кальция, бария и некоторых других металлов очень плохо растворяются в воде; поэтому обычные мыла в жесткой воде, переходя в нерастворимое состояние, не «мылятся», не пенятся, становятся липкими. Эфиры пальмитиновой кислоты составляют главную часть пчелиного воска. Получаемая при омылении жиров смесь твердых жирных кислот, главным образом С15Н31СООН и С17Н35СООН, называется стеарином. Из стеарина с небольшой добавкой парафина изготовляют стеариновые свечи. Из высших ненасыщенных кислот большое значение имеет олеиновая кислота С17Н33СООН, остаток которой, наряду с остатками пальмитиновой и стеариновой кислот, входит в состав жиров. Олеиновую кислоту получают омылением некоторых растительных масел. Это маслообразная жидкость без запаха и вкуса. Щелочные соли олеиновой кислоты — олеиновые мыла — применяются в технике, например для промывания шерсти и для других целей. Щавелевая кислота НООС–СООН — простейший представитель предельных двухосновных кислот, содержится в виде солей во многих растениях, например в щавеле и кислице. В промышленности щавелевую кислоту получают окислением древесных опилок кислородом воздуха при нагревании их с расплавленным КОН или смесью КОН + NaOH, а также при быстром нагревании до 400 °С калиевой или натриевой соли муравьиной кислоты. Щавелевая кислота применяется при полировке металлов, в деревообрабатывающей промышленности (отбелка орехового и красного дерева), при очистке урана, в качестве катализатора в процессах дегидратации, в реакциях поликонденсации (например, при получении фенолформальдегидных смол), в красильной и кожевенной промышленности и т.п. ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ Опыт 1. Растворимость предельных карбоновых кислот в различных растворителях Реактивы и оборудование: Карбоновые кислоты (муравьиная, уксусная, масляная и стеариновая), этиловый спирт, диэтиловый эфир; пробирки. Порядок проведения опыта: В четыре пробирки вносят по 0,5 мл муравьиной, уксусной, масляной и стеариновой кислот и добавляют по 2–3 мл дистиллированной воды. Содержимое пробирок тщательно перемешивают, если кислота не растворяется, пробирку нагревают. Отмечают, что растворимость карбоновых кислот в воде с увеличения молекулярной массы уменьшается. Плохо растворимые в воде высшие карбоновые кислоты хорошо растворяются в неполярных и слабополярных растворителях. Опыт повторяют, но в качестве растворителя используют этиловый спирт и диэтиловый эфир. Результаты опытов отмечают в рабочей тетради. Опыт 2. Сравнение силы карбоновых и минеральных кислот Реактивы и оборудование: 0,1М растворы муравьиной, уксусной, масляной, стеариновой и соляной кислот, универсальная индикаторная бумага со шкалой рН. Порядок проведения опыта: На полоску индикаторной бумаги наносят по капле растворов органических и соляной кислот и по шкале определяют рН этих растворов. Результаты опыта записывают в рабочей тетради. Опыт 3. Получение муравьиной кислоты Реактивы и оборудование: Хлороформ, 10%-ный раствор гидроксида натрия; обратные холодильники к пробиркам, пробирки. Порядок проведения опыта: В пробирку приливают 5–6 капель хлороформа, добавляют 2–3 мл 10% ного раствора гидроксида натрия и закрывают пробкой с обратным холодильником. Смесь осторожно при встряхивании нагревают на пламени спиртовки 3–4 мин (до кипения не доводить, так как хлороформ может испариться). В ходе реакции хлороформ гидролизуется в щелочной среде с образованием натриевой соли муравьиной кислоты. Напишите уравнение реакции получения муравьиной кислоты гидролизом хлороформа в щелочной среде. Опыт 4. Реакции окисления муравьиной кислоты Реактивы и оборудование: Муравьиная кислота (или формиат натрия), 10%-ный раствор гидроксида натрия, 5%-ный раствор аммиака, 1%-ный раствор нитрата серебра, 10%-ный раствор серной кислоты, 5%-ный раствор перманганата калия, известковая вода; водяные бани, пипетки, изогнутые газоотводные трубки, пробирки. 1. Окисление муравьиной кислоты аммиачным раствором гидроксида серебра (реакция «серебряного зеркала») Порядок проведения: В молекуле муравьиной кислоты есть карбонильная группа, поэтому эта кислота и ее соли, подобно альдегидам, легко вступают в реакции окисления. Обнаружить муравьиную кислоту и ее соли в растворе можно при помощи реакций, характерных для альдегидов, в частности реакции «серебряного зеркала». Для приготовления аммиачного раствора гидроксида серебра к 2–3 мл 1% ного раствора нитрата серебра добавляют 1–2 капли 10%-ного раствора гидроксида натрия. Образовавшийся осадок оксида серебра растворяют, добавляя по каплям 5%-ный раствор аммиака. К полученному прозрачному раствору приливают 0,5 мл формиата натрия, полученного в опыте 3 при щелочном гидролизе хлороформа. Пробирку с реакционной смесью нагревают на горячей водяной бане (70–80 °С). Через некоторое время наблюдают выделение металлического серебра в виде зеркального налета на стенках пробирки или черного осадка. Напишите уравнение реакции взаимодействия формиата натрия с аммиачным раствором гидроксида серебра и подберите коэффициенты методом электронного баланса. 2. Окисление муравьиной кислоты перманганатом калия. Порядок проведения: В пробирку помещают 0,5 г муравьиной кислоты или ее соли, 1 мл 10%-ного раствора серной кислоты и 2 мл 5%-ного раствора перманганата калия. Пробирку закрывают пробкой с газоотводной трубкой, конец которой помещают в пробирку с известковой водой. Реакционную смесь нагревают на пламени спиртовки. Через некоторое время розовая окраска раствора переходит в бурую, а затем раствор обесцвечивается. Известковая вода мутнеет вследствие образования осадка карбоната натрия. Напишите уравнения реакций и подберите коэффициенты. Опыт 5. Получение уксусной кислоты (тяга) Реактивы и оборудование: Ацетат натрия, концентрированная серная кислота, синяя лакмусовая бумага, газоотводные трубки с оттянутым концом, пробирки. Порядок проведения опыта: В пробирку помещают 0,5 г ацетата натрия и добавляют 1–2 мл концентрированной серной кислоты. Пробирку закрывают газоотводной трубкой с оттянутым концом и осторожно нагревают реакционную смесь на пламени спиртовки. Образующуюся уксусную кислоту обнаруживают по запаху (нюхать осторожно) и по изменению цвета влажной лакмусовой бумаги, поднесенной к концу газоотводной трубки. Напишите уравнение реакции. Опыт 6. Некоторые свойства уксусной кислоты и ее солей Реактивы и оборудование: Ледяная уксусная кислота, 10%-ный раствор уксусной кислоты, 10%-ный раствор карбоната натрия, металлический магний, оксид меди (II), этиловый спирт, концентрированная серная кислота, насыщенный раствор хлорида натрия; водяные бани, термометры, обратные холодильники к пробиркам, газоотводные трубки с оттянутым концом, пробирки. 1. Взаимодействие уксусной кислоты с карбонатом натрия Порядок проведения: К 1–2 мл 10%-ного карбоната натрия приливают 1 мл ледяной уксусной кислоты. Наблюдают выделение углекислого газа: 2СН3–СООН + Na2CO3 → 2CH3–COONa + H2CO3 H2CO3 → CO2↑ + H2O Будет ли уксусная кислота взаимодействовать с растворами сульфата натрия и хлорида натрия? 2. Взаимодействие уксусной кислоты с магнием и оксидом меди (II) Порядок проведения: В пробирку наливают 2 мл уксусной кислоты и добавляют 0,1–0,2 г металлического магния. Пробирку закрывают пробкой с газоотводной трубкой с оттянутым концом. Выделяющийся газ через некоторое время поджигают. Напишите уравнение протекающей реакции. В пробирку вносят 0,1–0,2 г оксида меди (II)и 2 мл уксусной кислоты, а затем ее осторожно нагревают на пламени горелки. Обращают внимание на изменение цвета раствора. 2CH3–COOH + CuO → (CH3–COOO)2Cu + H2O ацетат меди (II) 3. Получение этилацетата Порядок проведения: В сухую пробирку наливают 2 мл этилового спирта, 2 мл ледяной уксусной кислоты и 1 каплю концентрированной серной кислоты. Пробирку закрывают пробкой с обратным холодильником и нагревают на водяной бане 5–10 мин при температуре около 70°С. H2SO4 (конц.) CH3–COOH + CH3–CH2–OH ↔ CH3–CO–O–CH2–CH3 + H2O Раствор охлаждают. Для выделения этилацетата к содержимому пробирки приливают 3–4 мл насыщенного раствора хлорида натрия. Этилацетат в процессе высаливания всплывает, образуя слой бесцветной жидкости с приятным запахом. Рассмотрите механизм реакции этерификации. В чем заключается роль серной кислоты? Почему при добавлении избытка концентрированной серной кислоты сложный эфир карбоновой кислоты не образуется? Опыт 7. Получение высших жирных кислот и их свойства Реактивы и оборудование: Мыло (стружки), 1%-ный водный раствор мыла, спиртовой раствор мыла, 10%-ный раствор серной кислоты, 5%-ный раствор хлорида кальция, 5%-ный раствор сульфата меди (II), 5%-ный раствор гидроксида натрия, 10%-ная соляная кислота, 1%-ный спиртовой раствор фенолфталеина, диэтиловый эфир; стаканы на 50 мл, пробирки. 1. Выделение высших жирных кислот из мыла В стакане готовят 10–20 мл водного раствора мыла (1 г мыльной стружки на 8–10 мл дистиллированной воды). Большую его часть оставляют для проведения следующих опытов. В пробирку наливают 2–3 мл полученного водного раствора мыла и добавляют 2–3 мл 10%-ного раствора серной кислоты. Раствор мутнеет вследствие выпадения нерастворимых в воде высших жирных кислот: С17Н35–COONa + H2SO4 → С17Н35–COOH↓ + NaHSO4 Пробирку со смесью нагревают почти до кипения. Расплавившиеся жирные кислоты всплывают в виде слоя, который затвердевает при охлаждении. Какие высшие предельные кислоты входят в состав мыла? 2. Гидролиз мыла (натриевых солей высших жирных кислот) В сухую пробирку наливают 1–2 мл спиртового раствора мыла и добавляют 1–2 капли 1%-ного спиртового раствора фенолфталеина. Содержимое этой пробирки осторожно по стенке переливают в пробирку с дистиллированной водой. На границе раздела слоев воды и спиртового раствора мыла появляется кольцо малиново-розового цвета. Объясните результаты опыта. Напишите уравнение гидролиза стеарата натрия. 3. Образование нерастворимых солей высших жирных кислот Порядок проведения: Для опыта используют водный раствор мыла, полученный в первой части опыта. В три пробирки наливают по 1 мл водного раствора мыла, затем в первую пробирку вносят 1 мл 5%-ного раствора хлорида кальция, во вторую — 1 мл 5%-ного раствора сульфата меди (II). В первой пробирке выпадает белый осадок нерастворимых в воде кальциевых солей высших жирных кислот (кальциевое мыло). 2С17Н35–COONa + СаСl2 → (СН3–COO)2Ca↓ + NaCl стеарат кальция К осадку кальциевого мыла прибавляют 1 мл 10%-ного раствора соляной кислоты. При этом осадок растворяется, а высшие жирные кислоты постепенно всплывают над жидкой фазой. (СН3–СОО)2Са + 2НСl → 2С17Н35–СООН + СаСl2 Во второй пробирке выпадает голубовато-зеленый осадок медного мыла. Напишите уравнение реакции взаимодействия стеарата натрия с сульфатом меди (II). 4. Кислотные свойства высших жирных кислот Порядок проведения: 0,1 г стеарина растворяют в диэтиловом эфире (без нагревания) и добавляют несколько капель спиртового раствора фенолфталеина. По каплям приливают 5%-ный раствор гидроксида натрия. Появляющаяся малиновая окраска при встряхивании исчезает.Объясните, почему. НЕПРЕДЕЛЬНЫЕ КАРБОНОВЫЕ КИСЛОТЫ Опыт 8. Свойства олеиновой кислоты Реактивы и оборудование: Олеиновая кислота, 2%-ный раствор перманганата калия, 10%-ный раствор карбоната натрия, бромная вода (насыщенная), концентрированная азотная кислота, медные стружки или проволока; пробирки. 1. Взаимодействие олеиновой кислоты с бромной водой Порядок проведения: В пробирку наливают 1 мл бромной воды и 1 мл олеиновой кислоты. Смесь энергично перемешивают. Наблюдают обесцвечивание бромной воды. Почему? Напишите уравнение реакции взаимодействия олеиновой кислоты с бромной водой. По какому механизму протекает эта реакция? 2. Окисление олеиновой кислоты перманганатом калия (реакция Вагнера) Порядок проведения: В пробирку вносят 1,5 мл 2%-ного раствора перманганата калия, 1,5 мл 10%-ного раствора карбоната натрия и 0,5 мл олеиновой кислоты. Полученную смесь энергично встряхивают. Что наблюдаете? Напишите уравнение протекающей реакции. 3. Изомеризация олеиновой кислоты в элаидиновую (тяга) Порядок проведения: В пробирку помещают 1 мл олеиновой кислоты, немного медных стружек (или небольших кусочков медной проволоки) и 1,5 мл концентрированной азотной кислоты. Содержимое пробирки энергично встряхивают и оставляют в штативе под тягой. Наблюдают выделение оксидов азота бурого цвета, появляющихся в результате взаимодействия концентрированной азотной кислоты с медью. Оксиды азота являются катализаторами процесса изомеризации олеиновой кислоты в элаидиновую. Вспенившаяся масса олеиновой кислоты (цис-изомер) затвердевает вследствие образования твердой элаидиновой кислоты (транс-изомер). 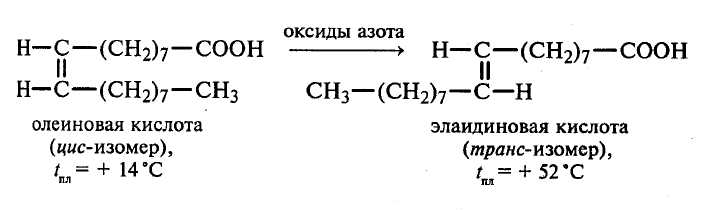 Следует помнить, что затвердевание массы кислоты происходит не сразу, и поэтому пробирку оставляют в вытяжном шкафу на 1,5 ч. |
