ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ
Опыт 9. Свойства щавелевой кислоты
Реактивы и оборудование:
Щавелевая кислота кристаллическая C2H2O4·2H2O, насыщенный раствор щавелевой кислоты, 1М раствор щавелевой кислоты, 2М раствор гидроксида калия, 10%-ный раствор серной кислоты, 5%-ный раствор перманганата калия, известковая вода; изогнутые газоотводные трубки, пипетки, пробирки.
1. Получение калиевых солей щавелевой кислоты
Порядок проведения:
В пробирку наливают 2 мл 1М раствора щавелевой кислоты и добавляют 1 мл 2М раствора гидроксида калия. Наблюдают выпадение осадка кислой калиевой соли щавелевой кислоты (значительное количество такой соли содержится в щавеле).
К осадку добавляют избыток гидроксида калия и наблюдают его растворение вследствие образования средней соли щавелевой кислоты
Напишите уравнения реакций образования калиевых солей (кислой и средней) щавелевой кислоты.
2. Декарбоксилирование щавелевой кислоты при нагревании
Порядок проведения:
В сухую пробирку вносят
1 г щавелевой кислоты. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой опускают в пробирку с известковой водой, и нагревают. При нагревании щавелевая кислота декарбоксилируется. Выделяющийся оксид углерода (IV) обнаруживают по помутнению известковой воды.
Напишите уравнения реакций: разложения щавелевой кислоты при нагревании, взаимодействия оксида углерода (IV) с известковой водой.
3. Окисление щавелевой кислоты перманганатом калия
Порядок проведения:
В пробирку наливают 1 мл насыщенного раствора щавелевой кислоты, добавляют 1 мл 10%-ного раствора серной кислоты и 2 мл 5%-ного раствора перманганата калия. Пробирку закрывают пробкой с изогнутой газоотводной трубкой, конец которой погружают в известковую воду. Реакционную смесь несильно нагревают.
Как изменяется окраска реакционной смеси и что происходит в пробирке с известковой водой? Напишите уравнение реакции окисления щавелевой кислоты перманганатом калия в кислой среде и подберите коэффициенты.
ЗАДАЧИ И УПРАЖНЕНИЯ
1. Каковы структурные формулы изомерных кислот, имеющих состав С5Н10О2 (четыре изомера)?
2. Составьте структурные формулы и назовите кислотные радикалы (ацилы) следующих кислот: а) муравьиной, б) уксусной, в) масляной, 4) валериановой, 5) капроновой.
3. Напишите структурные формулы следующих кислот:
1) изомасляной, 2) валериановой, 3) метилэтилуксусной,
4) капроновой, 5) пальмитиновой, 6) стеариновой.
5. Как, исходя из пропандихлорида-1,1, можно получить пропионовую кислоту? Напишите уравнения реакций.
6. Осуществите схему превращений. Назовите продукт С:
HCl KCN H2O (H+)
   СН3–СН=СН2 А Б С СН3–СН=СН2 А Б С
7. Уксусную кислоту в технике получают из ацетилена, окислением предельных углеводородов или этилового спирта. Напишите уравнения этих реакций.
8. Приняв за исходное вещество бутен-2, напишите уравнения реакций получения метилуксусной кислоты следующими способами: 1) действием оксида углерода (II) и воды в присутствии тетракарбонила никеля (синтез Реппе), 2) с применением цианида калия.
9. Рассмотрите электронное строение карбоксильной группы. Объясните взаимное влияние гидроксильной и карбонильной групп. Сравните силу предельных двухосновных кислот.
10. Объясните, почему карбоновые кислоты имеют аномально высокие температуры кипения и плавления.
11. Составьте схемы взаимодействий уксусной кислоты со следующими веществами:
1) гидроксидом магния, 2) карбонатом магния, 3) хлором,
4) оксидом кальция, 5) гидроксидом натрия, 6) PCl5.
12. Назовите соединение, которое образуется при восстановлении триметилуксусной кислоты алюмогидридом лития.
13. Напишите уравнения взаимодействия муравьиной кислоты: а) с серной кислотой, 2) с аммиачным раствором оксида серебра.
14. Как из пропионовой кислоты получить: 1) гексанон-3, 2) этан, 3) пропан.
15. Какие вещества используются в качестве синтетических моющих средств? Напишите реакции их получения.
16. Напишите уравнения реакций присоединения бромистого водорода к следующим кислотам: а) акриловая, б) метакриловая. Объясните порядок присоединения галогеноводорода.
17. Какие соединения образуются: а) при осторожном (щелочным раствором перманганата калия) и б) энергичном (хромовой смесью) окислении олеиновой кислоты?
18. Напишите уравнения реакций присоединения к олеиновой кислоте: а) брома, б) водорода. Назовите продукты.
19. Как изменяется сила двухосновных кислот в гомологическом ряду?
20. Напишите уравнения следующих реакций: а) щавелевая кислота и раствор едкого натра, б) щавелевая кислота и Са(ОН)2, в) янтарная кислота и раствор едкого кали.
21. Дано вещество, имеющее эмпирическую формулу С4Н6О4. Оно обладает кислотными свойствами. При взаимодействии его с этиловым спиртом в присутствии хлороводорода получается новое вещество состава С8Н14О4. Исследуемое соединение при нагревании выделяет оксид углерода (IV) и образует вещество состава С3Н6О2, обладающее кислотными свойствами. Установите строение исследуемого вещества.
Научить ничему нельзя — можно только научиться.
Популярное высказывание.
ЛАБОРАТОРНАЯ РАБОТА № 4
АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ: БЕНЗОЛ
И ЕГО ПРОИЗВОДНЫЕ
Продолжительность работы —
Бензол — ароматическая система Электронное строение молекулы бензола. Понятие «ароматичности». Гомологи и изомерия ароматических углеводородов. Номенклатура. Способы получения бензола и его гомологов. Химические свойства. Реакции электрофильного замещения. Механизм этих реакций; π- и σ-комплексы. Ориентанты I и II рода. Механизм ориентирующего влияния заместителей.
Ароматические галогенпроизводные. Роль катализатора в реакции галогенирования при замещении в ядро. Замещение в боковой цепи. Различие условий проведения этих реакций. Химические свойства ароматических галогенпроизводных. Сравнение подвижности галогена в галогенпроизводных ароматического и алифатических рядов.
Ароматические нитросоединения. Нитрующий агент. Химические свойства ароматических нитросоединений.
Фенолы. Классификация. Одноатомные фенолы. Номенклатура. Химические свойства. Причина кислотности фенолов. Двух-и трехатомные фенолы. Хиноидная структура.
Ароматические спирты. Получение и свойства.
Ароматические альдегиды и кетоны. Получение. Свойства.
Ароматические карбоновые кислоты. Классификация. Бензойная кислота и ее производные. Хлористый бензоил. Антраниловая, n-аминорбензойная кислота, сульфобензойная кислота и салициловая кислота.
Ароматические амины. Классификация. Анилин. Получение и химические свойства.
ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ
Трудно переоценить значение крупномаштабного производства бензола и его производных для химической промышленности и для всей экономики. Подобно получаемым из нефти алканам, которые служат основным источником почти всех алифатических соединений, бензол и его гомологи являются основным источником почти всех ароматических соединений. Обычно для синтеза сложного ароматического соединения в лаборатории или в промышленности берут более простое соединение, уже содержащее бензольное кольцо, и затем постепенно присоединяют к нему различные группы до тех пор, пока не получат нужную структуру.
Существует два источника органических соединений — уголь и нефть, и ароматические соединения получают из обоих. Ароматические соединения выделяют из каменноугольной смолы или синтезируют из алканов нефти.
Бóльшую часть добываемого в настоящее время угля превращают в кокс, который необходим для выплавки стали из железа. При нагревании угля до высокой температуры в отсутствие воздуха он превращается в кокс, при этом образуется газообразная смесь соединений, которая частично конденсируется с образованием каменноугольной смолы, а частично остается в газообразном состоянии (каменноугольный газ).
Из каменноугольной смолы перегонкой получают ряд ароматических соединений. При коксовании из 1 т мягкого угля можно получить около 55 кг каменноугольной смолы. Из 55 кг этой смолы можно выделить следующие ароматические соединения: бензол (900 г), толуол (225 г), ксилолы (45 г), фенол (225 г), крезолы (900 г), нафталин (2300 г). Выход бензола (900 г) из 1 т угля не очень высокий; однако коксованию подвергается такое большое количество угля, что ежегодно производство бензола из каменноугольной смолы достигает очень больших размеров.
Во время второй мировой войны потребность в толуоле для производства тринитротолуола (ТНТ) значительно превысила 120–150 млн. л., ежегодно получаемых из каменноугольной смолы. Поэтому были разработаны методы получения толуола из алифатических углеводородов нефти, состоящие в основном в дегидрировании метилциклогексана, получаемого из нефти. Этот процесс, называемый каталитическим реформингом, заключается в пропускании алифатического углеводорода при высокой температуре и давлении над платиновым катализатором. В результате производство толуола возросло с 120–150 млн. л в 1940 г. до 1 млрд. л. В 1944 г.
При каталитическом реформинге происходит не только дегидрирование, но также циклизация и изомеризация, как, например, при синтезе толуола из н-гептана или 1,2-диметилциклопентана. Аналогично бензол получают из циклогексана и метилциклопентана, а также из толуола в результате гидродезалкилирования.
В настоящее время нефть служит основным источником огромных количеств бензола, толуола и ксилолов, необходимых для производства химических реактивов и топлива. Половина полученных таких путем толуола и ксилолов смешивается с другими фракциями переработки нефти с целью получения высокооктанового бензина, и в известной степени они заменяют алифатические соединения, из которых они были синтезированы и которые являются топливом худшего качества.
Бензол С6Н6 — легкая бесцветная жидкость (t.кип. 80,1°С) специфическим запахом. Мало растворим в воде (образует с ней азеотропную смесь). Бензол служит сырьем для производства различных химических продуктов: нитробензола, хлорбензола, анилина, фенола, стирола и др. Применяют для синтеза красителей, пестицидов, полимеров, ПАВ, взрывчатых веществ и фармацевтических препаратов. Служит добавкой к моторному топливу для повышения октанового числа.
Толуол (метилбензол) С6Н5–СН3 — бесцветная жидкость (t.кип. 110,6°С), легче воды. Главное применение — производство взрывчатых веществ (тринитротолуол, тротил), бензойного альдегида, фенола и хлористого бензила — полупродуктов анилинокрасочной, парфюмерной, пищевой и других отраслей промышленности. Применяется как растворитель.
Ксилолы (диметилбензолы) С6Н4(СН3) — До недавнего времени в лабораторной практике и технике применялась смесь трех изомерных ксилолов, получавшихся при разгонке углеводородных фракций каменноугольной смолы. Такая смесь с t.кип. 138–142°С используется главным образом как растворитель и как компонент моторного топлива (октановое число более 120). В последние десятилетия получили широкое применение отдельные изомерные ксилолы, особенно п-ксилол (как исходное сырье в производстве синтетического волокна лавсан (терилен). Аминоксилолы применяются в качестве антидетонаторов.
Разделяют ксилолы ступенчатым вымораживанием.
Фенол С6Н5–ОН — кристаллическое вещество, t.пл. 43°С, т.кип. 181°С., растворяется в воде. С водой дает гидрат называемый обычно карболовой кислотой. Даже небольшие количества воды сильно снижают температуру плавления фенола. Фенол обладает характерным едким запахом. Он вызывает ожоги на коже. Является одним из первых примененных в медицине антисептиков.
Фенол содержится в моче человека и животных, так как белковые аминокислоты, содержащие бензольное кольцо, при расщеплении в организме дают фенол.
Фенол применяется в больших количествах для получения пластических масс (конденсация с формальдегидом), лекарственных препаратов (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота).
Опыт 1. Отношение ароматических углеводородов к окислителям
Реактивы и оборудование:
Бензол, толуол, 5%-ный раствор перманганата калия, 10%-ный раствор серной кислоты; обратные холодильники к пробиркам, водяные бани.
Порядок проведения опыта:
В две пробирки наливают по 1 мл бензола и толуола и добавляют по 1 мл 5%-ного раствора перманганата калия и 10%-ного раствора серной кислоты в каждую. Пробирки закрывают пробками с воздушными холодильниками и нагревают на водяной бане. В пробирке с толуолом наблюдают обесцвечивание перманганата калия, а в пробирке с бензолом никаких изменений не происходит.
Приведите объяснения результатам опыта? Напишите уравнение реакции окисления толуола перманганатом калия.
Опыт 2. Бромирование бензола (тяга)
Реактивы и оборудование:
Бензол, раствор брома в тетрахлориде углерода (1:5), железные опилки, синяя лакмусовая бумага; водяные бани, обратные холодильники к пробиркам, пробирки.
Порядок проведения опыта:
В две пробирки приливают по 1 мл бензола и по 1 мл раствора брома в тетрахлориде углерода. В одну из пробирок добавляют немного железных опилок (на кончике шпателя). Пробирки закрывают пробками с воздушными холодильниками и нагревают на теплой водяной бане. Через некоторое время в пробирке с железными опилками происходит обесцвечивание реакционной смеси. Синяя лакмусовая бумажка, смоченная водой и поднесенная к свободным концам стеклянных трубок, подтверждает, что реакция идет только в пробирке с железными опилками (происходит изменение цвета индикатора от паров выделяющегося бромводорода):
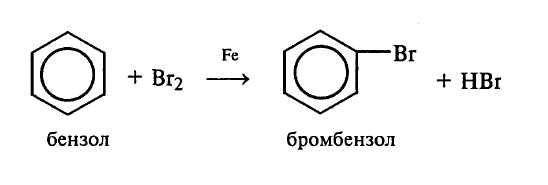
Через 5–10 мин после начала реакции в реакционную смесь опускают полоску фильтровальной бумаги, которую затем подсушивают на воздухе. На бумаге остается бромбензол, отличающийся по запаху от исходного бензола.
Необходимо помнить, что реакция замещения водорода в бензоле происходит в присутствии активированной частицы галогена. Активирование галогена происходит в присутствии активированной частицы галогена. Активирование галогена осуществляется действием катализаторов (часто кислоты Льюиса). Галогенирование в ядро протекает по механизму электрофильного замещения (SE).
Напишите уравнение реакции образования апротонной кислоты Льюиса (FeBr3) и механизм реакции бромирования бензола. Какие из изомеров дибромбензола могут получиться при дальнейшем бромировании бромбензола?
Опыт 3. Бромирование толуола (тяга)
Реактивы и оборудование:
Толуол, раствор брома в тетрахлориде углерода, железные опилки, синяя лакмусовая бумага; обратные холодильники к пробиркам, водяные бани, пробирки.
Порядок проведения опыта:
Повторяют опыт 2, но вместо бензола в две пробирки вносят по 1 мл толуола. Пробирку, не содержащую железных опилок, нагревают на кипящей водяной бане.
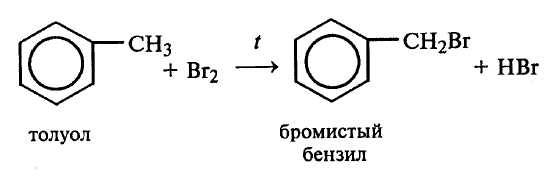
В отличие от предыдущего опыта, реакция идет в обеих пробирках. Бромирование толуола протекает по двум направлениям в зависимости от условий проведения реакций. В отсутствии катализатора (Fe), но при нагревании галоген замещает водород в боковой цепи по радикальному механизму (SR).
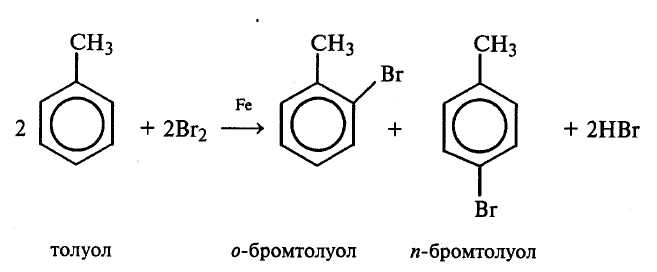
В присутствии катализатора (кислоты Льюиса) идет замещение водорода на бром в ароматическом ядре по ионному механизму (SE), при этом атом галогена вступает в кольцо в орто– или пара–положение по отношению к алкильному радикалу:
Рассмотрите механизмы галогенирования толуола в боковую цепь (SR) и в ароматическое кольцо (SE). Объясните роль катализатора при галогенировании ароматических углеводородов в кольцо. Объясните ориентирующее влияние алкильных радикалов в реакциях электрофильного замещения.
Опыт 4. Нитрование бензола (тяга)
Реактивы и оборудование:
Бензол, концентрированные азотная и серная кислоты; обратные холодильники к пробиркам, водяные бани, стаканы на 50 мл, лед, пробирки.
Порядок проведения опыта:
В пробирку вносят 1 мл концентрированной азотной кислоты (ρ = 1,4 г/см3) и 1,5 мл концентрированной серной кислоты. Нитрующую смесь охлаждают ледяной водой, а затем к ней при встряхивании и охлаждении в несколько приемов прибавляют 1 мл бензола. Пробирку закрывают пробкой с воздушным холодильником и нагревают на водяной бане (50–55°С) 5–10 мин, периодически встряхивая. После окончания реакции содержимое пробирки осторожно выливают в стакан с ледяной водой. Избыток минеральных кислот растворяется в воде, а нитробензол выделяется на дне стакана в виде желтоватых маслянистых капель, пахнущих горьким миндалем.
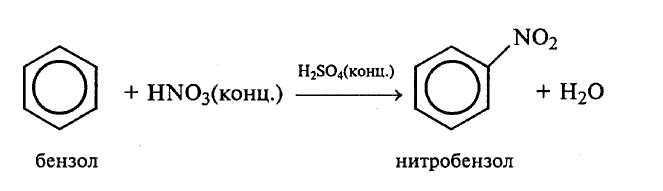
|
 Скачать 1.46 Mb.
Скачать 1.46 Mb.

 СН3–СН=СН2 А Б С
СН3–СН=СН2 А Б С


