Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Опыт 1. Растворимость спиртов в воде, их отношение к индикаторам и горение Реактивы и оборудование: Спирты (этиловый, пропиловый, бутиловый, амиловый или изоамиловый), 1%-ный спиртовой раствор фенолфталеина, синяя и красная лакмусовая бумага; фарфоровые чашки, лучинки, пробирки. Порядок проведения опыта: 1. В 4 пробирки наливают по 2 мл воды и в каждую добавляют по 0,5 мл этилового, пропилового, бутилового и амилового (или изоамилового) спиртов соответственно. Пробирки хорошо встряхивают. Отмечают, что этиловый и пропиловый спирты прекрасно растворяются в воде, бутиловый спирт растворяется плохо, а при растворении амилового спирта образуется эмульсия, которая быстро расслаивается. При этом амиловый (изоамиловый) спирт, подобно маслу, всплывает на поверхность воды. Отсюда возникло название «сивушное масло», под которым понимают смесь высокомолекулярных одноатомных спиртов, в том числе и амилового и изоамилового. Высшие спирты могут образовываться при спиртовом брожении, поэтому при разбавлении водой плохо очищенного от сивушного масла этилового спирта происходит помутнение раствора. Объясните, почему перечисленные спирты по-разному растворяются в воде. 2. На синюю и красную лакмусовые бумажки наносят по одной капле каждого из полученных спиртовых растворов. В каждую из четырех пробирок со спиртовыми растворами вносят по одной капле 1%-ного спиртового раствора фенолфталеина. Ни в одном из случаев не происходит изменения окраски индикатора. Объясните, почему. 3. В три фарфоровые чашки наливают по 1 мл этилового, бутилового и амилового спиртов. Спирты поджигают лучиной и наблюдают характер горения. Высокомолекулярные спирты горят более коптящим и ярким пламенем. Объясните, почему. Напишите уравнения реакций горения указанных спиртов и рассчитайте в них содержание углерода. Опыт 2. Абсолютирование этилового спирта Реактивы и оборудование: Этиловый спирт (ректификат), сульфат меди (II) кристаллический; фарфоровые чашки, щипцы, баня водяная. Порядок проведения опыта: В маленькую фарфоровую чашку помещают примерно 1 г кристаллического сульфата меди (II) и прокаливают его в пламени горелки до исчезновения голубой окраски. В сухую пробирку наливают 2–3 мл этилового спирта–ректификата и вносят в него полученный безводный сульфат меди (II) (белого цвета). Слегка нагревают пробирку в водяной бане и размешивают ее содержимое. Почему изменяется цвет сульфата меди? Полученный абсолютный этиловый спирт переливают в сухую пробирку. Его используют для получения алкоголята натрия (опыт 3). Сколько процентов воды содержится в этиловом спирте-ректификате? Почему воду нельзя удалить перегонкой? Опыт 3. Образование и свойства этилата натрия Реактивы и оборудование: Этиловый спирт (абсолютный), металлический натрий, 1%-ный спиртовой раствор фенолфталеина; прямые газоотводные трубки с оттянутыми концами, пробирки. Порядок проведения опыта: В сухую пробирку наливают 2–3 мл абсолютного этилового спирта и аккуратно вносят кусочек металлического натрия величиной с маленькую горошину. Пробирку закрывают пробкой с прямой газоотводной трубкой. Реакция идет бурно с выделением водорода: 2CH3–CH2–OH + 2Na → 2CH3–CH2–ONa + H2↑ Через минуту после начала реакции поджигают выделяющийся газ у конца газоотводной трубки: 2H2 + O2 → 2H2O Если реакция этанола с натрием сильно замедляется, пробирку можно немного подогреть. Почему для этого опыта нужно брать абсолютный спирт, а не ректификат? Какие свойства спирта (основные или кислотные) проявляются в реакции с металлическим натрием? Почему этанол взаимодействует с натрием более спокойно, чем вода? Осторожно нагревая пробирку, доводят реакцию этанола с натрием до конца. На дне пробирки образуется белый осадок этилата натрия. (В пробирке не должен оставаться металлический натрий!) В пробирку добавляют 1 каплю спиртового раствора фенолфталеина. Изменяется ли окраска индикатора? Добавляют в пробирку 1–2 мл дистиллированной воды и растворяют в ней этилат натрия. Если окраска не появляется, добавляют 1 каплю раствора фенолфталеина. Напишите уравнение реакции этилата натрия с водой. Объясните, почему появляется окраска с фенолфталеином. Опыт 4. Реакции окисления этилового спирта Реактивы и оборудование: Этиловый спирт, хромовая смесь, перманганат калия кристаллический, концентрированная серная кислота; пипетки, пробирки. 1. Окисление спирта хромовой смесью Порядок проведения: В пробирку наливают 1–2 мл хромовой смеси и добавляют по каплям при встряхивании 0,5 мл этилового спирта (Осторожно! Смесь сильно разогревается). Цвет смеси изменяется от оранжево-красного до зеленого. При этом ощущается запах уксусного альдегида, напоминающий запах зеленого яблока (нюхать осторожно). Напишите уравнение реакции окисления хромовой смесью этилового спирта в уксусный альдегид. Подберите коэффициенты. С чем связано изменение окраски хромовой смеси в ходе реакции? Окисление спирта перманганатом калия Порядок проведения: (Тяга!) В сухую пробирку, закрепленную в штативе, аккуратно пипеткой, не смачивая стенок, вносят 2–3 мл концентрированной серной кислоты. По стенке пробирки другой пипеткой приливают 2–3 мл этилового спирта таким образом, чтобы получилось два слоя. Затем насыпают 0,5–1 г перманганата калия, который будет размещаться на границе раздела двух слоев. Через 1–2 мин начинает протекать реакция, сопровождающаяся появлением ярких вспышек, ощущается запах уксусного альдегида. Напишите уравнение реакции окисления этилового спирта в уксусный альдегид перманганатом калия. Подберите к нему коэффициенты. Опыт 5. Получение и свойства этилсерной кислоты(сложного эфира этилового спирта и серной кислоты) Реактивы и оборудование: Этиловый спирт, концентрированная серная кислота, борная кислота, карбонат бария, лакмусовая бумага; стаканы на 50 мл, прямые газоотводные трубки с оттянутыми концами, водяная баня, кипятильники, пробирки. 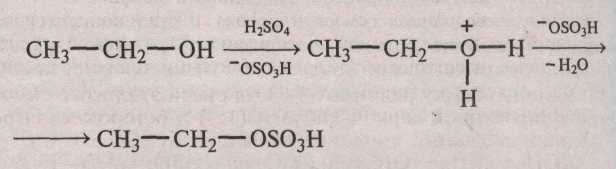 В пробирку наливают 1 мл этилового спирта, затем осторожно по каплям при встряхивании добавляют 1 мл концентрированной серной кислоты. Полученную смесь нагревают 2–3 мин на водяной бане, а затем охлаждают. Полученный раствор выливают в стакан с 25 мл дистиллированной воды и нейтрализуют его сухим карбонатом бария, который добавляют маленькими порциями при активном перемешивании стеклянной палочкой. Наблюдают сильное вспенивание реакционной смеси в результате выделения оксида углерода (IV). После окончания выделения углекислого газа реакция среды должна быть нейтральной (по лакмусу). 2СН3–СН2–ОSO3H + BaCO3 → (CH3–CH2–OSO3)2Ba + CO2↑ + H2O Напишите механизм реакции образования этилсерной кислоты при взаимодействии этилового спирта и концентрированной серной кислоты (SN2). Составьте сокращенное ионное уравнение реакции нейтрализации этилсерной кислоты карбонатом бария. Опыт 6. Получение простого диэтилового эфира Реактивы и оборудование: Смесь этилового спирта и концентрированной серной кислоты в объемном соотношении 1:1, этиловый спирт; пипетки, прямые газоотводные трубки с оттянутыми концами, пробирки. Порядок проведения опыта: В сухую пробирку наливают 2–3 мл смеси этилового спирта и концентрированной серной кислоты (1:1) и осторожно нагревают до начинающегося кипения. Затем горелку убирают и к горячей смеси по стенке пробирки добавляют пипеткой 5–10 капель этилового спирта. CH3–CH2–OH + H2SO4 → CH3–CH2–OSO3H + H2O этилсерная кислота t°C CH3–CH2–OSO3 + CH3–CH2–OH → CH3–CH2–O–CH2–CH3 + H2SO4 диэтиловый эфир Образование диэтилового эфира обнаруживают по запаху. Потом пробирку закрывают пробкой с прямой газоотводной трубкой с оттянутым концом, осторожно ее нагревают и поджигают выделяющийся эфир. Напишите механизмы реакций образования этилсерной кислоты и диэтилового эфира (SN2). Почему, в отличие от этилового спирта, диэтиловый эфир горит светящимся пламенем? Напишите уравнения реакций горения этилового спирта и диэтилового эфира и рассчитайте массовую долю (%) углерода в данных соединениях. Опыт 7. Получение глицерата и гликолята меди Реактивы и оборудование: Глицерин, этиленгликоль, 2%-ный раствор сульфата меди (II), 10%-ный раствор гидроксида натрия; пробирки. Порядок проведения опыта: В пробирку наливают 3–4 капли 2%-ного раствора сульфата меди и 2–3 мл 10%-ного раствора гидроксида натрия: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 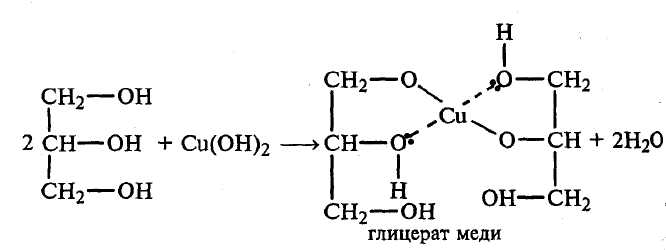 К образовавшемуся осадку голубого цвета добавляют несколько капель глицерина. После перемешивания осадок растворяется и появляется васильково-синее окрашивание вследствие образования комплексного соединения — глицерата меди: Опыт повторяют с этиленгликолем. Напишите уравнение реакции образования гликолята меди. Какие свойства глицерина и этиленгликоля проявляются в опытах с гидроксидом меди (II)? ЗАДАЧИ И УПРАЖНЕНИЯ 1. Укажите общую формулу гомологического ряда предельных одноатомных спиртов. 2. Приведите структурные формулы изомерных спиртов состава С4Н9ОН. Отметьте среди них первичные, вторичные и третичные спирты. Назовите их по систематической литературе. 3. Каковы структурные формулы следующих спиртов: 1) изоамилового спирта, 2) аллилового спирта, 3) трет-бутилового спирта, 4) изопропилового спирта, 5) 2-метилгексанола-3, 6) бутандиола-1,3, 7) глицерина, 8) этиленгликоля, 9) пентен-3-ола-2. 4. Какие спирты образуются при действии водного раствора щелочи на следующие галогенпроизводные: 1) изопропилиодид; 2) изобутилбромид; 3) 3-метилбутанхлорид-1, 4) 2-метилпентаниодид-3, 5) бутандихлорид-1,4. Напишите уравнения реакций. 5. Как получить следующие спирты, используя реакцию гидратации соответствующих олефинов (алкенов): 1) трет-бутиловый, 2) втор-бутиловый, 3) 2-метилбутанол-2, 4) пентанол-2? 6. Какие спирты получаются при гидратации в кислой среде: 1) изобутилена, 2) 2-метилпентена-1, 3) пропилена, 4) 2-метилбутена-2? 7. Напишите соответствующие реакции получения метилового и этилового спиртов в промышленности. 8. Напишите уравнения реакции получения из соответствующих галогенпроизводных следующих спиртов: 1) первичного амилового, 2) изобутилового, 3) 2-метилбутанола-2, 4) бутандиола-1,3. 9. Составьте уравнения реакции получения: а) 3-метилбутанола из 3-метилбутена; б) пропандиола-1,2 из пропилена; в) 2-метилбутанола-1 из 2-метилбутанола-2. 10. Сравните физические свойства этилового спирта и диметилового эфира. Чем обусловлена хорошая растворимость в воде первых членов гомологического ряда спиртов? 11. Что такое водородная связь. Изобразите водородные связи для метилового спирта. 12. Сравните кислотные свойства следующих спиртов: а) пропанол-1 и пропанол-2; б) пропанол-1 и 2-хлорпропанол; в) 2-хлорбутанол-1, 3-хлорбутанол-1, 4-хлорбутанол-1; г) 2-фторбутанол-1, 2-хлорбутанол-1 и 4-хлорбутанол-1; д) 4-хлорбутанол-1, и 4,4-дихлорбутанол-1. 13. Напишите уравнения реакции взаимодействия пропилового спирта: 1) с металлическим натрием, 2) с магнием, 3) с бромоводородом. Охарактеризуйте основные и кислотные свойства спирта. 14. Напишите уравнения реакций межмолекулярной дегидратации следующих смесей спиртов: а) метанола и пропанола-1; б) 2,2-диметилпентанола-3 и этанола. 15. Напишите формулы спиртов, при внутримолекулярной дегидратации которых образуются следующие алкены: а) 2,3-диметилбутен-2; б) 2,4-диметил-3-этилгексен-1. 16. Спирты (кроме метилового) при пропускании их паров над оксидом алюминия (при 375°С) подвергаются дегидратации, образуя олефины (алкены). Напишите уравнения реакции дегидратации следующих спиртов: изоамилового, 3-метилбутанола-2. 17. При пропускании паров спирта над нагретым катализатором (медью или серебром) происходит дегидрирование. Напишите уравнения реакций дегидрирования метилового и изопропилового спирта. 18. Осуществите превращения: а) метан → этилат натрия → метан; б) циклогексан → диизопропиловый эфир; в) карбид кальция → бутанол-1  бутанол-2 бутанол-219. Напишите уравнения реакций получения этиленгликоля из этилена несколькими способами. Какие вещества могут образоваться при окислении этиленгликоля? 20. Составьте схему получения глицерина из пропилена. Какое соединение получается при дегидратации глицерина? 21. Приведите схемы получения: 1) динитрата этиленгликоля, 2) тринитрата глицерина. Какое практическое значение имеет тринитрат глицерина? 22. Из пропилена получите диизопропиловый эфир. Укажите области его применения. 22. Как можно установить присутствие перекисных соединений в простых эфирах? Почему перегонку простых эфиров нельзя вести досуха? 23. Напишите схему образования соединения формула которого НОСН2–СН2–О–СН2–СН2ОН. Назовите его. 24. Установите строение вещества состава С7Н16О, не реагирующего с металлическим натрием при обыкновенной температуре. При нагревании с иодистоводородной кислотой оно образует С2Н5I и С5Н11I, после обработки влажным оксидом серебра С5Н11I превращается в изопентиловый эфир. Похвально совершать то, что подобает, а не то, что можно. Луций Аней Сенека (4 г. до.н.э — 65 г. н.э.) — древнеримский государственный деятель, философ, драматург 3.3. Альдегиды и кетоны. Продолжительность работы — Строение карбонильной группы. Изомерия и номенклатура альдегидов и кетонов. Способы получения. Химические свойства. Реакции нуклеофильного присоединения. Реакции замещения и окисления. Функциональные производные оксосоединений: ацетали, оксимы, гидразоны, азины. Альдольная и кротоновая конденсации. Непредельные альдегиды и кетоны. ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ Муравьиный альдегид (формальдегид) — бесцветный газ с резким специфическим запахом, t.кип. –21°С. Он ядовит, действует раздражающе на слизистые оболочки глаз и дыхательных путей. Хорошо растворим в воде, 40%-ный водный раствор формальдегида называется формалином. В промышленности формальдегид получают двумя методами — неполным окислением метана и его некоторых гомологов и каталитическим окислением и дегидрированием метанола (при 650–700°С над серебряным катализатором): СН3ОН → Н2 + Н2СО Благодаря отсутствию алкильного радикала формальдегиду присущи некоторые особые свойства. При легком нагревании формальдегида (формалина) с аммиаком получается гексаметилентетрамин (уротропин), синтезированный впервые А.М. Бутлеровым: 6Н2С=О + 4NН3 —→ 6H2O + (CH2)6N4 Уротропин в больших количествах применяют в производстве фенолформальдегидных смол, взрывчатых веществ (гексогена, получаемого нитрованием уротропина), в медицине (в качестве мочегонного средства, как составная часть антигриппозного препарата кальцекса, при лечении почечных заболеваний и др.). В присутствии щелочей формальдегид может конденсироваться со многими альдегидами, образуя многоатомные спирты. Так, конденсацией формальдегида с уксусным альдегидом получают четырехатомный спирт — пентаэритрит С(СН2ОН)4: СН3СНО + 3Н2СО ————–→ (НОСН2)3ССНО альдолизация ОН— (НОСН2)3ССНО + Н2СО3 ———–→ (НОСН2)4 + НСОО– Пентаэритрит используется для получения смол и весьма сильного взрывчатого вещества — тетранитропентаэритрита (ТЭН) С(СН2ОNO2)4. Совершенно сухой газообразный формальдегид в присутствии специфических катализаторов (например, карбонила железа) образует высокомолекулярный полиформальдегид с t.пл. 185°С: Н2С=О Н2СО —→ Н2С|–О| ———→ –Н2С–О–СН2–О– ——→ Н2С=О ——→ … –Н2С–О–СН2–О–(–Н2С–О–СН2–О–)n– …. Он не растворим при обычных температурах ни в одном растворителе, обладает высокой прочностью и применяется для изготовления синтетического волокна и разнообразных изделий (труб, листов и т.д.). Полимеры формальдегида, образующиеся в водных растворах, имеют общую формулу НО(СН2—О—СН2—О—)nH, где n колеблется в широких пределах. При n от 8 до 100 этот полимер называется параформальдегидом (параформом). Он выпадает в виде белого осадка при стоянии концентрированных растворов формалина и имеет т.пл. 121°С. При нагревании с разбавленной серной кислотой параформ нацело превращается в газообразный формальдегид, на чем и основано их применение в качестве транспортабельного сырья для получения формальдегида. Спрессованные таблетки и палочки уротропина, а также параформа применяются в качестве горючего (сухой спирт). Формальдегид способен вступать в различные реакции конденсации с образованием синтетических смол, широко применяемых в промышленности. Так, поликонденсацией формальдегида с фенолом получают фенолформальдегидные смолы, с мочевиной — карбамидные смолы. Формалин широко применяется в качестве дезинфицирующего вещества для дезинфекции зерно–и овощехранилищ, парников, теплиц, для протравливания семян и т.д. Уксусный альдегид, ацетальдегид СН3СНО, — жидкость с резким неприятным запахом. t.кип. 21°С. Пары ацетальдегида вызывают раздражение слизистых оболочек, удушье, головную боль. Ацетальдегид хорошо растворим в воде и во многих органических растворителях. Промышленные методы получения ацетальдегида: гидратация ацетилена, дегидрирование этилового спирта, каталитическое окисление воздухом предельных углеводородов. Из ацетальдегида в промышленных масштабах получают уксусную кислоту, уксусный ангидрид, этиловый спирт, альдоль, бутиловый спирт, ацетали, пентаэритрит и ряд других веществ. Подобно формальдегиду, он конденсируется с фенолом, аминами и другими веществами, образуя синтетические смолы, которые используются в производстве различных полимерных материалов. Трихлоруксусный альдегид, хлораль CCl3CHO, получается хлорированием этилового спирта. Хлораль — бесцветная жидкость с резким запахом; обладает снотворным действием. Конденсацией хлораля с хлорбензолом получают в промышленных маштабах инсектициды. При действии на хлораль щелочей образуется хлороформ. Ацетон СН3СОСН3 — бесцветная жидкость с характерным запахом; т.кип. 56,1°С. Хорошо растворим в воде и во многих органических растворителях. Ацетон получают: из изопропилового спирта — окислением или дегидрированием; окислением изопропилбензола, получаемого алкилированием бензола, наряду с фенолом. Ацетон-бутанольным брожением углеводов. Ацетон в качестве растворителя применяется в очень больших количествах в лакокрасочной промышленности, в производствах ацетатного шелка, кинопленки, бездымного пороха (пироксилина), для растворения ацетилена (в баллонах) и т.д. Он служит исходным продуктом при производстве небьющегося органического стекла. |
