Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Опыт 1. Получение метана и его химические свойства Реактивы и оборудование: Смесь для получения метана — безводный ацетат натрия (СН3СООNa) и прокаленная натронная известь (CaO+NaOH); разбавленный раствор перманганата калия (KMnO4); 5%-ный раствор карбоната натрия; бромная вода (насыщенная). Четыре сухие пробирки; изогнутая газоотводные трубки; химический стакан на 50 мл; спиртовка, фарфоровая чашка с пестиком. 1.Получение и горение метана Порядок проведения: В сухую пробирку (на высоту около 1 см) насыпают смесь для получения метана (смесь приготавливают растиранием в фарфоровой ступке 1-й весовой части ацетата натрия с 2-мя весовыми частями натронной извести), размещая ее таким образом, чтобы метан мог свободно выходить из пробирки. Пробирку закрывают пробкой с газоотводной трубкой и закрепляют ее в лапке штатива с небольшим наклоном в сторону пробки (рис. 12.). Перед получением метана в штатив ставят две пробирки: в первую наливают разбавленный раствор перманганата калия и 5%-ный раствор карбоната натрия в соотношении 3:1, во вторую — 3–4 мл насыщенной бромной воды. 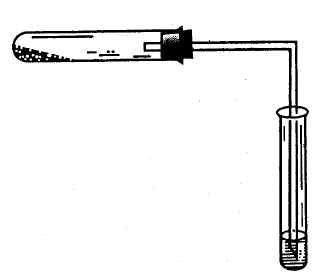 Рис. 12. Прибор для получения метана Равномерно прогревают всю пробирку, а затем сильно нагревают ту ее часть, где находится основная часть смеси. Сначала из пробирки вытесняется воздух, потом начинает выделяться метан, который поджигают у конца газоотводной трубки, он горит несветящимся голубоватым пламенем (иногда оно бывает окрашено в желтый цвет за счет натрия, содержащегося в стекле). При внесении в пламя фарфоровой чашки, то черного пятна от сажи на ней не образуется. Почему? Помещают сухой стакан над пламенем горящего метана вверх дном. Что наблюдаете? Напишите уравнения реакций: 1) получения метана из ацетата натрия и гидроксида натрия5 2) горения метана. 2.Отношение метана к водному раствору перманганата калия и бромной воде Порядок проведения: Газоотводную трубку вводят в пробирку с водным раствором перманганата калия и пропускают метан в течение 1 мин. Затем ту же процедуру повторяют с бромной водой. Происходит ли обесцвечивание растворов? (наблюдения поясните). Опыт 2.Реакции с жидкими предельными углеводородами Реактивы и оборудование: Петролейный эфир (или другие жидкие насыщенные углеводороды); 1%-ный разбавленный раствор перманганата калия; 5%-ный раствор карбоната натрия; концентрированная серная кислота; концентрированная азотная кислота; фарфоровые чашки; три сухие пробирки. Для изучения свойств жидких предельных углеводородов часто используют петролейный эфир, который обычно представляет собой смесь пентана и гексана. Порядок проведения опыта: В три пробирки наливают по 1 мл петролейного эфира. В одну добавляют 1 мл 5%-ного карбоната натрия, а затем по каплям при встряхивании — раствор перманганата калия. Во вторую пробирку вносят 1 мл бромной воды, в третью — 1 мл концентрированной серной кислоты, а в четвертую — 1 мл концентрированной азотной кислоты. Содержимое пробирок тщательно взбалтывают в течение 2–3 мин. Происходят ли какие-нибудь изменения?(наблюдения поясните). В фарфоровую чашку наливают 1 мл петролейного эфира и поджигают его. Объясните, почему в отличие от метана жидкие алканы горят коптящим пламенем? Напишите уравнения реакции горения пентана и гексана и рассчитайте содержание (%) углерода и водорода в метане, пентане и гексане. ЗАДАЧИ И УПРАЖНЕНИЯ 1. Дайте понятие гомологического ряда. Какова общая формула гомологического ряда алканов? 2. Составьте структурную формулу ближайшего гомолога октана, имеющего в молекуле два третичных атома углерода. 3. Какие соединения называют изомерами? Приведите структурные формулы всех изомеров гептана. Укажите число первичных, вторичных, третичных и четвертичных атомов углерода в каждом изомере. 4. Назовите все изомерные углеводороды состава С6Н14 по систематической (IUPAC) номенклатуре. 5. Назовите по систематической номенклатуре следующие углеводороды: 1. Н3С Н3С СН3 СН3—СН—С—С—СН3 Н2С СН3 Н3С СН3 СН3 СН–СН–СН2 СН3 СН2–СН3 СН3 СН3–СН–СН—СН–СН3 СН2 СН3 СН3 4. CН3—СН—СН—СН2—СН3 Н3С СН–СН3 СН3 6. Напишите структурные формулы углеводородов: 1) 2,2,3-триметилбутан, 2) 2,5-диметил-3-этилгексан, 3) 2,2,4-триметил-3-этилпентан, 4) 3-метил-4-изопропилгептан. 7. Какие вещества получатся при сплавлении с натронной известью натриевых солей следующих кислот: а) пропионовой СН3СН2СООН, б) масляной СН3(СН2)2СООН, в) изомасляной (СН3)2СНСООН, г) диэтилуксусной (С2Н5)2СНСООН? Напишите уравнения реакций и назовите полученные соединения. 8. Какова формула карбоновой кислоты, из натриевой соли которой может быть получен изобутан? 9. Сколько пропионата натрия нужно взять для получения 15 л этана (н.у.)? 10. Какие предельные углеводороды можно получить при каталитическом гидрировании следующих углеводородов: а) СН2=СН–СН2–СН3, б) СН3–С≡С–СН3, в) СН3–СН=СН–СН=СН2, г) СН2=С(СН3)–СН3, 11. Как из соответствующих ненасыщенных углеводородов получить изопентан? Какие катализаторы при этом применяются? 12. Какие соединения образуются при нагревании с иодоводородом (в запаянных трубках) следующих веществ: 1) этилиодида, 2) трет-бутилиодида, 3) изопропилиодида, 4) н-пропилового спирта, 5) изопропилового спирта. 13. Какие соединения получаются при действии металлического натрия на смеси следующих алкилгалогенидов: 1) метилиодида и пропилиодида, 2) изопропилиодида и втор-бутилбромида, 3) изоамилбромида и этилхлорида? Назовите полученные соединения по систематической номенклатуре. 14. Как получить из соответствующих алкилгалогенидов по реакции Вюрца: 1) н-гексан, 2) 2,3-диметилбутан, 3) 2,2,5,5,-тетраметилгексан? 15. Сколько монобромпроизводных может образоваться при бромировании следующих углеводородов: 1) пропана, 2) 2,2,3-триметилпентана? Напишите их структурные формулы. 16. Напишите уравнения реакций нитрования по Коновалову следующих углеводородов: а) пропана, б) изобутана, в) 3-метилпентана. Рассмотрите механизм реакции. 17. Какие продукты получаются в результате проведения следующей реакции: С16Н34 + SO2 + Cl2 → Какое практическое значение имеют продукты реакции? 18. Объясните сущность крекинга нефтепродуктов. В каких условиях осуществляется данный процесс? Какие углеводороды могут образоваться при крекинге октана? 19. Напишите уравнения реакций полного сгорания в кислороде метана, пропана, бутана. 20. Какие технически важные продукты можно получить при окислении гексадекана (при 100–160°С) кислородом воздуха? Объясните механизм образования гидроперекиси и дальнейшего его распада. 21. Напишите уравнение реакции каталитического окисления метана. Укажите условия реакции. Есть только одно благо — знание и только одно зло — невежество. Сократ (469–399 гг. до н.э.) — древнегреческий философ 2.1. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ РЯДА ЭТИЛЕНА (АЛКЕНЫ) Продолжительность работы — Гомологический ряд алкенов. Общая формула гомологического ряда. Номенклатура алкенов. Структурная и геометрическая изомерия. Гибридизованное состояние атома углерода sp2. Строение и особенности двойной связи. Способы получения алкенов. Физические и химические свойства. Реакции присоединения. Правило В.В. Марковникова. Механизм реакции электрофильного присоединения на примере бромирования этилена. Окисление алкенов. Полимеризация алкенов. Классификация алкадиенов. Способы получения. Отдельные представители алкадиенов. Эффект сопряжения. 1,2- и 1,4-присоединение. Полимеризация диеновых углеводородов. Каучуки. ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ В промышленных маштабах алкены получают главным образом при крекинге нефти. Низшие алкены можно получать в чистом виде фракционной перегонкой, и поэтому они являются доступным сырьем синтеза большого числа важных алифатических соединений. Высшие алкены, которые нельзя выделить из сложной смеси после крекинга, входят как важные компоненты в состав бензина. Этилен в больших количествах выделяют из газов крекинга и коксования и используют для получения полимеров (полиэтилен, поливинилхлорид), растворителей (спирт, дихлорэтан, эфиры гликолей), антифризов (жидкостей, понижающих температуру замерзания воды), уксусного альдегида и уксусной кислоты. Пропилен также выделяют из промышленных газов и применяют главным образом для получения полипропилена и изопропилового спирта. Из последнего получают ацетон. Исходя из пропилена можно также получить глицерин и фенол. Бутилены с нормальным строением перерабатываются на дивинил (важнейший мономер в производстве синтетического каучука). Изобутилен используют для синтеза изопрена (мономер, используемый в производстве синтетического каучука), высокооктанового топлива (изооктана). Пентены (амилены) с нормальным строением изомеризуются в изоамилены, и последние дегидрируются в изопрен. Один из высших гомологов этилена цис-9-трикозен CH3–(CH2)12–CH=CH–(CH2)7–CH3 — вещество, привлекающее самцов домашней мухи. Он используется для прекращения ее размножения. Такие вещества называются феромонами. Опыт 1. Получения и свойства этилена Реактивы и оборудование: Смесь для получения этилена; бромная вода (насыщенная); 2%-ный раствор перманганата калия; 10%-ный раствор карбоната натрия; 1%-ный раствор перманганата калия; концентрированная серная кислота; прибор для получения этилена; кипятильники (кусочки битого фарфора или кварцевый песок); газоотводные трубки, соединенные с хлоркальциевыми трубками, заполненные кусочками натронной извести; фарфоровая чашка. Порядок проведения опыта: В сухую пробирку наливают 4–5 мл смеси для получения этилена, состоящей из 96%-ного этилового спирта и концентрированной серной кислоты в объемном соотношении 1:2. При смешивании этанола с серной кислотой образуется этилсерная кислота (кислый сложный эфир). Напишите уравнение реакции образования этилсерной кислоты. В реакционную смесь помещают несколько кипятильников (кусочков битого фарфора, кварцевого песка и т.д.) — для равномерного кипения реакционной смеси. Пробирку закрывают пробкой с газоотводной трубкой. В середину газоотводной трубки вставляют хлоркальциевую трубку с натронной известью (рис. 13.). 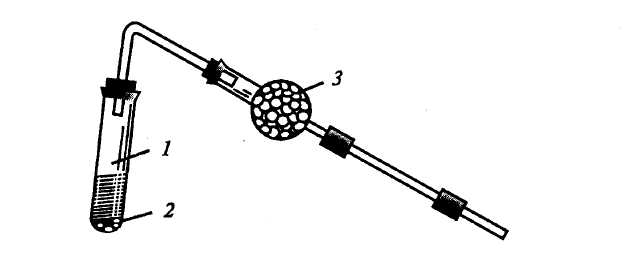 Рис. 13. Прибор для получения этилена: 1 – пробирка со смесью для получения этилена; 2 – кипятильники; 3 – хлоркальциевая трубка с натронной известью Нужно помнить, что гранулированная натронная известь не должна плотно заполнять хлоркальциевую трубку, чтобы выделяющиеся при реакции газы не выбили пробку из пробирки и не произошел выброс реакционной смеси, содержащей концентрированную серную кислоту. Перед получением этилена в штатив ставят три пробирки с реактивами: в первую наливают 3–4 мл бромной воды, во вторую — 2 мл 2%-ного раствора перманганата калия и 0,5 мл 10%-ного раствора карбоната натрия, а в третью — 2 мл 1%-ного раствора перманганата калия и 1 каплю концентрированной серной кислоты. Реакция этилена с бромной водой Порядок проведения: Пробирку с реакционной смесью для получения этилена закрепляют в лапке штатива и осторожно нагревают, следя за тем, чтобы кипящую жидкость не перебросило в хлоркальциевую трубку. При нагревании из этилсерной кислоты образуется этилен: t°C CH3–CH2–OSO3H → CH2=CH2↑ + H2SO4 Выделяющийся этилен пропускают через бромную воду, которая мгновенно обесцвечивается (качественная реакция на кратные связи). Этилен реагирует с бромной водой по электрофильному механизму (АЕ). Рассмотрите его. Кроме основной реакции при получении этилена — сернокислотной дегидратации этилового спирта, протекает несколько побочных реакций. Одна из наиболее важных — окислительно–восстановительная. Концентрированная серная кислота при высокой температуре окисляет органическое вещество (в том числе и этанол) до углерода и оксида углерода (IV) — реакционная смесь чернеет. При этом кислота восстанавливается до оксида серы (IV), который может взаимодействовать с бромной водой (и с перманганатом калия) подобно этилену. Поэтому этилен отделяют от примеси оксида серы (IV). Кислотные оксиды (CO2, SO2) активно поглощаются натронной известью, помещенной в хлоркальциевую трубку. Напишите уравнения реакций взаимодействия оксидов CO2 и SO2 с натронной известью. 2. Взаимодействие этилена с водным раствором перманганата калия (реакция Вагнера) Порядок проведения: Этилен пропускают через 2%-ный раствор перманганата калия, подщелоченный 10%-ным раствором карбоната натрия. Фиолетовая окраска раствора перманганата калия исчезает, образуется хлопьевидный осадок бурого цвета. Если этилен пропускать долго, осадок может раствориться. При окислении этилена в условиях реакции Вагнера образуется двухатомный спирт этиленгликоль НО–СН2–СН2–ОН. Напишите уравнение реакции окисления этилена водным раствором перманганата калия. Реакция Вагнера — качественная реакция на кратные связи. Окисление этилена в кислой среде Порядок проведения: Этилен пропускают через 1%-ный раствор перманганата калия, подкисленный серной кислотой. Наблюдают быстрое обесцвечивание раствора, бурые хлопья при этом не образуются, так как окисление происходит более глубоко. В кислой среде этилен окисляется до щавелевой кислоты НООС–СООН. Напишите уравнение реакции окисления этилена в кислой среде. Горение этилена Порядок проведения: Этилен поджигают у конца газоотводной трубки. Он горит светящимся пламенем. При внесении в пламя фарфоровой чашки на ней образуется черное пятно. Чем можно объяснить его появление? Рассчитайте массовые доли (%) углерода и водорода в молекуле этилена. Напишите уравнение реакции горения этилена. Опыт 2. Свойства жидких алкенов Реактивы и оборудование: Керосин или бензин, 3%-ный раствор брома в тетрахлориде углерода, 2%-ный раствор перманганата калия, 10%-ный раствор карбоната натрия, концентрированная серная кислота; пробирки. Для опытов с жидкими алкенами можно использовать бензин или керосин, так как в их состав входят различные непредельные углеводороды. Порядок проведения опыта: В три пробирки наливают по 1 мл керосина (или бензина). В первую пробирку добавляют несколько капель 3%-ного раствора брома в тетрахлориде углерода. Полученную смесь осторожно нагревают на горячей водяной бане. Наблюдают исчезновение желтой окраски. Чем это можно объяснить? Напишите уравнение реакции присоединения брома к пентену–2 и рассмотрите ее механизм (АЕ). Во вторую пробирку добавляют 1 мл 2%-ного раствора перманганата калия, подщелоченного раствором соды. Что наблюдаете, почему? Напишите уравнение реакции окисления пентена–2 в данных условиях. В третью пробирку приливают 1 мл концентрированной серной кислоты и взбалтывают смесь в течение нескольких минут (Вначале осторожно!). При сильном разогревании смеси пробирку необходимо охладить водой. Наблюдают исчезновение слоя жидких алкенов и появление бурой окраски реакционной смеси. Напишите уравнение реакции образования алкилсерной кислоты и рассмотрите механизм (АЕ) этой реакции (на примере 2 метилпентена–2). Реакцией с концентрированной серной кислотой пользуются для очистки предельных углеводородов от примесей непредельных углеводородов. Опыт 3. Свойства полиэтилена Реактивы и оборудование: Концентрированная серная кислота, полиэтилен (гранулы, кусочки трубки). 1. Отношение к концентрированной серной кислоте Порядок проведения: В пробирку наливают 2 мл концентрированной серной кислоты и помещают кусочек полиэтилена. Через 2–3 мин осторожно вынимают полиэтилен из серной кислоты, промывают водой и убеждаются, что он не изменился. Почему? Отношение к нагреванию Порядок проведения: Кусочек полиэтилена помещают на асбестовую сетку и нагревают до тех пор, пока он не станет мягким. Стеклянной палочкой придают ему какую-нибудь форму и охлаждают. Сохраняет ли полиэтилен в охлажденном виде свою форму? |
