Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Опыт 1. Цветные реакции на карбонильные соединения Реактивы и оборудование: 10%-ный раствор формальдегида, уксусный альдегид, 10%-ный уксусный альдегид, ацетон, фуксинсернистая кислота (заранее приготовленную из фуксина), концентрированная серная кислота, 0,5%-ный раствор резорцина (свежеприготовленный), 0,5%-ный раствор нитропруссида натрия, 1М раствор гидроксида натрия, пипетки, пробирки. 1. Реакция альдегидов с фуксинсернистой кислотой Порядок проведения: В две пробирки наливают по 1 мл прозрачного бесцветного раствора фуксинсернистой кислоты. В первую пробирку добавляют несколько капель 10%-ного раствора формальдегида, а во вторую — такой же объем 10%-ного раствора уксусного альдегида. Через некоторое время в пробирке с формальдегидом развивается фиолетовая окраска, а в пробирке с уксусным альдегидом — фиолетово–розовая. При добавлении к окрашенным растворам по 0,5 мл концентрированной соляной кислоты происходят следующие изменения: окраска в пробирке с формальдегидом переходит в фиолетово–синюю, а в пробирке с уксусным альдегидом через несколько минут она исчезает. Объясните результаты опыта. Что собой представляет фуксинсернистая кислота? Почему при добавлении альдегидов к бесцветной фуксинсернистой кислоте появляется окраска? 2. Реакция альдегидов и кетонов с нитропруссидом натрия Порядок проведения: В две пробирки наливают по 1 мл дистиллированной воды, затем в одну из них добавляют 2–3 капли уксусного альдегида, а во вторую — такой же объем ацетона. К полученным смесям приливают по несколько капель 1М раствора гидроксида натрия. Наблюдают появление красно–фиолетового окрашивания, которое при стоянии переходит в желтое. Необходимо отметить, что при реакции с нитропруссидом натрия более яркое окрашивание дают кетоны. Опыт 2. Некоторые способы получения альдегидов Реактивы и оборудование: Метиловый спирт, этиловый спирт, фуксинсернистая кислота, дихромат калия К2Сг207, концентрированная серная кислота; спирали из медной проволоки, изогнутые газоотводные трубки, стаканы на 100 мл, лед, пробирки. 1. Получение формальдегида и уксусного альдегида окислением спиртов (метилового и этилового соответственно) оксидом меди (II) Порядок проведения: Несколькими каплями метилового спирта смачивают стенки сухой пробирки. В пламени газовой горелки нагревают спираль из медной проволоки до образования на ее поверхности черного налета оксида меди (II). Раскаленную докрасна спираль опускают в заранее подготовленную пробирку со спиртом. Операцию повторяют несколько раз. Метиловый спирт превращается в формальдегид, который имеет резкий запах (нюхать осторожно). Напишите уравнение реакции окисления метилового спирта в формальдегид оксидом меди (II). Для обнаружения формальдегида используют фуксинсернистую кислоту. В пробирку наливают 1 мл раствора фуксинсернистой кислоты и через несколько минут отмечают появление фиолетового окрашивания. Для получения уксусного альдегида опыт повторяют, но вместо метилового спирта стенки пробирки смачивают этанолом. Образовавшийся уксусный альдегид обнаруживают по запаху (пахнет зелеными яблоками) и цветной реакции с фуксинсернистой кислотой. Напишите уравнение реакции окисления этилового спирта в уксусный альдегид оксидом меди (II). 2. Получение уксусного альдегида окислением этилового спирта дихроматом калия Порядок проведения: В сухую пробирку насыпают 0,5 г дихромата калия, приливают 2 мл 10%-ного раствора серной кислоты и постепенно при встряхивании добавляют 2 мл этилового спирта. Смесь разогревается, и происходит изменение ее цвета от оранжево-красного до зеленовато-бурого. Напишите уравнение реакции окисления спирта дихроматом калия в кислой среде и подберите коэффициенты методом электронного баланса. Пробирку закрывают пробкой с изогнутой газоотводной трубкой и закрепляют в лапке штатива. Конец газоотводной трубки опускают в пробирку-приемник с дистиллированной водой. Приемник предварительно помещают в стакан со льдом. Пробирку с реакционной смесью осторожно нагревают на пламени спиртовки и отгоняют летучие продукты в течение 3–4 мин. Наличие уксусного альдегида в пробирке-приемнике определяют по запаху и реакции с фуксинсернистой кислотой. Опыт 3. Реакции окисления альдегидов Реактивы и оборудование: 5%-ный раствор формальдегида, 10%-ный раствор гидроксида натрия, 2%-ный раствор сульфата меди (II), 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака (в капельнице); водяные бани, термометры, пробирки. 1. Окисление формальдегида аммиачным раствором гидроксида серебра (реакция «серебряного зеркала») Порядок проведения: Реакцию «серебряного зеркала» проводят в тщательно вымытой пробирке. Для этого в пробирку наливают 4–5 мл 10%-ного раствора гидроксида натрия и осторожно кипятят несколько минут на пламени спиртовки. В вымытой пробирке готовят аммиачный раствор гидроксида серебра. К 2–3 мл 1%-ногораствора нитрата серебра при встряхивании по каплям прибавляют 5%-ный раствор аммиака до тех пор, пока образующийся вначале осадок полностью не растворится: AgNO3 + NH3 + H2O → AgOH + NH4NO3 2AgOH → Ag2O↓ + H2O Ag2O + 4NH4OH → 2[Ag(NH3)2]OH + 3H2O К прозрачному, бесцветному аммиачному раствору гидроксида серебра прибавляют несколько капель 5%-ного раствора формальдегида. Пробирку несколько минут нагревают на водяной бане при температуре воды 70–80 °С или на спиртовой горелке до начала побурения раствора (до кипения не доводить). Далее реакция идет без нагревания, и металлическое серебро выпадает в виде черного осадка или осаждается на стенках пробирки в виде блестящего серебряного налета («серебряное зеркало»): Н–С|=О + 2[Ag(NH3)2]OH + 3Н2О → H–C|=O + Ag↓ + NH4OH H OH Вступают ли в эту реакцию кетоны? Дайте объяснение. 2. Окисление формальдегида гидроксидом меди (II) Порядок проведения: В пробирку наливают 1 мл 5%-ного раствора формальдегида и 1 мл 10%-ного раствора гидроксида натрия, а затем при встряхивании по каплям добавляют 2%-ный раствор сульфата меди (II) до появления неисчезающей взвеси гидроксида меди (II): CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 Верхнюю часть жидкости нагревают до начинающегося кипения. Наблюдают появление желтого осадка гидроксида меди (I), переходящего затем в красный осадок оксида меди (I): t°C Н–С|=О + 2Cu(OH)2 ↓ → Н–С|=О + 2СuOH + Н2О H голубой цвет OH желтый цвет t°C 2CuOH → Cu2O↓ + Н2О красный цвет Эта реакция, как и реакция серебряного зеркала, является качественной реакцией на альдегиды. Гидроксид меди (II) может восстанавливаться формальдегидом до металлической меди. В этом случае при использовании очень чистой пробирки можно наблюдать образование на ее стенках «медного зеркала». Ацетон и другие кетоны не окисляются мягкими окислителями, в том числе и гидроксидом меди (II). Поэтому при нагревании гидроксид меди (II) дегидратируется с образованием черного осадка оксида меди (II): t°C Cu(OH)2 → CuO + Н2О Опыт 4.Альдольная и кротоновая конденсация уксусного альдегида и его осмоление Реактивы и оборудование: Уксусный альдегид, 10%-ный раствор гидроксида натрия; пробирки. Порядок проведения опыта: В пробирку наливают 3 мл 10%-ного раствора гидроксида натрия и добавляют 5–6 капель уксусного альдегида. Полученную смесь нагревают на спиртовой горелке. Сначала образуется альдоль (приятный запах), а затем непредельный кротоновый альдегид – соединение с резким неприятным запахом (нюхать осторожно). При достаточно длительном нагревании жидкость становится бурой, образуется смола. Альдольная конденсация уксусного альдегида (реакция Бородина): NaOH, t°C СН3–С|=О + СН3–С|=О → CH3–C|H–CH2–C|=O H H OH H альдоль Кротоновая конденсация: t°C CH3–C|H–CH2–C|═O → CH3–CH=CH–C|=O OH H –H2O H кротоновый альдегид Рассмотрите механизмы реакций альдольной и кротоновой конденсации в щелочной среде. Какие продукты получатся при конденсации пропионового и триметилуксусного альдегидов? Опыт 5.Получение ацетона пиролизом ацетата кальция Реактивы и оборудование: Ацетат кальция (безводный); газоотводные трубки, изогнутые под тупым углом, пробирки. Порядок проведения опыта: В сухую пробирку насыпают безводный ацетат кальция (высота слоя 3–4 см) и равномерно распределяют его по нижней ее стенке. Пробирку закрывают пробкой с газоотводной трубкой, изогнутой под тупым углом, и закрепляют в лапке штатива с наклоном в сторону пробки (см. прибор для получения метана). Конец газоотводной трубки опускают в пробирку-приемник, содержащую 1,5–2 мл дистиллированной воды. Сначала равномерно прогревают всю пробирку с ацетатом кальция, а потом прокаливают ее, начиная со дна. Соль плавится, а затем разлагается с образованием ацетона. Напишите уравнение реакции получения ацетона из ацетата кальция. Пары ацетона отгоняются и растворяются в воде, находящейся в пробирке-приемнике. Через 6–8 мин объем жидкости в приемнике увеличивается вдвое. Ощущается характерный запах ацетона. После прекращения вспенивания в нагреваемой пробирке на ее дне остается карбонат кальция, который можно обнаружить после охлаждения пробирки реакцией с 10%-ной соляной кислотой. Ацетон в пробирке–приемнике можно обнаружить реакцией с нитропруссидом натрия. Опыт 6. Открытие ацетона пробой Легаля Реактивы и оборудование: Ацетон, 10%-ный раствор NaOH, свежеприготовленный 10%-ный раствор нитропруссида натрия, ледяная уксусная кислота. Порядок проведения опыта: К 10 мл воды прибавляют 5–6 капель свежеприготовленного 10%-ного раствора нитропруссида натрия, 2–3 капли ацетона и 3–4 капли 10%-ного раствора гидроксида натрия. Появляется темно–красное окрашивание, переходящее в оранжевое. При добавлении по каплям ледяной уксусной кислоты раствор становится вишнево–красным. Пробой Легаля пользуются для клинического обнаружения ацетона в моче. Опыт 7. Реакция ацетона с гидросульфитом натрия (реакция нуклеофильного присоединения) Реактивы и оборудование: Насыщенный раствор гидросульфита натрия NaHSO3, ацетон, 10%-ная соляная кислота, 10%-ный раствор карбоната натрия; стаканы на 50–100 мл, лед, пробирки. Порядок проведения опыта: 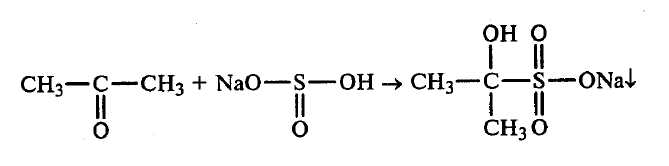 В пробирку наливают 3 мл насыщенного раствора гидросульфита натрия и добавляют при энергичном встряхивании 2 мл ацетона. Разогревшуюся реакционную смесь охлаждают в стакане со льдом. Через некоторое время в пробирке выпадает кристаллический осадок гидросульфитного производного ацетона: Если осадок не появляется, то кристаллизацию вызывают потиранием стеклянной палочкой о стенку пробирки. Необходимо отметить, что в эту реакцию вступают альдегиды и только те кетоны, которые имеют метильную группу, непосредственно связанную с карбонильной группой. Напишите механизм реакции образования гидросульфитного производного ацетона и формальдегида (AN). Эту реакцию применяют для очистки альдегидов и кетонов и для выделения их из трудно разделяемых смесей. Отфильтрованное от растворимых примесей гидросульфитное производное легко гидролизуется под действием разбавленной соляной кислота или раствора соды. Отфильтрованные кристаллы гидросульфитного производного переносят в две пробирки. В одну пробирку приливают 1 мл 10%-ной соляной кислоты, во вторую — 1 мл 10%-ного раствора карбоната натрия. Пробирки слегка нагревают и отмечают запах выделяющихся паров (нюхать осторожно). Напишите уравнения реакций гидролиза гидросульфитного производного ацетона в кислой и щелочной среде. ЗАДАЧИ И УПРАЖНЕНИЯ: 1. Какова общая формула гомологического ряда насыщенных альдегидов и кетонов? 2. Напишите структурные формулы изомерных соединений состава C4H8O. Назовите их. 3. В эфирных маслах цитрусовых содержится душистое вещество цитраль, имеющее структурную формулу: О СН3–|С=СН–СН2–|С=СН–С СН3 СН3 Н Назовите его по систематической литературе и укажите число возможных геометрических изомеров. 4. Какие карбонильные соединения получатся в результате окисления или каталитического дегидрирования: а) бутанола-1, б) бутанола-2, в) изоамилового спирта, г) 2,4-диметилпентанола-3, д) пентадиола-2,4? 5. Дегидриванием каких спиртов можно получить: а) 3-метилбутаналь, б) 3-метилбутанон-2, в) метил-трет-бутил-кетон? 6. С помощью каких реакций можно осуществить следующие превращения: а) СН3–|СН–СН2–СНCl2 → СН3–|СН–СО–СН3 СН3 СН3 б) СН3–|СН–СН2–СН2–СН2ОН → СН3–|СН–СН2–СО–СН3 СН3 СН3 6. Напишите реакции гидролиза следующих дигалогенпроизводных: а) 3-метилпентандибромид-1,1; б) 2-метилпентандибромид-3,3. 7. Из каких кислот пропусканием их паров над нагретым катализатором (MnO, ThO2) можно получить: а) диэтилкетон, б) пропионовый альдегид, в) циклопентанон?. Напишите уравнения реакций. 8. Какие альдегиды можно получить из пропилена реакцией оксосинтеза? Укажите условия реакций. 9. Получите пентанон-3: а) окислением спирта, б) гидролизом дигалогенпроизводного, в) гидратацией ацетиленового углеводорода. 10. Предложите схемы получения ацетона из следующих исходных веществ: а) этилового спирта; б) пропилового спирта; в) пропилена. 11. Расположите приведенные ниже карбонильные соединения в ряд по убыванию активности в реакциях с нуклеофильными реагентами: а) Н–СНО б) СН3–СНО в) СН3–СО–СН3 12. Напишите для 3-метилпентаналя и ацетона реакции с хлоридом фосфора (V), хлором, водородом, синильной кислотой, аммиаком, бисульфитом натрия. Приведите механизм реакции 3-метилпентаналя с HCN. 13. Какие соединения получаются при взаимодействии: а) этилового спирта и уксусного альдегида, б) метилового спирта и ацетона? 14. Рассмотрите механизм альдольной конденсации на примере пропионового альдегида. 15. Напишите уравнения реакций конденсации уксусного альдегида с ацетоном и последующей дегидратации полученного соединения. 16. Напишите уравнения реакций полимеризации формальдегида с образованием линейных и циклических продуктов. 17. При помощи каких реакций можно отличить ацетон от изомерного ему пропионового альдегида? 18. Какие вещества образуются при окислении: а) масляного альдегида, б) изовалерианового альдегида, в) 3-метилпентанона-2? 19. При действии небольших порций серной кислоты (одна–две капли) на уксусный альдегид последний полимеризуется с образованием паральдегида. Разберите схему указанной реакции. 20. Укажите условия реакции полимеризации альдегидов. Приведите схемы реакций полимерных превращений муравьиного альдегида. Что собой представляет «сухой спирт»? 21. Напишите схемы получения указанных соединений из пропионового альдегида: а) н-пропилового спирта; б) пропионовой кислоты; в) α-оксимасляной кислоты; г) втор-бутилового спирта; д) метилэтилкетона; е) 2-метил-3-пентанола. 22. Как из ацетона можно получить следующие соединения: а) диизопропиловый эфир; б) 2,3-диметил-2-бутанол; в) 4-метил-3-пентен-2-он; г) кетен? 23. Определите строение кетона общей формулы С6Н12О, который при окислении дает уксусную, пропионовую и масляную кислоты. 24. Каково строение кетона, имеющего состав С8Н16О, если он при окислении дает ацетон и валериановую кислоту и в меньшем количестве — изомасляную и масляную кислоты? 25. Определите строение соединения состава С5Н10О, представляющего собой жидкость с температурой кипения 101,7°С. Оно взаимодействует с гидроксиламином, с синильной кислотой дает вещество состава С6Н11ОN, с аммиачным раствором оксида серебра зеркала не образует. При окислении исследуемого вещества получаются уксусная и пропионовая кислоты. Знание некоторых принципов легко возмещает незнание некоторых фактов. Клод Адриан Гельвецкий (1715–1771), французский философ 3.4. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ. Продолжительность работы — |
