Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
РАЗДЕЛ II. ЛАБОРАТОРНЫЕ РАБОТЫ ЛАБОРАТОРНАЯ РАБОТА № 1. КАЧЕСТВЕННЫЙ ЭЛЕМЕНТНЫЙ АНАЛИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Продолжительность работы — Качественный элементный анализ позволяет определить, из каких элементов построены молекулы вещества. Наиболее распространенными элементами в органических веществах, кроме углерода и водорода, являются кислород, азот, сера и галогены. Первые четыре элемента получили название органогенов. При выполнении элементного анализа органическое соединение разлагают таким образом, чтобы исследуемые элементы перешли в состав неорганических веществ, которые могут быть изучены обычными методами аналитической химии. Так, при сожжении органического вещества в смеси с порошком оксида меди (II) углерод, входящий в его состав, переходит в оксид углерода (IV), а водород — в воду. СО2 легко обнаруживается при пропускании его через известковую воду — образуется осадок в виде мути. Вода вызывает появление синего окрашивания сульфата меди вследствие образования гидрата CuSO4·5H2O. Для обнаружения азота и серы органическое вещество сплавляют с металлическим натрием. В результате образуются цианид натрия, который обнаруживают по окраске берлинской лазури Fe4[Fe(CN)6]3, и сульфид натрия, который легко определяют в виде сульфида свинца. Присутствие галогенов в органических соединениях можно обнаружить реакцией Бейльштейна — при прокаливании в пламени спиртовки медной проволоки, на которой находится органическое вещество, содержащее галоген, пламя окрашивается в интенсивно зеленый цвет. Опыт 1.Обнаружение углерода пробой на обугливание Реактивы и оборудование: Сахар (или мука, крахмал), бумага, 1%-ный раствор серной кислоты, концентрированная серная кислота, фарфоровые чашки, шпатели, держатели, цилиндры на 50 мл, стеклянные палочки. Самой простой пробой на обнаружение углерода в органическом веществе является его обугливание (почернение) при прокаливании или обугливание под действием водоотнимающих средств, например концентрированной серной кислоты. Порядок проведения опыта: 1. В фарфоровую чашку помещают немного муки, крахмала или сахара (0,1–0,2 г), закрепляют ее в держателе. Осторожно нагревают чашку в пламени спиртовки и прокаливают исследуемое вещество до обугливания. Можно внести несколько крупинок сахара на кончике шпателя непосредственно в пламя спиртовки. После прокаливания сахара остается обуглившаяся масса черного цвета. 2. На белой или фильтровальной бумаге (целлюлозе) при помощи стеклянной палочки делают надпись 1%-ным раствором серной кислоты. После высыхания такая надпись будет невидна. После нагревания бумаги над пламенем спиртовки надпись, сделанная серной кислотой, проявляется в виде черных обугленных полос. 3. В фарфоровой ступке растирают 25 г быстрорастворимого сахара и добавляют 3 мл воды. Образовавшуюся смесь переносят в стеклянный цилиндр вместимостью 50 мл. Затем постепенно, при размешивании стеклянной палочкой, добавляют 12,5 мл концентрированной серной кислоты. Когда начинается обугливание, стеклянную палочку приподнимают. Смесь вспучивается, и черный пористый пирог поднимается по палочке. Опыт 2. Обнаружение углерода и водорода окислением вещества оксидом меди (II) Реактивы и оборудование: Сахар (предварительно просушенный), оксид меди (II) — порошок, известковая (или баритовая) вода — насыщенный раствор гидроксида кальция или бария, безводный сульфат меди (II) — свежепрокаленный; изогнутые газоотводные трубки с пробками для пробирок, вата. При всей своей простоте и убедительности проба на обугливание — это только вспомогательный, ориентировочный прием, она достоверна только при наличии положительного результата, т.е. обугливания. Отсутствие же обугливания не дает права говорить об отсутствии углерода, так как ряд веществ нельзя обугливать обычным путем. Некоторые вещества, например спирты или эфиры, испаряются раньше, чем успевают обуглиться; мочевина и фталевый ангидрид возгоняются3 до обугливания. В таких веществах обнаружить углерод и одновременно с ним водород можно при прокаливании их в присутствии оксида меди (II). Органическое вещество окисляется оксидом меди. При этом углерод превращается в углекислый газ, а водород — в воду. Оксид меди (II) при этом частично восстанавливается до металлической меди: С12Н22О11 + 24CuO → 12CO2↑ + 11H2O↑ + 24Cu Порядок проведения опыта: В сухую пробирку на высоту около 1 см помещают порошок оксида меди (II) (приблизительно 1 г) и 0,1–0,2 г сахарозы. Избыток оксида меди необходим для того, чтобы органическое вещество полностью было окислено. Смесь перемешивают и сверху добавляют дополнительно около 0,5–1 г оксида меди. В верхнюю часть пробирки помещают маленький комочек ваты, на который насыпают немного безводного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой (рис. 11). 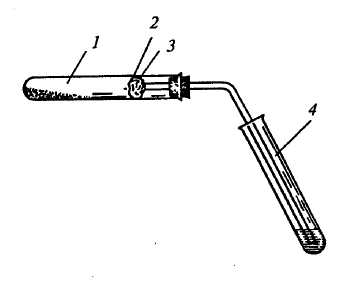 Пробирку закрепляют в лапке штатива с небольшим наклоном в сторону пробки. Свободный конец газоотводной трубки опускают в пробирку с известковой (или баритовой) водой так, чтобы трубка почти касалась поверхности жидкости. Сначала прогревают всю пробирку, а потом сильно нагревают часть пробирки с реакционной смесью. Рис. 11. Прибор для одновременного обнаружения углерода и водорода в органическом веществе: 1 – сухая пробирка со смесью сахарозы и оксида меди (II); 2 – вата; 3 – безводный сульфат меди; 4 – пробирка с известковой водой Отметьте, что происходит с известковой водой. Как и почему изменяется цвет сульфата меди? Напишите уравнения протекающих при этом реакций. Опыт 3. Обнаружение азота сплавлением вещества с металлическим натрием Тяга! Защитные очки! Реактивы и оборудование: Мочевина (или анилин, яичный белок), металлический натрий, 5%-ный раствор сульфата железа (II), 1%-ный раствор хлорида железа (III), 10%-ная соляная кислота, этиловый спирт, лакмусовая бумага; пинцеты, скальпели, фильтровальная бумага, пипетки. Принцип метода состоит в том, что при сплавлении с металлическим натрием органическое вещество разлагается, а содержащийся в нем азот образует с углеродом и натрием цианид натрия. Схематически эту реакцию можно представить следующим образом: сплавление Азотсодержащее + Na —→ NaCN + … органическое вещество Для обнаружения цианида натрия используют реакцию получения берлинской лазури (комплексное соединение с окраской синего цвета). Свое название цианид натрия получил от латинского названия cyanus — синий, т.е. способный давать синюю окраску. Порядок проведения опыта: В сухую пробирку вносят несколько кристаллов мочевины H2N–CO–NH2 и небольшой кусочек металлического натрия (с половину горошины), предварительно очищенного от корки и отжатого в фильтровальной бумаге (т.е. не содержащего остатков керосин), см. «Правила техники безопасности при работе в химической лаборатории». Вместо мочевины можно взять другое органическое вещество, содержащее азот, например анилин, яичный белок и др. Смесь осторожно нагревают в пламени спиртовки (Тяга! Защитные очки!). Через некоторое время происходит вспышка, после чего пробирку нагревают до красного каления еще 1–2 мин. Необходимо отметить, что натрий должен плавиться вместе с мочевиной, иначе не будет образовываться цианид натрия, и опыт окажется неудачным. После охлаждения пробирки на воздухе в нее добавляют 3–5 капель, этилового спирта для удаления остатков металлического натрия (при этом происходит образование алкоголята натрия с выделением водорода): 2С2Н5ОН + 2Na → 2C2H5ONa + H2↑ Убедившись, что остаток натрия прореагировал со спиртом (прекращается шипение и выделение пузырьков газа), в пробирку добавляют 2 мл дистиллированной воды и нагревают ее до полного растворения плава. На этом этапе цианид натрия переходит в раствор, а алкоголят натрия с водой образует щелочь: C2H5ONa + H2O → C2H5OH + NaOH Затем полученный раствор переливают в другую пробирку (при необходимости его фильтруют через складчатый фильтр). Если органическое вещество разложилось частично, то жидкость будет окрашена в бурый или черный цвет. В этом случае плавление исследуемого вещества с металлическим натрием необходимо повторить. К фильтрату добавляют 2–3 капли 5%-ного раствора сульфата железа (II) и каплю 1%-ного раствора хлорида железа (III) и наблюдают выпадение осадков гидроксида железа (II) грязно–зеленого цвета и гидроксида железа (III) бурого цвета. В случае избытка цианида натрия в растворе будет образовываться гексацианоферрат (II) натрия: Fe(OH)2 + 2NaCN → Fe(CN)2 + 2NaOH Fe(CN)2 + 4NaCN → Na4[Fe(CN)6] После перемешивания содержимого пробирки его подкисляют 10%-ной соляной кислотой (несколько капель). Смесь осадков гидроксидов железа (II) и (III) растворяется, и появляется синяя окраска берлинской лазури Fe4[Fe(CN)6]3. Через некоторое время в пробирке выпадает синий оcадок. Берлинская лазурь образуется при взаимодействии гексацианоферрата (II) натрия с ионами трехвалентного железа, которые появляются только в кислой среде. В щелочной среде обычно содержится недиссоциированный гидроксид железа (III), а ионы появляются лишь в кислой среде. Если берлинской лазури образуется очень мало, то раствор окрашивается в зеленый цвет, переходящий в синий при длительном стоянии. Напишите уравнения следующих реакций: Гидроксид железа (III) + соляная кислота → Гексацианоферрат натрия (II) + хлорид железа (III) → Опыт 4. Определение серы сплавлением органического вещества с металлическим натрием Тяга! Защитные очки! Реактивы и оборудование: Тиомочевина (или сульфаниловая кислота, сухой белок), металлический натрий, 2%-ный раствор ацетата свинца, 2%-ный раствор нитропруссида натрия (свежеприготовленный), 10%-ная соляная кислота, уксусная кислота, этиловый спирт, скальпели, пинцеты, пипетки, стеклянные палочки, фильтровальная бумага. Метод основан на том, что при сплавлении металлического натрия с изучаемым органическим веществом происходит его разложение, и выделяющаяся сера образует с натрием соответствующий сульфид. Далее сульфид–ион S2– обнаруживают обычными качественными реакциями. Порядок проведения опыта: В сухую пробирку помещают несколько крупинок тиомочевины (или сульфаниловой кислоты, белого стрептоцида, сухого белка и т.д.) и кусочек металлического натрия с блестящей поверхностью размером с небольшую горошину. Далее проводят сплавление (Тяга! Защитные очки!) так, как было описано в опыте 3 (определение азота). Полученный раствор, содержащий сульфид натрия, разливают в три пробирки. 1. В первую пробирку добавляют несколько капель уксусной кислоты, а затем приливают 0,5 мл 2%-ного раствора ацетата свинца. Образуется черный осадок сульфида свинца. Если образуется черный или бурый коллоидный раствор, то его нагревают, и образование осадка ускоряется. Напишите уравнение реакции сульфида натрия с ацетатом свинца. 2. Во вторую пробирку приливают 0,5 мл 2%-ного раствора нитропруссида натрия Na2[Fe(CN)5NO]. Появляется интенсивное красно–фиолетовое окрашивание раствора, которое постепенно переходит в бурое: Na2S + Na2[Fe(CN)5NO] → Na4[Fe(CN)5NOS] Эта реакция значительно чувствительнее реакции с ацетатом свинца. 3. В третью пробирку с раствором добавляют 10%-ную соляную кислоту, при этом появляется запах сероводорода. Напишите уравнение реакции сульфида натрия с соляной кислотой. Опыт 5. Определение галогенов в органических веществах по Бейльштейну4 Реактивы и оборудование: Хлороформ (или тетрахлорид углерода), дистиллированная вода, соляная кислота, медная проволока с петлей на конце, вставленная другим концом в корковую пробку. При прокаливании галогенсодержащего органического вещества с оксидом меди (II) происходит его окисление, причем галогены (кроме фтора) образуют с медью летучие галогениды, окрашивающие пламя в ярко–зеленый цвет. Порядок проведения опыта: Медную проволоку диаметром 1–2 мм с маленькой петлей на конце прокаливают в пламени спиртовки до исчезновения посторонней окраски пламени и образования на поверхности черного налета оксида меди (II). Остывшую петлю смачивают хлороформом или тетрахлоридом углерода, и снова вносят в пламя спиртовки. Сначала пламя становится светящимся (сгорает углерод), а затем появляется интенсивно зеленое окрашивание, вследствие образования летучих галогенидов меди. Напишите уравнение реакции окисления хлороформа оксидом меди (II), имея в виду, что образуются хлориды меди (I) и (II). Для очистки проволоку смачивают соляной кислотой и прокаливают. Считай несчастным тот день или тот час, в который не усвоил ничего нового и ничего не прибавил к своему образованию. Ян Амос Каменский ЛАБОРАТОРНАЯ РАБОТА № 2. УГЛЕВОДОРОДЫ АЛИФАТИЧЕСКОГО РЯДА 2.1. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ (АЛКАНЫ) Продолжительность работы — Гомологический ряд алканов. Общая формула гомологического ряда. Номенклатура алканов. Структурная изомерия. Гибридизованное состояние атома углерода sp3. Способы получения алканов. Физические и химические свойства. Реакции замещения: галогенирование, сульфохлорирование и сульфоокисление, нитрование. Механизм реакции радикального замещения на примере хлорирования метана. Окисление алканов. Крегинг алканов. ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ Основными источниками алканов служит нефть и сопутствующий ей природный газ. Природный газ в основном состоит из метана и значительно меньших количеств этана, пропана и бутана. Пропан–бутановую фракцию отделяют от более летучих компонентов сжижением и под давлением помещают в баллоны; баллоны с газом применяются в быту. Фракционной перегонкой нефти получают различные фракции (табл. 1); поскольку температура кипения зависит от молекулярного веса, перегонка приводит к грубому разделению алканов в зависимости от числа атомов углерода. Каждая фракция представляет собой очень сложную смесь алканов с различным числом атомов углерода, и каждый алкан представлен несколькими изомерами. Использование каждой фракции зависит главным образом от ее летучести или вязкости и очень мало от того, является ли она сложной смесью или чистым соединением. Все нелетучие фракции используют в основном как топливо. Газовая фракция, как и природный газ, применяется в основном так же, как топливо. Бензин используется в двигателях внутреннего сгорания, работающих на летучем топливе, керосин — в тракторах и форсунках реактивных двигателей, а соляровое масло — в дизелях. Для двигателей внутреннего сгорания требуется топливо с высоким «октановым» числом. В процессе химической подготовки паровоздушной смеси (топлива и воздуха) в двигателе внутреннего сгорания накапливаются взрывчатые пероксиды, которые могут детонировать раньше, чем наступит необходимый момент для воспламенения смеси, т.е. раньше, чем поршень двигателя дойдет до нужного положения. Это вызывает порчу мотора (двигатель «стучит»). Необходимое для повышения мощности двигателя увеличение степени сжатия паровоздушной смеси в цилиндре усиливает детонацию. Поэтому от моторного топлива требуется, чтобы оно было максимально устойчиво к детонации. Наиболее легко детонируют углеводороды с нормальным строением. Для того, чтобы сравнить способность к детонации различных горючих материалов, построили специальную шкалу. За нуль в этой шкале принят н-гептан, за 100 – изооктан. Если исследуемое топливо детонирует так же, как смесь 76% изооктана и 24% н-гептана, то топливу присваивают октановое число 76. В настоящее время в качестве топлива для легковых автомобилей используется бензин с октановыми числами 72, 76, 93, 95. Таблица 1 Состав нефти
Фракция смазочных масел содержит большие количества алканов с длинной цепью (С20–С34), которые имеют довольно высокие температуры плавления. Если они остаются в масле, то при холодной погоде они могут кристаллизоваться с образованием воскообразных твердых веществ. Чтобы предотвратить это, масло охлаждают и воск отделяют фильтрованием. После отчистки получают твердый парафин (t. пл. 50–55°С), который можно использовать для получения вазелина. Асфальт используют при строительстве крыш и дорог. Нефтяной кокс находит применение как топливо, а также в производстве угольных электродов для электрохимической промышленности. Петролейный эфир и лигроин являются хорошими растворителями для многих малополярных органических соединений. Кроме того, некоторые петролейные фракции используют для синтеза других соединений. |
