Лабораторный практикум. Издательство бгту
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Напишите уравнение реакции получения этилхлорида с указанием промежуточных стадий. Опыт 2. Щелочной гидролиз алкилгалогенидов (реакции нуклеофильного замещения) Реактивы и оборудование: Этилбромид, этилиодид, трет-бугилбромид, трет-бутилиодид (или другие алкилгалогениды), 10%-ный раствор гидроксида натрия, 1%-ный раствор нитрата серебра, 20%-ный раствор азотной кислоты; пипетки, обратные холодильники к пробиркам, пробирки. Обычно для данного опыта используют несколько алкилгалогенидов с различной подвижностью галогена. Порядок проведения опыта: В несколько пробирок наливают по 0,5 мл исследуемых алкилгалогенидов и каждый из них 2–3 раза промывают дистиллированной водой. Для этого в каждую пробирку добавляют по 3 мл воды, смесь интенсивно встряхивают и после расслоения большую часть воды сливают. После промывания к алкилгалогенидам приливают по 2 мл 10%-ного раствора гидроксида натрия, пробирки закрывают пробками с обратными холодильниками, содержимое пробирок интенсивно встряхивают. Очень осторожно при встряхивании смесь нагревают, не доводя до интенсивного кипения, так как алкилгалогенид может испариться: t°C R–Hal + NaOH → R–OH + NaHal После охлаждения по 1 мл щелочного раствора переливают в другие пробирки. Гидролизаты подкисляют 20%-ным раствором азотной кислоты и добавляют несколько капель 1%-ного раствора нитрата серебра: NaHal + AgNO3 → AgHal↓ + NaNO3 Количество образующегося осадка AgHal зависит от подвижности галогена в используемых алкилгалогенидах. Напишите уравнения реакций щелочного гидролиза взятых для опыта алкилгалогенидов и рассмотрите их механизмы (SN2 и SN1). По какому механизму вступают в реакцию первичные, вторичные и третичные алкилгалогениды? Зависит ли скорость реакции замещения галогена в алкилгалогенидах от природы галогена? Дайте объяснение. Опыт 3. Свойства хлороформа Реактивы и оборудование: Хлороформ, 10%-ный раствор гидроксида натрия, раствор иода в иодиде калия, 1%-ный раствор нитрата серебра, 10%-ный раствор аммиака, 20%-ный раствор азотной кислоты, 10%-ый раствор резорцина; обратные холодильники к пробиркам, стаканы на 100 мл, лед, пробирки. Порядок проведения опыта: 1. В пробирку наливают 1 мл хлороформа и 1 мл воды. Закрывают пробирку пробкой и интенсивно встряхивают. Через некоторое время образуются два слоя, так как хлороформ практически нерастворим в воде. 2. В пробирку наливают 1 мл хлороформа и добавляют несколько капель раствора йода в иодиде калия. Смесь интенсивно встряхивают. Через некоторое время нижний слой приобретает розовую окраску. Хлороформ хорошо растворяет йод, при встряхивании йод переходит из водного слоя в хлороформ, окрашивая его в розовый цвет. 3. Щелочной гидролиз хлороформа. В пробирку наливают 1 мл хлороформа и 3 мл 10%-ного раствора гидроксида натрия. Пробирку закрывают пробкой с обратным холодильником. Смесь очень осторожно при встряхивании нагревают на пламени спиртовки до кипения, а затем охлаждают в ледяной бане. В условиях опыта хлороформ гидролизуется с образованием хлора и муравьиной кислоты (в щелочной среде получается натриевая соль муравьиной кислоты — формиат натрия HCOONa). Для обнаружения ионов хлора отливают в другую пробирку 1/3 гидролизата, подкисляют его 20%-ным раствором азотной кислоты добавляют несколько капель 1-ного раствора нитрата серебра. Наблюдают выпадение белого творожистого осадка хлорида серебра. Напишите уравнения реакции гидролиза хлороформа в щелочной среде и взаимодействия хлора с нитратом серебра. Муравьиная кислота легко окисляется, так как содержит в молекуле альдегидную группу. Это свойство лежит в основе методов обнаружения ее в растворе. К оставшейся части гидролизата хлороформа приливают свежеприготовленный аммиачный раствор гидроксида серебра. Пробирку нагревают на горячей водяной бане. Через некоторое время наблюдают образование металлического серебра (реакция «серебряного зеркала»). Напишите уравнение реакции окисления муравьиной кислоты аммиачным раствором гидроксида серебра. 4. Цветная реакция на хлороформ. В пробирку наливают 1 мл 10%-ного раствора резорцина и 5 капель 10%-ного раствора гидроксида натрия. В пробирку добавляют 5 капель хлороформа. Смесь нагревают. Появляется окрашивание. Опыт 4. Свойства четыреххлористого углерода Реактивы и оборудование: Четыреххлористый углерод, 10%-ный раствор гидроксида натрия, 1%-ный раствор нитрата серебра, 20%-ный раствор азотной кислоты, этиловый спирт (или другое легковоспламеняющееся вещество), подсолнечное масло (или другой жир); фарфоровая чашка, асбестовая сетка, медная проволока. Четыреххлористый углерод широко используется как растворитель жиров, масел, смол, каучука. Ценным свойством, отличающим его от большинства органических растворителей, является негорючесть. На этом свойстве основано его применение в огнетушителях для тушения пожаров на химических предприятиях, в лабораториях, книгохранилищах и др. Порядок проведения опыта: 1. В пробирку наливают 1 мл CCl4 и добавляют 1 каплю подсолнечного масла или другого жира. Смесь взбалтывают. Результат опыта записывают в журнал. 2. В фарфоровую чашку наливают 2 мл этилового спирта (или другого воспламеняющегося вещества), ставят чашку на асбестовую сетку и поджигают спирт (Осторожно! Тяга!). Гасят «пожар» четыреххлористым углеродом. 3. В пробирку наливают несколько капель CCl4 и 2–3 мл 10%-ного раствора гидроксида натрия, осторожно нагревают смесь 1–2 мин до начинающегося кипения (при взбалтывании реакционной смеси). Затем охлаждают, сливают щелочную жидкость в другую пробирку, подкисляют ее 20%-ным раствором азотной кислоты и добавляют несколько капель 1%-ного раствора нитрата серебра. Сравните результаты этого опыта с результатами, полученными при щелочном гидролизе хлороформа. Сделайте вывод о подвижности хлора в молекуле четыреххлористого углерода. Опыт 5. Термическое разложение поливинилхлорида Реактивы и оборудование: 1%-ный раствор нитрата серебра, лакмусовая бумага, поливинилхлоридная смола — винипласт (изоляция осветительного провода ППВ — провод плоский виниловый, ТРВК — телефон-радиовиниловый кабель, или другой образец), изогнутые газоотводные трубки. Поливинилхлоридные смолы и пластмассы на их основе при нагревании выше 140° разлагаются с выделением хлороводорода. Напишите схему реакции полимеризации винилхлорида (получение поливинилхлорида). Порядок проведения опыта: Помещают кусочек (1–2 см) винилпласта в пробирку с изогнутой газоотводной трубкой, конец которой опущен в другую пробирку с 1,5 мл раствора нитрата серебра. Осторожно нагревают пробирку на пламени спиртовки. Винипласт размягчается, темнеет и разлагается с выделением газообразных продуктов, в том числе хлороводорода. В пробирке с раствором нитрата серебра появляется белый осадок. Почему? Хлороводород можно также обнаружить по покраснению влажной лакмусовой бумаги, поднесенной к отверстию газоотводной трубки. ЗАДАЧИ И УПРАЖНЕНИЯ 1. Напишите уравнения реакций получения всеми возможными способами: 1) бромэтана, 2) 2-иодпропана. 2. Напишите уравнения реакций получения моноиодпроизводных, исходя из следующих непредельных углеводородов: бутена-2, бутена-1, пропилена, 2-метилбутена-2. Поясните механизм реакции присоединения галогеноводорода к непредельным соединениям (правило Марковникова) с точки зрения электронной теории. 3. Напишите уравнения реакций бутана с хлором. Укажите условия реакции. Разберите ее механизм. Какие изменения наблюдаются, если действовать не хлором, а бромом, иодом и фтором? 4. Составьте структурные формулы и назовите монобромпроизводные, которые могут получиться при действии брома на углеводороды: 1) изобутан, 2) пропан, 3) н-пентан. Укажите условия реакций. 5. Составьте схемы реакций получения из соответствующих спиртов: 1) изопропилбромида; 2) бутантрихлорида-1,2,4; 3) пропанхлорида-1. 6. Напишите уравнения взаимодействия хлора с пропиленом при комнатной температуре и при 400°С. Разберите механизмы реакций и назовите продукты взаимодействия указанных реагентов. 7. Приведите схему промышленного получения фторопласта тефлона. Укажите области его применения. 8. Составьте схемы реакций и назовите вещества, образующиеся при действии бромоводорода на следующие вещества: 1) пентадиен-1,4, 2) изопрен, 3) метилацетилен. 9. Напишите формулы всех хлорпроизводных метана. Укажите, какие из этих веществ поляризованы. Приведите объяснения. 10. Сравните реакционную способность CH3–F, CH3–Cl, CH3–Br, CH3–I в условиях реакции гидролиза. 11. Какое из дигалогенопроизводных будет обладать бóльшим дипольным моментом: C2H5–Cl, C2H5–Br, C2H5–I? Какое из этих веществ легче вступает в реакции нуклеофильного замещения (SN)? Приведите объяснения. 12. Какое из соединений будет обладать бóльшим дипольным моментом: CH3–CH2–Cl, CH2=CH–Cl, CH2=CH–CH2–Cl? Для ответа используйте электронные представления (индукционный и мезомерный эффекты). 13. Напишите уравнения реакции гидролиза галогенопроизводных: 1) СH3I, 2) CН2I2, 3) CHCl3. На примере одной из реакций разберите ее механизм. Укажите условия, способствующие протеканию SN2–реакций. 14. Напишите уравнения взаимодействия йодэтана со следующими веществами: цианидом калия, аммиаком, ацетатом натрия, натрием, гидросульфидом натрия, магнием (в присутствии эфира), нитритом серебра, этилатом натрия. 15. Составьте уравнения взаимодействия с водной щелочью галогенпроизводных: 1) изобутилиодида, 2) 2,2-диметилпропанхлорида-1, 3) 2-метилбутанбромида-1. Расположите эти галогенопроизводные в порядке увеличения подвижности галогена в данной реакции. 16. Напишите уравнения реакций трет-бутилбромида со следующими реагентами: 1) гидроксидом натрия (водный раствор), 2) гидроксидом серебра, 3) метиламином, 4) нитритом серебра. На примере одной из реакций разберите ее механизм. Какие факторы способствуют протеканию SN1–реакциям? 17. Для какого из указанных ниже веществ легче пойдет реакция гидролиза по механизму SN1: 1) 2-метилбутанхлорида-1, 3) бутанхлорида-2, 3) бутанхлорида-1, 4) 2-метилбутен-2-хлорида-1? Дайте объяснения. 18. Какие соединения получаются при действии спиртового раствора щелочи на 2,4,4,-триметилпентанбромид-2? По какому механизму идет эта реакция? 19.Дегидрогалогенирование 2-метилбутанбромида-2 приводит к смеси двух этиленовых углеводородов. Напишите уравнения этих реакций. Укажите, олефина какого строения будет больше в реакционной смеси. 20. Напишите уравнение реакций дегидрохлорирования спиртовым раствором щелочи следующих соединений: 1) (CH3)2CCl–CH2–CH2–CH3, 2) CH3–CHCl–CH3, 3) CH2Cl–CH2–CH2–CH3, 4) CH3–CHCl–CH2–CH3. 21. Как осуществить следующие превращения: 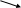 Этандихлорид-1,1 Этандихлорид-1,1  Ацетилен Винилхлорид? Ацетилен Винилхлорид? 22. Тефлон – высокоустойчивый полимер; он получается при полимеризации тетрафторэтилена. Составьте схему этой реакции. 23. Каково строение иодопроизводного, имеющего молекулярную формулу C4H9I, если известно, что при действии водного раствора щелочи получается спирт состава C4H9ОН, который при окислении образуется кетон? … разум есть способность видеть связь общего с частным. Иммануил Кант (1724–1804) — немецкий философ 3.2. СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. Продолжительность работы — Классификация спиртов. Изомерия и номенклатура спиртов. Способы получения. Физические и химические свойства. Высшие жирные спирты (ВЖС). Двух- и трехатомные спирты. Непредельные спирты. Правило А.П. Эльтекова. Простые эфиры. Получение и свойства. Пероксиды. ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ И ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ В промышленном маштабе алкилгалогениды, главным образом хлориды из-за дешевизны хлора, получают чаще всего прямым галогенированием углеводородов при высокой температуре, необходимой для протекания свободнорадикальных реакций, например если бы химику-органику позволили выбрать десять алифатических соединений, с которыми он должен был бы остаться на необитаемом острове, он, конечно, выбрал бы спирты. Из них он мог бы получить многие другие алифатические соединения: алканы, алкилгалогениды, эфиры, альдегиды, кетоны, кислоты, сложные эфиры и многие другие соединения. «Химический» Робинзон Крузо использовал бы спирты не только как исходные соединения, но и как растворители для проведения реакций и для перекристаллизации полученных веществ. Спирты являются не только ценным исходным материалом для синтеза алифатических соединений вследствие многообразия их реакций, но они также доступны в больших количествах по низкой цене. Для получения простых спиртов существуют два принципиальных метода, лежащих в основе синтеза алифатических соединений: гидратация алкенов, полученных при крекинге нефти, и ферментативный гидролиз углеводов. Кроме этих двух основных методов, существуют и некоторые другие, имеющие более ограниченное применение. Этиловый спирт. Этиловый спирт, этанол, не только наиболее старое синтетическое органическое соединение, используемое человеком, но также и одно из наиболее важных соединений. Этиловый спирт широко используется в промышленности в качестве растворителя лаков, красок, в парфюмерии и лаборатории в качестве растворителя для химических реакций и для перекристаллизаций. Кроме того, он служит сырьем для многих синтезов. Для промышленных целей этиловый спирт получают из нефти, сахарного тростника и различных зерновых культур. Этиловый спирт используется также для производства спиртных напитков. Для этих целей его получают ферментативным гидролизом сахара, выделяемого из различных растительных источников. Свойства напитков зависят от сырья, используемого для ферментативного гидролиза (рожь или пшеница, виноград или ягоды бузины, мякоть кактусов и одуванчиков), метода проведения гидролиза (например, улетучивается двуокись углерода или нет) и метода обработки продукта гидролиза (перегоняется спирт или нет). Специфический аромат напитков обусловлен не этиловым спиртом, а другими веществами, имевшимися в исходном сырье (используемом для получения спирта), или специальными добавками. С медицинской точки зрения спирт относится к наркотическим и дезинфицирующим веществам. Поскольку этиловый спирт потребляют в виде различных спиртных напитков и он широко используется в промышленном синтезе, возникает проблема: спирт, используемый в промышленности, должен быть непригоден для питья. Эта проблема решается прибавлением к спирту денатуранта — вещества, которое придает ему неприятный вкус или даже делает его ядовитым. Двумя из восьмидесяти с лишним таких денатурантов являются, например, метиловый спирт и авиационный бензин. 95%-ный этиловый спирт: азеотропная смесь. Почти весь этиловый спирт, за исключением спиртных напитков, используется в виде смеси 95% спирта и 5% воды и называется просто 95%-ным спиртом. Можно получить чистый (абсолютный) спирт, но он значительно дороже и используется только в случае необходимости. Чем же замечательна концентрация 95%? Этиловый спирт сначала получается в виде смеси с водой; затем эту смесь концентрируют фракционной перегонкой. Как при любой перегонке сначала отгоняется более летучее вещество, т.е. имеющее наиболее низкую температуру кипения. В смеси этилового спирта и воды наиболее низкую температуру кипения имеет не вода (tкип. 100°С) и не этиловый спирт (tкип. 78,3°С), а смесь 95% спирта и 5%воды (tкип. 78,15°С). При использовании эффективной ректификационной колонки сначала отгоняется 95%-ный спирт, затем небольшая промежуточная фракция с более низкой концентрацией спирта и после этого отгоняется вода. Но независимо от эффективности ректификационной колонки 95%-ный спирт больше сконцентрировать не удается. Известно, что разделение смеси перегонкой происходит, потому что пар имеет состав иной, чем жидкость, от которой он отгоняется; пар обогащен более летучим компонентом. 95%-ный спирт нельзя разделить на компоненты перегонкой, поскольку в этом случае пар имеет тот же состав, что и жидкость; при перегонке 95%-ный спирт ведет себя так же, как индивидуальное соединение. Жидкие смеси, обладающие особым свойством образовывать пары того же состава, называются азеотропами, или постоянно кипящими смесями. Поскольку 95%-ный спирт состоит из двух компонентов, он называется бинарным азеотропом. Температуры кипения большинства азеотропов, так же как и 95%-ного спирта, ниже температур кипения своих компонентов. Такие азеотропы называются смесями с минимум температуры кипения; азеотропы, температуры кипения которых выше температур кипения их компонентов, называются смесями с максимумом температуры кипения. Абсолютный спирт. Если 95%-ный спирт нельзя больше сконцентрировать перегонкой, то как же получить 100%-ный этиловый спирт, так называемый абсолютный спирт? Его можно получить, используя возможность образования другого трехкомпонентного азеотропа (тройного азеотропа). Смесь 7,5% воды, 18,5% этилового спирта и 74% бензола образует азеотроп с температурой кипения 64,9°С (азеотроп с минимумом температуры кипения). Что же происходит при перегонке смеси, содержащей, например, 150 г 95%-ного спирта (142,5 г спирта и 7,5 г Н2О) и 74 г бензола? Сначала отгоняется тройной азеотроп; 100 г этого азеотропа содержит 7,5 г воды, 18,5 г спирта и 74 бензола. Таким образом полностью удаляется вода и бензол и только часть спирта, после чего остается 124 г чистого безводного спирта. Обычно прибавляют небольшой избыток бензола, который после перегонки тройной смеси удаляется в виде бинарного азеотропа со спиртом (температура кипения 68,3°С). В некоторых случаях необходимо удалить даже следы воды из промышленного абсолютного спирта. Это можно сделать, обработав спирт металлическим магнием; вода превращается в нерастворимый Mg(OH)2, от которого затем спирт отгоняют. |
