бизнес план. Аяулым тема. Изучение молекулярных предикторов сосудистого риска опосредованного эндотелиальной дисфункцией у людей с сахарным диабетом 2 типа
 Скачать 1.19 Mb. Скачать 1.19 Mb.
|
КЛИНИЧЕСКАЯ ДИАГНОСТИКА ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИНа современном этапе наибольшее внимание уделяется таким методам количественной оценки действия инсулина, как ГЭК и математические модели на основе внутривенного (минимальная модель, FSIGTT) и перорального (OSIG) глюкозотолерантного теста или определение глюкозы и инсулина натощак (с вычислением целого ряда индексов, в том числе HOMA, QUICKI, Matsuda и др.). Считается, что использование различных индексов возможно в крупных эпидемиологических исследованиях и мало применимо для индивидуальных измерений [35]. ГЭК признан основным методом диагностики ИР и имеет ряд преимуществ, в частности, возможность оценки чувствительности к инсулину без риска гипогликемии и последующего выброса контринсулярных гормонов, без влияния эндогенного инсулина и колебаний уровня гипергликемии. Помимо этого, ГЭК совместим с инновационными методами исследования метаболизма (непрямая калориметрия, биопсия тканей, позитронно- эмиссионная томография и др.), однако этот метод достаточно трудоемкий и дорогостоящий, что ограничивает его применение в широкой клинической практике [36]. С целью усовершенствования диагностики ИР мы провели детальное сравнение ГЭК и HOMA-ИР. В исследовании участвовали пациенты с впервые выявленным СД2 или предиабетом в сопоставлении с контрольной группой здоровых добровольцев без нарушений углеводного обмена. По данным ГЭК значения М-индекса составили >7,0 мг/кг/мин в группе контроля (пациенты без нарушения углеводного обмена с нормальной чувствительностью к инсулину). В группе впервые выявленного СД2/предиабета М-индекс варьировал от 0–2 мг/кг/мин (2 случая, выраженная ИР) до 2–4 мг/кг/мин (9 случаев, умеренная ИР) и 4–6 мг/кг/мин (4 случая, слабо выраженная ИР). Таким образом, два этих метода оценки ИР дают сходные, но несовпадающие результаты. Они показывают, что ГЭК более точен при количественной оценке ИР. Дополнительные исследования необходимы, чтобы понять, насколько ГЭК пригоден для определения предиабета как состояния, при котором возможна эффективная ремиссия метаболических нарушений в патогенезе СД2. В ходе проведенных исследований на обширной группе пациентов было выявлено, что ИР в общем и липодистрофия в частности могут встречаться при многих эндокринных и аутоиммунных заболеваниях. Так, было обнаружено, что частота нарушений углеводного обмена (предиабета и манифестного сахарного диабета) составляла 55% у пациентов с болезнью Иценко-Кушинга и 38% у пациентов с акромегалией. Болезнь Иценко-Кушинга и акромегалия характеризуются высокой степенью ИР, как минимум в 8 раз превышающей значения для общей популяции. Поскольку наиболее существенными факторами риска развития нарушений углеводного обмена у пациентов с СД вторичного генеза являются ИР и гиперглюкагонемия, то пациентам с данными заболеваниями необходима оценка ИР с помощью ГЭК. Кроме того, впервые были описаны ИР и липодистрофия как проявления аутоиммунного полигландулярного синдрома 1 типа (АПС1) – моногенного аутоиммунного заболевания, развившегося вследствие гомозиготной мутации в гене AIRE с.760>Т p.R257X. Данное наблюдение является первым и на сегодняшний день единственным в мире случаем развития генерализованной липодистрофии у пациента с АПС1 [37]. Данное наблюдение свидетельствует о необходимости проведения теста на наличие ИР у пациентов с аутоиммунными заболеваниями. МОЛЕКУЛЯРНЫЕ МАРКЕРЫ ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИНарушение инсулинового каскада при активации ИР состоит в снижении инсулинзависимого фосфорилирования участников и мишени этого каскада, необходимого для их активации. Логично, что эти показатели могут служить молекулярными маркерами ИР. Для того чтобы проверить эту гипотезу и удостовериться в сходстве таких изменений при ИР различного генеза, мы использовали стандартную модель линейных адипоцитов 3Т3L1. Эти клетки поддерживаются в культуре как предшественники (рис. 1А) и дифференцируются в адипоциты непосредственно перед экспериментом. Зрелые адипоциты (рис. 1Б) отличаются наличием жировых капель, выявляемых специальными красителями, и представляют собой переживающую культуру. В них полностью представлен инсулиновый каскад (рис. 1В), активацию которого последовательно отражают фосфорилирование белка IRS по тирозину Tyr-612, киназы Akt по двум остаткам треонина Thr-308 и серина Ser-473, и белка AS160 (субстрата Akt с массой 160 кДа) по остатку серина Ser-318. Именно последний регулирует выход на поверхность клетки глюкозного транспортера Glut-4. Сайт-специфический анализ фосфорилирования этих белков до и после кратковременной обработки клеток инсулином показывает степень активации этих белков и каскада в целом. 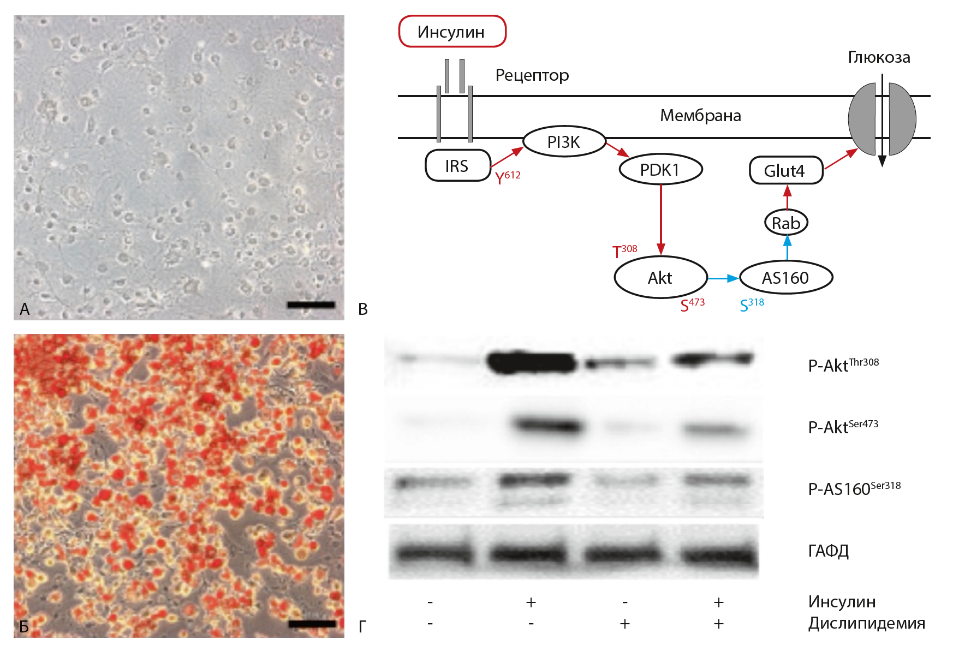 Рис. 1. Определение молекулярных маркеров ИР в линейных адипоцитах 3T3L1. (А) Культура преадипоцитов и (Б) зрелых адипоцитов 3T3L1 с липидными каплями, окрашенными OilRedO. Масштабный отрезок 100 нм. (В) Схема передачи инсулинового сигнала в жировых и мышечных клетках от рецептора до инсулинзависимого транспортера глюкозы Glut4. Красным и синим цветом показаны активирующие и ингибирующие воздействия и фосфорилируемые остатки соответственно. (Г) Способность инсулина стимулировать фосфорилирование компонентов каскада падает в условиях экспериментальной ИР, вызванной дислипидемией (обработкой клеток пальмитиновой кислотой в течение суток). Показаны репрезентативные результаты вестерн-блоттинга лизатов клеток, которые стимулировали или не стимулировали 100 нМ инсулином в течение 20 мин; для контроля нагрузки использовали окраску на глицеральдегидфосфатдегидрогеназу (ГАФД). На рис. 1Г показано, что в зрелых адипоцитах 3Т3L1 инсулин значительно активирует фосфорилирование Akt и AS160, однако в условиях экспериментальной дислипидемии (длительная обработка клеток конъюгатом альбумина с пальмитиновой кислотой) активация снижается. Аналогичное снижение этих показателей наблюдали с другими индукторами ИР, моделируя условия воспаления (обработка клеток липополисахаридом), стресса ЭПР (обработка брефелдином-А) или гипоксии (обработка солями кобальта). Таким образом, независимо от причины, ИР характеризуется сходным снижением инсулинзависимого фосфорилирования Akt и AS160, которые могут служить маркерами ИР. Для валидации этих белков как маркеров ИР у человека был проведен пилотный анализ мышечных биопсий. Он подтвердил, что инсулин стимулирует фосфорилирование Akt по остатку Ser-473 у здоровых доноров. При этом уровень фосфорилирования Ser-473 у больных СД2 был ниже. Мы не обнаружили достоверных различий между пациентами со слабой (М-индекс 4–6), умеренной (2–4) и выраженной (<2) степенью ИР. Эти результаты указывают на Ser-473 в Akt как потенциальный маркер ИР. В лейкоцитах здоровых доноров фосфорилирование Ser-473 в Akt также возрастало при действии инсулина как in vitro (при стимуляции выделенных лейкоцитов инсулином), так и in vivo (в лейкоцитах, выделенных через 4 ч после начала клэмп-теста по сравнению с таковыми, взятыми до начала клэмп-теста). В то же время изменения этого параметра были незначительны у больных СД2, что согласуется с результатами, полученными с использованием мышечных биопсий. Таким образом, уровень фосфорилирования Ser-473 в Akt может маркировать состояние ИР, а лейкоциты периферической крови могут служить удобным объектом, отражая ситуацию в инсулинзависимых тканях. Мы исследовали гипотезу о том, что, независимо от причины возникновения, развитие ИР опосредовано активацией воспалительного каскада и стрессзависимых киназ JNK и IKK как его главных участников. При всех способах экспериментальной индукции ИР в адипоцитах 3Т3L1 наблюдался более высокий уровень фосфорилирования JNK, чем в адипоцитах без ИР. В модели дислипидемии при этом наблюдалось усиление ингибиторного фосфорилирования белка IRS по остатку Ser-302, который считается субстратом JNK (Sun & Liu, 2009). Ингибиторный анализ JNK в резистентных адипоцитах 3Т3L1 показал частичное восстановление инсулинзависимого фосфорилирования Akt и AS160. Эти результаты свидетельствуют о том, что JNK опосредует развитие ИР различного генеза в адипоцитах 3Т3L1, по-видимому, за счет серинового фосфорилирования IRS и нарушения передачи инсулинового сигнала. Таким образом, фосфорилирование и активация JNK также являются потенциальными маркерами ИР наряду с Akt и AS-160. |
