бизнес план. Аяулым тема. Изучение молекулярных предикторов сосудистого риска опосредованного эндотелиальной дисфункцией у людей с сахарным диабетом 2 типа
 Скачать 1.19 Mb. Скачать 1.19 Mb.
|
|
Изучение молекулярных предикторов сосудистого риска опосредованного эндотелиальной дисфункцией у людей с сахарным диабетом 2 типа. 2 типті қант диабетімен ауыратын адамдарда эндотелий дисфункциясы арқылы жүретін қан тамырлары қаупінің молекулалық болжамдарын зерттеу. Роль сахарного диабета в возникновении и развитии эндотелиальной дисфункции https://doi.org/10.14341/probl12212 АННОТАЦИЯ Эндотелий сосудов выполняет множество функций. Он является ключевым регулятором сосудистого гомеостаза, поддерживает баланс между вазодилатацией и вазоконстрикцией, ингибированием и стимулированием миграции и пролиферации клеток гладких мышц, фибринолизом и тромбообразованием, а также участвует в регуляции адгезии и агрегации тромбоцитов. Эндотелиальная дисфункция лежит в основе патогенеза сосудистых осложнений сахарного диабета. Целью настоящего обзора было рассмотрение механизмов, приводящих к возникновению эндотелиальной дисфункции при сахарном диабете. В работе рассматриваются современные литературные данные, касающиеся роли гипергликемии, окислительного стресса, конечных продуктов гликирования в альтерации эндотелия. Отдельный раздел посвящен особенностям функционирования системы антиоксидантов и их значению в развитии эндотелиальной дисфункции при сахарном диабете. Проведенный анализ литературы позволяет заключить, что при сахарном диабете патологическая активация путей утилизации глюкозы вызывает повреждение эндотелиальных клеток, что сопровождается нарушением всех их основных функций. Метаболические нарушения при сахарном диабете вызывают выраженный дисбаланс свободнорадикальных процессов и антиоксидантной защиты, сопровождаемых оксидативным стрессом эндотелиоцитов, который способствует прогрессированию эндотелиальной дисфункции и развитию сосудистых осложнений. Многие аспекты многокомпонентных регуляторных реакций в патогенезе развития эндотелиальной дисфункции при сахарном диабете до настоящего времени изучены недостаточно. КЛЮЧЕВЫЕ СЛОВА сахарный диабет, повреждение эндотелия, эндотелиальная дисфункция, ангиопатия Попыхова Э.Б., Степанова Т.В., Лагутина Д.Д., Кириязи Т.С., Иванов А.Н. Роль сахарного диабета в возникновении и развитии эндотелиальной дисфункции. ПроблемыЭндокринологии. 2020;66(1):47-55. https://doi.org/10.14341/probl12212 Popyhova E.B., Stepanova T.V., Lagutina D.D., Kiriiazi T.S., Ivanov A.N. The role of diabetes in the onset and development of endothelial dysfunction. Problems of Endocrinology. 2020;66(1):47-55. (In Russ.) https://doi.org/10.14341/probl12212 ВВЕДЕНИЕ Медико-социальная значимость сахарного диабета определяется прогрессивным нарастанием частоты заболевания, а также развитием у пациентов работоспособного возраста инвалидизирующих и снижающих качество жизни сосудистых осложнений [1]. К числу таких осложнений относят микроангиопатии, включая нефро-, ретино- и нейропатии, а также макроангиопатии, в том числе ишемическую болезнь сердца и цереброваскулярные заболевания, для развития которых сахарный диабет является доказанным фактором риска [2]. Механизм развития ангиопатий при сахарном диабете носит многофакторный характер, но большинство исследователей сходятся во мнении, что гипергликемия, запуская комплекс патологических реакций, включая неферментативное гликозилирование, окислительный стресс и воспаление, является ключевым звеном в их возникновении и развитии. В настоящее время признано, что сосудистый эндотелий является многофункциональным органом. Эндотелиальные клетки метаболически активны и обладают паракринными, эндокринными и аутокринными функциями, необходимыми для поддержания гомеостаза сосудов в физиологических условиях [3, 4]. Функции эндотелия включают в себя регулирование целостности сосудов и их проницаемости, ангиогенеза, гемостаза. Эндотелий участвует в иммунных реакциях. Он играет ключевую роль в регуляции тонуса сосудов, воспалительных реакциях, контроле тканевого кровотока, поддержании реологических свойств крови [3−7]. Являясь основным регулятором сосудистого гомеостаза, эндотелий поддерживает баланс между вазодилатацией и вазоконстрикцией, ингибированием и стимулированием миграции и пролиферации клеток гладких мышц, фибринолизом и тромбообразованием, а также участвует в регуляции адгезии и агрегации тромбоцитов [4−7]. Нарушение этого регулируемого равновесия приводит к эндотелиальной дисфункции [5]. Сахарный диабет является типичным заболеванием, при котором наблюдается нарушение функции эндотелия [6]. Поэтому понимание механизмов, лежащих в основе возникновения и развития эндотелиальной дисфункции при сахарном диабете, является важным направлением в профилактике и лечении сосудистых осложнений, связанных со всеми формами сахарного диабета [8, 9]. В связи с этим целью настоящего обзора было рассмотрение механизмов, приводящих к возникновению эндотелиальной дисфункции при сахарном диабете. НАРУШЕНИЯ ФУНКЦИЙ ЭНДОТЕЛИЯ ПРИ САХАРНОМ ДИАБЕТЕ В настоящее время выделяют 4 типовые формы дисфункции эндотелия — вазомоторную, гемостатическую, адгезионную, ангиогенную [3]. Однако случаи изолированной эндотелиальной дисфункции встречаются редко, и, как правило, при большинстве заболеваний наблюдается комбинированное нарушение функции эндотелия [3, 6]. У пациентов с сахарным диабетом наблюдается снижение синтеза основных вазодилататоров, таких как оксид азота (nitric oxide, NO) и простациклин, а также повышение уровня вазоконстрикторов, прежде всего эндотелина-1, отражающих вазомоторную функцию эндотелия [2, 8]. При сахарном диабете наблюдается увеличение экспрессии молекул адгезии семейства селектинов и иммуноглобулинов, а также молекул адгезии тромбоцитов/эндотелиальных клеток (platelet/endothelial cell adhesion molecule 1, PECAM-1), тромбогенных биомаркеров эндотелия — тканевого фактора (tissue factor, TF), ингибитора активатора плазминогена-1 (plasminogen activator inhibitor-1, PAI-1) [10, 11]. Гипергликемия является одним из факторов альтерации гликокаликса эндотелиальных клеток, что сопровождается нарушением барьерной функции сосудистой стенки [12], и повышения ее адгезивных свойств, в частности, за счет гиперэкспрессии на поверхности эндотелиоцитов сосудистых молекул адгезии (vascular cell adhesion molecule 1, VCAM-1), а при отсутствии адекватного гликемического контроля — Р- и Е-селектинов [13]. Довольно часто эндотелиальная дисфункция за несколько лет предшествует развитию сахарного диабета, что было показано на примере повышения PAI-1 и фактора фон Виллебранда [9, 14, 15]. Следует отметить роль васкулоэндотелиального фактора роста (vascular endothelial growth factor, VEGF) в возникновении и развитии ангиогенной эндотелиальной дисфункции при сахарном диабете, поскольку он участвует в регуляции пролиферации эндотелиальных клеток сосудов в различных тканях. Повышают экспрессию VEGF гипергликемия [16, 17], в почках — высокое внутриклубочковое давление, провоспалительные цитокины. Неблагоприятные эффекты увеличенного синтеза VEGF реализуются в регуляторном комплексе с другими факторами роста, включая инсулиноподобные, трансформирующие (transforming growth factor beta, TGF-β), тромбоцитарные и др. [18, 19]. Последние исследования нарушений ангиогенной функции при сахарном диабете свидетельствуют, что гипергликемия непосредственно индуцирует пролиферацию и дифференцировку эндотелиальных клеток [20]. РОЛЬ ГИПЕРГЛИКЕМИИ В ВОЗНИКНОВЕНИИ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ В условиях гипергликемии активируется полиоловый путь окисления глюкозы, в котором при помощи фермента альдозоредуктазы глюкоза превращается в осмотически активные сорбитол и фруктозу, при этом расходуется клеточный мембрано-связанный мультимолекулярный ферментный комплекс (nicotinamide adenine dinucleotide phosphate, NADPH), имеющий большое значение в функционировании NO-синтазы (nitric oxide synthases, NOS) и антиоксидантных систем глутатиона и витамина Е [7, 21]. Дефицит NADPH обусловливает недостаточность системы антиоксидантной защиты, активацию свободнорадикального окисления и снижение синтеза NO [14, 21, 22]. В условиях гипергликемии снижается скорость диффузии NO к нижележащим гладкомышечным клеткам, уменьшается доступность L-аргинина — предшественника NO, усиливается свободнорадикальная деструкция NO и повышается инактивация других вазодилататоров [15, 22]. Результатом активации гексозаминового пути метаболизма глюкозы под влиянием гипергликемии является изменение активности транскрипционных факторов, включая специфический белок 1 (specificity protein 1, Sp1) и транскрипционный ядерный фактор каппа-би (nuclear factor kappa-light-chain-enhancer of activated B cells, NF-kB) [21, 22]. В эндотелиальных клетках Sp1 индуцирует транскрипцию PAI-1, что снижает тромборезистентность сосудистой стенки, а NF-kB способствует выработке провоспалительных цитокинов [23, 24]. Важным механизмом альтерирующего действия гипергликемии является активация сигнального пути диацилглицерол−протеинкиназа С. При гипергликемии увеличивается концентрация в клетках промежуточного продукта гликолиза дигидроксиацетонфосфата, который, восстанавливаясь до глицерол-3-фосфата, увеличивает синтез диацилглицерола, активирующего протеинкиназу С [21]. Стимулированная гипергликемией активация протеинкиназы С индуцирует множественные внутриклеточные сигнальные механизмы, вызывающие увеличение проницаемости сосудистой стенки, нарушение эндотелийзависимой релаксации сосудов и активации окислительного стресса. Протеинкиназа С стимулирует увеличение продукции VEGF, эпидермального фактора роста и TGF-β, обусловливающих повышение ангиогенной активности эндотелиоцитов, что приводит к структурному ремоделированию микроциркуляторного русла. Активация протеинкиназы С в гладкомышечных клетках за счет активации NF-kB ингибирует экспрессию гена и подавляет активность растворимой гуанилатциклазы — фермента, при помощи которого NO реализует свои эффекты, в частности вазодилатацию [25, 26]. Данные литературы последних лет свидетельствуют о том, что контроль гликемии у больных сахарным диабетом позволяет уменьшить альтерацию сосудистой стенки и препятствует развитию клинических признаков ангиопатий [14, 22]. В то же время имеются данные, что адекватный гликемический контроль при сахарном диабете как 1-го, так и 2-го типа не блокирует полностью патогенетические механизмы развития эндотелиальной дисфункции, а лишь замедляет ее прогрессирование [14]. Таким образом, гипергликемия реализует несколько механизмов индукции эндотелиальной дисфункции при сахарном диабете, включая активацию сигнальных реакций протеинкиназы С, метаболических путей гексозамина и полиолов. РОЛЬ ОКИСЛИТЕЛЬНОГО СТРЕССА В РАЗВИТИИ ЭНДОТЕЛИАЛЬНОЙ ДИСФУНКЦИИ Окислительный стресс — это состояние дисбаланса между оксидантами и антиоксидантами в биологической системе в сторону преобладания оксидантов. В настоящее время предложена гипотеза, согласно которой окислительный стресс, вызванный гипергликемией, является универсальным патогенетическим механизмом, играющим важную роль в возникновении и развитии диабетических сосудистых осложнений [15, 21]. Ключевую роль в развитии окислительного стресса играет дисбаланс продукции и утилизации активных форм кислорода. Гиперпродукция или недостаточная утилизация активных форм кислорода сопровождается их накоплением, в результате чего они начинают оказывать повреждающее действие, индуцируя окислительную модификацию липидов, белков и нуклеиновых кислот, что вызывает нарушение функций и может приводить к гибели клеток [15, 21, 25]. Активация перекисного окисления липидов, образование модифицированных липопротеинов, увеличение их содержания в пенистых клетках являются маркерами эндотелиальной дисфункции при сахарном диабете [15]. Активные формы кислорода в физиологических условиях образуются обычно в небольших количествах и выполняют в клетках, в том числе и эндотелиоцитах, ряд регуляторных функций. Источниками активных форм кислорода в клетке являются оксидазные реакции дыхательной цепи митохондрий, микросомального окисления, метаболизма пуринов, хинонов, катехоламинов, флавинов и других соединений. Выраженная активация образования активных форм кислорода, получившая название «кислородного взрыва», наблюдается в фагоцитах и выполняет защитную функцию, обеспечивая бактерицидный эффект [15, 21]. В физиологических условиях происходит быстрая детоксикация свободных радикалов в результате взаимодействия с различными восстанавливающими агентами (неферментными антиоксидантами и ферментами) [21]. При сахарном диабете в эндотелиоцитах выраженно нарастает продукция активных форм кислорода. В литературе описано несколько источников повышенной продукции активных форм кислорода, в частности супероксид-аниона при сахарном диабете, включая NADPH-оксидазу, мономеры NO-синтазы, систему альдозоредуктазы и митохондриальную цепь переноса электронов [18−22]. Гипергликемия индуцирует повышение экспрессии генов NADPH-оксидаз, а также стимулирует активность этой группы ферментов, что приводит к генерации супероксиданиона и истощению ресурсов NADPH — кофактора эндотелиальной NOS [21]. В физиологических условиях эндотелиальная NOS представляет собой димер, вырабатывающий NO. Мономерная форма эндотелиальной NOS обеспечивает продукцию супероксид-аниона. Димеризация NOS зависит от наличия кофактора тетрагидробиоптерина, который легко окисляется. При сахарном диабете снижается уровень тетрагидробиоптерина, что приводит к диссоциации NOS на мономеры и продукции ими супероксидных радикалов, которые, в свою очередь, окисляют тетрагидробиоптерин, замыкая порочный круг, приводящий к выраженному снижению продукции NO [22]. Снижение продукции NO eNOS обусловливает не только нарушение тромборезистентности и вазомоторной активности, но и ангиогенной и барьерной функций эндотелиоцитов [12]. Было продемонстрировано, что гипергликемия повышает продукцию супероксид-аниона в дыхательной цепи митохондрий, что повреждает митохондриальную ДНК. Альтерация митохондриальной ДНК, в свою очередь, приводит к постоянной генерации активных форм кислорода дыхательной цепью, то есть формируется порочный круг митохондриальной дисфункции, который не разрывается даже после нормализации уровня глюкозы [2, 21]. Активные формы кислорода оказывают влияние не только на генетический аппарат митохондрий, но и на ядра эндотелиоцитов, активируя NF-kB, что в итоге вызывает изменение экспрессии генов, регулирующих продукцию цитокинов, адгезивных молекул, ангиогенных факторов, а также апоптоз [25]. Таким образом, окислительный стресс при сахарном диабете развивается сразу несколькими взаимосвязанными патологическими процессами, включая активацию NADPH-оксидаз, митохондриальную дисфункцию и структурно-функциональные изменения NOS. Результатом окислительного стресса являются альтерация эндотелиальных клеток и снижение продукции NO, что вызывает нарушение вазомоторной, барьерной, ангиогенной функций эндотелия, а также его тромборезистентности. Механизмы защиты от окислительного стресса Разбалансированность взаимодействия активных форм кислорода и систем антиоксидантной защиты различается в зависимости от особенностей индукции окислительного стресса [15]. Так, избыточная продукция активных форм кислорода сопровождается последовательной сменой участия одних антиоксидантных систем на другие. Система антиоксидантной цитопротекции представлена двумя основными механизмами ферментативной и неферментативной защиты, которые функционируют в тесной ассоциации и регулируются сложным комплексом прямых и обратных связей [27]. Основные неферментативные антиоксидантные молекулы — это аскорбиновая кислота (витамин С), α-токоферол (витамин Е) и глутатион, в то время как супероксиддисмутаза (superoxide dismutase, SOD), каталаза (catalase, CAT), глутатионпероксидаза (glutathione peroxidase, GPxs), гемоксигеназа (hemoxygenase, НО), параоксоназы (paraoxonases, PON) и тиоредоксин (thioredoxin, Trx) играют важную роль в ферментативной антиоксидантной защите, непосредственно участвуя в удалении активных форм кислорода из клетки за счет превращения их в менее реактивные формы [9, 15]. В организме человека и млекопитающих идентифицировано несколько форм SOD в зависимости от металла-кофактора: Cu, Zn-SOD, Mn-SOD. SOD является первой линией защиты клеток от действия активных форм кислорода. Она катализирует дисмутацию супероксида в кислород (О2) и пероксид водорода (H2O2) [9, 21]. В сосудистой ткани были идентифицированы три различные изоформы SOD: Cu/Zn-SOD (кодируемая геном SOD1), расположенная в цитоплазме, Mn-SOD (кодируемая геном SOD2) — в митохондриях, внеклеточная SOD (кодируемая геном SOD3). Важность SOD как механизма антиоксидантной защиты была показана в исследованиях по переносу генов, в которых сверхэкспрессия SOD улучшала функцию эндотелия [9]. Также было показано, что сверхэкспрессия SOD2 предотвращает ассоциированную с гипергликемией продукцию O2-, активацию образования протеинкиназы С и конечных продуктов гликирования [9], подтверждая роль продукции митохондриальных активных форм кислорода при диабетических ангиопатиях. CAT в основном присутствует в пероксисомах, но также функционирует и в цитоплазме. Данный фермент имеет меньшую активность при расщеплении перекиси водорода по сравнению с GPxs, но медленно инактивируется, поэтому играет важную роль в превращении H2O2 в Н2О после дисмутации O2- с помощью SOD [9]. В работе [28] было показано, что наследственный дефицит CAT связан с повышенным риском развития сердечно-сосудистых заболеваний и сахарного диабета. Однако в работе [29] были представлены экспериментальные доказательства того, что CAT обеспечивает лишь умеренную защиту от окислительного стресса. GPx — это семейство цитозольных и митохондриальных ферментов, активность которых возрастает при сахарном диабете. GPx катализируют восстановление гидроперекисей липидов в соответствующие спирты и посредством окисления глутатиона (γ-L-glutamyl-L-cysteinyl-glycine, GSH) восстанавливают H2O2 до Н2О [30]. Существует несколько изоформ глутатионпероксидазы: в тканях млекопитающих и человека широко представлена изоформа GPx1. Авторы работы [15] показали, что у мышей нарушение гена GPx1 провоцирует повышенную восприимчивость к агентам, вызывающим окислительный стресс, тогда как было показано, что индукция этого изофермента обеспечивает защиту от окислительного повреждения эндотелиоцитов [9]. У мышей с дефицитом апоЕ дефицит GPx1 ускорял и модифицировал прогрессирование атеросклеротического поражения [31]. Кроме того, авторами в работе [32] было показано, что трансгенная сверхэкспрессия GPx1 приводит к улучшению состояния эндотелия. В работе [9] авторы показали, что дефицит GPx3 связан со снижением биодоступности NO и увеличением тромбоцитзависимого тромбоза. Мыши, нокаутированные по GPx4, проявляли нежизнеспособность и умирали во время раннего эмбрионального развития [15]. GSH является основным низкомолекулярным небелковым тиолом в клетке. В восстановленном состоянии он выполняет множество функций, участвуя в обмене веществ, передаче сигнала и экспрессии генов [9]. GSH является донором электронов и может непосредственно инактивировать активные формы кислорода, но он также действует как кофактор в превращении H2O2 в H2O с помощью GPx [28, 33] . Сходной с GPx антиоксидантной активностью обладают селенопротеины — Trx [28] и глутатион-S-трансферазы (GSTs) [21, 33]. Trx у человека и млекопитающих присутствует в эндотелиоцитах и гладкомышечных клетках. Он участвует в детоксикации активных форм кислорода и пероксинитрита в клетках. Trx проявляет большинство своих антиоксидантных свойств через Trx-пероксидазу (пероксиредоксин), которая использует эндогенные SH-группы в качестве восстанавливающих эквивалентов [34]. GSTs за счет конъюгации глутатиона обеспечивают восстановление окисленных мембранных фосфолипидов и детоксикацию мембранных липидных радикалов [21]. Гемоксигеназа (hemoxygenase, НО) оказывает непрямой антиоксидантный эффект за счет расщепления свободного гема и выработки монооксида углерода, а также биливердина и билирубина, которые обладают антиоксидантными свойствами [9, 16]. Существуют две изоформы этого фермента — конститутивная гемоксигеназа, HO2, которая экспрессируется в эндотелиальных клетках, и HO1, которая индуцируется в ответ на окислительный стресс и является адаптивным ответом клетки на действие активных форм кислорода. Авторы работы [35] показали, что HO1 оказывает цитопротекторный эффект, который проявляется в защите эндотелиоцитов от повреждающего действия активных форм кислорода. Генетические модели дефицита HO1 или его избыточной экспрессии позволяют предположить, что действия HO1 важны для модуляции тяжести атеросклероза [9]. PON представляет собой семейство трех ферментов. Полагают, что полиморфизм генов-представителей семейства РОN 1 и 2 оказывает выраженное влияние на параметры гликемии у пациентов с сахарным диабетом 2-го типа, а также на прогрессирование сосудистых осложнений, в частности ретинопатии [9, 36−38]. РОN 1- и 3-го типов секретируются печенью и циркулируют в крови в комплексе с липопротеинами высокой плотности. РОN1 обладает способностью расщеплять гидроперекиси липидов, что препятствует их повреждающему действию на эндотелий [36, 37]. Кроме того, PON1 обеспечивает снижение генерации активных форм кислорода макрофагами, что в комплексе с расщеплением окисленных липидов обусловливает антиатерогенные эффекты [39]. Показано, что при сахарном диабете активность PON1 уменьшается [36]. PON2, в отличие от PON1 и -3, действует только внутри клеток [40−42], ее основные эффекты связаны с предотвращением митохондриальной дисфункции [36]. Было показано, что фермент снижает активные формы кислорода в эндотелиальных клетках человека и гладких мышцах сосудов [9]. У мышей с дефицитом PON2 с фоном apoE-/- развивалось больше атеросклеротических поражений, тогда как мыши с избыточной экспрессией PON2 были защищены от этих поражений [9, 43]. Защита мембран от перекисного окисления также обеспечивается альфа-токоферолом, который, взаимодействуя с активными формами кислорода, переходит в феноксильный радикал, обладающий малой активностью. Интенсивное потребление неферментативных антиоксидантов, таких как глутатион и токоферол, в качестве кофакторов ферментных звеньев антиоксидантной защиты у пациентов с сахарным диабетом приводит к снижению содержания тиолов и требует постоянного восстановления окисленных форм этих соединений, которое осуществляется преимущественно за счет окисления аскорбиновой кислоты до аскорбата и дегидроаскорбата [15, 21]. Также в механизмах, обеспечивающих восстановление окисленного глутатиона, принимает участие альфа-липоевая кислота [21]. Таким образом, ликвидацию последствий окислительного стресса осуществляет многоуровневая система антиоксидантной защиты. Нарушение ее функционирования играет ключевую роль в возникновении и прогрессии сосудистых осложнений сахарного диабета в связи с выраженным негативным влиянием окислительного стресса на эндотелиоциты, обусловливающим эндотелиальную дисфункцию. РОЛЬ НЕФЕРМЕНТАТИВНОГО ГЛИКОЗИЛИРОВАНИЯ В РАЗВИТИИ СОСУДИСТЫХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА В 1987 г. S. Wolff с соавт. одними из первых показали, что в условиях нарушения углеводного обмена неферментативное аутоокислительное гликозилирование и окислительный стресс играют ключевую роль в развитии сосудистых осложнений [19]. Реакция гликозилирования обусловлена способностью глюкозы связываться с аминокислотными остатками белков и образовывать соединения, участвующие в обменных процессах. Эти соединения являются субстратом для образования конечных продуктов гликирования, которые обладают более длительным, по сравнению с белками, периодом полураспада и, в свою очередь, сами могут быть источниками активных форм кислорода. Чем выше гликемия, тем больше образуется конечных продуктов гликирования, которые накапливаются в тканях и сохраняются в них даже при достижении нормогликемии [14, 22, 44]. В процессе неферментативного гликозилирования образуются гликозилированные формы практически всех белков — гемоглобина, альбумина, липопротеидов, коллагена, белков хрусталика глаза. Следует отметить, что гликозилирование вызывает нарушение их структуры и функций [21]. В частности, гликозилирование гемоглобина увеличивает его сродство к кислороду, что затрудняет транскапиллярный обмен и способствует развитию гипоксии в тканях [21]. Гликозилирование альбумина приводит к нарушению транспорта билирубина, жирных кислот и лекарственных веществ. Необходимо отметить, что гликозилированный альбумин способен накапливаться в базальной мембране почечных клубочков и провоцировать развитие диабетической нефропатии [18, 19, 45]. Гликозилирование белков хрусталика нарушает светопропускание и ведет к развитию диабетической катаракты [46]. Гликозилирование липопротеидов приводит к тому, что соответствующие рецепторы перестают их распознавать, что, в свою очередь, вызывает увеличение времени их циркуляции в сосудистом русле, и, как следствие, наблюдается прогрессия атеросклеротического повреждения сосудистой стенки [22, 44]. Гликозилирование коллагена вызывает изменение его физико-химических свойств, которые проявляются меньшей растворимостью и большей устойчивостью к действию коллагеназы [21]. Конечные продукты гликирования оказывают выраженное влияние на состояние сосудистой стенки несколькими механизмами, которые могут быть разделены на рецепторные и нерецепторные. Первая группа связана со взаимодействием конечных продуктов гликирования с рецепторами эндотелиоцитов, вторая группа механизмов осуществляется за счет изменения конформации и активности ферментов, неспецифического связывания рецепторов и изменения их аффинитета и внутренней активности. Конечные продукты гликирования вызывают нарушение барьерной функции сосудистой стенки, повышают экспрессию адгезивных молекул, индуцируют образование активных форм кислорода, выработку провоспалительных цитокинов, повышают экспрессию индуцибельной NOS, что блокирует активность эндотелиальной NOS и снижает биодоступность NO, то есть в конечном итоге приводят к эндотелиальной дисфункции [47−49]. При этом показано, что конечные продукты гликирования оказывают непосредственное ингибирующее влияние на антиоксидантные ферменты, в частности PON2, что способствует развитию оксидативного стресса [50]. Кроме того, воздействие конечных продуктов гликирования на КПГ-рецепторы моноцитов и макрофагов вызывает их активацию и запускает экспрессию ими провоспалительных цитокинов, которые являются важным патогенетическим звеном в возникновении и развитии сосудистого воспаления и атерогенеза [14, 16]. Накопление конечных продуктов гликирования при прогрессировании диабета способствует структурному ремоделированию сосудистой стенки, что проявляется, в частности, увеличением толщины интимы и медии сонных артерий [51]. Таким образом, накопление конечных продуктов гликирования является одним из пусковых механизмов в возникновении эндотелиальной дисфункции при сахарном диабете. Эндотелиальная дисфункция, в свою очередь, играет инициирующую роль в каскаде последовательных процессов, происходящих в сосудистой стенке и приводящих к ее морфологическим изменениям. ВЫВОДЫ Эндотелиальная функция играет важную роль в поддержании гомеостаза организма, и на сегодняшний день сформулирована концепция, согласно которой эндотелиальная дисфункция является центральным звеном в патогенезе многих заболеваний, включая сахарный диабет. Проведенный анализ литературы свидетельствует, что развитие эндотелиальной дисфункции при сахарном диабете складывается из нескольких ключевых аспектов, которые могут быть представлены в виде схемы (рис.) Так, представленные данные позволяют выделить среди основных факторов, инициирующих альтерацию эндотелиальных клеток, гипергликемию и накопление конечных продуктов гликирования. Гипергликемия, обусловливающая активацию полиолового и гексозаминового путей, а также накопление продуктов гликолиза в совокупности с рецепторным и нерецепторным воздействием конечных продуктов гликирования нарушают метаболизм и функционирование сигнальных систем эндотелиоцитов как за счет изменения активности ферментов, в частности протеинкиназы С, эндотелиальной NOS, так и за счет изменения экспрессии ряда генов, в том числе гиперэкспрессии генов NADPH-оксидаз, PAI-1, VEGF, индуцибельной NOS, провоспалительных цитокинов. 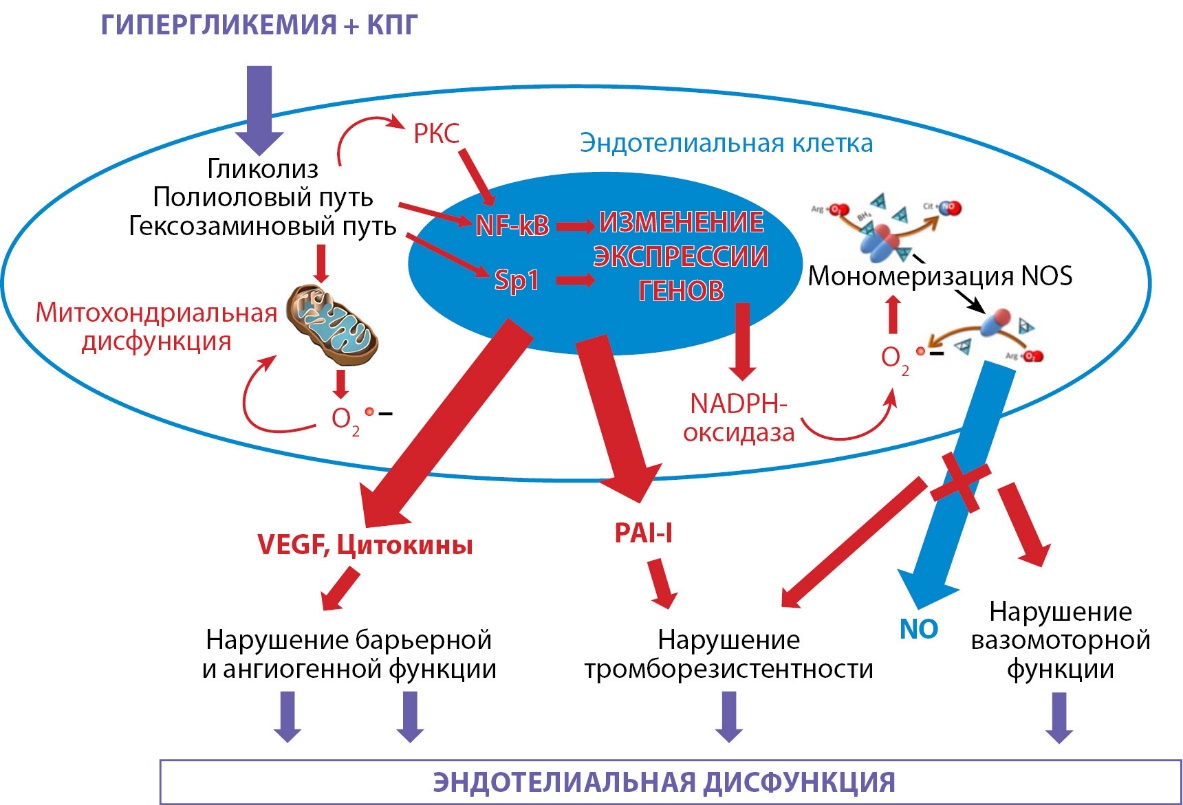 |
