Ответы к экзамену по иммунологии. Клеточный иммунитет введение
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
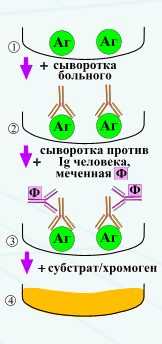
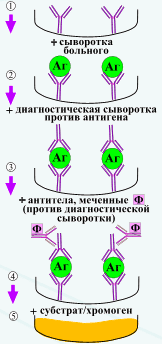
Отражение основных патологических состояний иммунной системы в иммунном статусе 1. Инфекционно-воспалительные заболевания. При различных инфекционных заболеваниях в иммунном статусе можно наблюдать следующие общие черты: повышение уровня активированных лимфоцитов (CD3-HLA-DR+; CD3+HLA-DR+); повышение общего уровня иммуноглобулинов в сыворотке крови: IgM – при острых воспалительных процессах, IgA – при острых и хронических воспалительных процессах слизистых оболочек, IgG - при хронических воспалительных процессах; усиление функциональной активности фагоцитарных клеток, проявляющееся в повышенном образовании активных форм кислорода; понижение уровня пролиферативной активности Т клеток (иногда). В зависимости от этиологии инфекционного процесса изменения в иммунном статусе имеют некоторые специфические черты. Бактериальная инфекция характеризуется повышением абсолютного и относительного числа нейтрофилов, В лимфоцитов (CD20+), появлением маркёров активации В лимфоцитов (CD38+ и HLA-DR), высокими показателями макрофагальной активности, повышением сывороточной концентрации иммуноглобулинов при острых инфекциях и снижением при хронических, повышением активности Th2-лимфоцитов (увеличение продукции ИЛ-4, ИЛ-10, ИЛ-13). Для вирусных инфекций и инфекций, вызванных другими внутриклеточными возбудителями (микоплазмами, хламидиями) характерны следующие изменения: лимфоцитоз или лимфопения; повышение (в начальном периоде инфекции) или снижение (при частых рецидивах) абсолютного и относительного числа Т лимфоцитов (CD3+); снижение абсолютного и относительного числа CD4+-лимфоцитов, особенно при частых рецидивах; повышение при острых и хронических инфекциях абсолютного и относительного числа уровня киллерных клеток: цитотоксических (CD3+CD8+) и NK-клеток (CD16+/56+); развитие Th1-ответа (повышенная продукция ИНФ-γ, ИЛ-2). 2. Иммунодефициты (ИД). Различают два вида иммунодефицитов: врожденный (первичный) и приобретенный (вторичный). Первичный ИД – это генетический дефект основных компонентов иммунной защиты организма от инфекции: Т и В звеньев системы иммунитета, фагоцитоза, комплемента. К приобретенным ИД относятся ВИЧ-инфекция, иммунодефициты при голодании, ожогах и т. п. Иммунодиагностика при врожденных (первичных) и приобретенном ИД имеет основное и решающее значение для постановки диагноза. Только с её помощью можно поставить окончательный клинический диагноз. И. Б. Резник предложил для диагностики первичных ИД определение следующих показателей: абсолютного количества лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов; сывороточных IgM, IgG, IgA; гемолитической активности комплемента; гиперчувствительности замедленного типа с помощью кожных тестов. Этот набор тестов позволяет осуществлять диагностику болезни Брутона (Х-сцепленной агаммаглобулинемии), гипер-IgM-синдрома, общей вариабельной и тяжелой комбинированной иммунологической недостаточности, синдрома Вискотта-Олдрича, селективной недостаточности IgA, дефицитов в системе комплемента. Какова же роль иммунодиагностики при вторичных ИД? Их основным клиническим проявлением является наличие у взрослого человека хронического, вялотекущего, рецидивирующего, трудно поддающегося адекватному этиотропному лечению инфекционно-воспалительного процесса любой локализации. Установление причины неспособности иммунной системы справиться с этим процессом является важной задачей клинической иммунологии. Изменения в иммунном статусе при вторичных ИД нередко являются следствием инфекционного процесса в организме, хотя в ряде случаев выявленные изменения являются причинными по отношению к частным или необычным инфекциям. Примерами могут быть CD4+-лимфопения при СПИДе, Т лимфопения при акцидентальной инволюции тимуса, гипогаммаглобулинемия при ожоговой болезни или нефротическом синдроме. В клинической практике бывают такие ситуации, когда имеются клинические признаки ИД, а показатели иммунного статуса находятся в пределах нормальных возрастных значений. Это бывает в следующих случаях: причина заболевания вне лимфоцитарного иммунитета, или имеют место различные нарушения неспецифической резистентности; ИД может быть связан со снижением иммунного ответа на конкретные антигены при интактных показателях системного иммунитета, иными словами может отсутствовать параллелизм между системным иммунным ответом и ответом на конкретный антиген; ограничение методов лабораторной диагностики (например, некоторые субклеточные дефекты рецепции цитокинов могут не сопровождаться значимыми изменениями в стандартных тестах иммунного статуса, но проявляться клинически как ИД). С другой стороны, возможно выявление различных нарушений иммунитета у практически здоровых людей, не часто болеющих, не предъявляющих жалоб. Это может быть связано с ошибками лабораторной диагностики или отражать компенсированное состояние за счёт других звеньев иммунной системы. 3. Аллергия. При атопическом варианте различных аллергических заболеваний (атопический дерматит, бронхиальная астма, аллергический ринит) можно выявить ряд общих черт: активация В лимфоцитов (повышение их абсолютного и относительного количества); повышение содержания в сыворотке крови общего и аллерген-специфических IgE; повышение концентрации сывороточного IgG и IgM при нормальных или сниженных значениях IgA; повышение или снижение отношения CD4+/CD8+; повышение активности Th2-лимфоцитов (увеличение продукции ИЛ-4, ИЛ-10, ИЛ-13) и торможение развития Th1-ответа (снижение продукции ИНФ-γ); повышение числа активированных лимфоцитов (HLA-DR+-клеток). 4. Аутоиммунные заболевания. Для различных как антиген-специфических, так и антиген-неспецифических аутоиммунных заболеваний наиболее типичны следующие сдвиги в иммунограмме: нормальное или пониженное содержание CD3+лимфоцитов; повышение уровня CD4+-клеток; повышение отношения CD4+/CD8+; снижение количества CD8+-лимфоцитов; повышение количества CD20+-лимфоцитов, особенно В1-лимфоцитов (CD20+CD5+); девиация Т хелперов в сторону Th1; повышение сывороточной концентрации иммуноглобулинов основных классов; повышение уровня ЦИК; повышенная или сниженная (чаще) фагоцитарная активность нейтрофилов. Иммунозависимые заболевания и состояния мы относим к двум группам: 1 группа - первичные (врожденные), и 2 - вторичные, которые включают следующие заболевания и состояния: 1. - аутоиммунные болезни. 2. - аллергические болезни. 3. - лимфопролиферативные и другие злокачественные новообразо- вания. 4. - инфекционные болезни, включая СПИД. 5. - большинство острых и хронических болезней желудочно-кишечного тракта, крови, кожи, эндокринной и сосудистой систем, соединительной ткани, урогенитальной сферы, ЛОР органов, хирургических, стоматологических, нарушений опорно-двигательного аппарата, ожоговой болезни и др. 6. - лекарственная иммуносупрессия. 7. - нормальная и осложненная беременность. 8. - старение. 9. - воздействие неблагоприятных экологических факторов - радиация и другие излучения, вибрация, промышленные токсины, пестициды, климатогеографические факторы и пр. 10. - хроническая недостаточность белков, витаминов, микроэлементов и других компонентов питания 11. - стресс в результате нервно-психической и физической перегрузки, травм, оперативных вмешательств и пр. Система гистосовместимости в трансплантационном иммунитете Эффективность отторжения трансплантата зависит, по крайней мере, от двух причин: уровня развития иммунной системы хозяина и степени индивидуальных различий по антигенам гистосовместимости между донором трансплантата и реципиентом. Подтверждением второго положения являются, в частности, исследования на дождевых червях, полученных из разных по удаленности популяций. Во всех случаях межпопуляционные отторжения были более эффективными, чем внутрипопуляционные. Очевидно, что в основе ярко выраженных различий по временным параметрам отторжения у иглокожих , круглоротых , хрящевых рыб , костных рыб , хвостатых амфибий также лежат индивидуальные антигенные различия между донором трансплантата и реципиентом. В настоящее время устоялось мнение, что система гистосовместимости - одна из наиболее общих и древних систем в мире животных. Она представлена уже у наиболее примитивных многоклеточных - губок и кишечнополостных . Подтверждением факту, что антигены гистосовместимости провоцируют развитие реакции специфического отторжения, стали, в частности, опыты по трансплантации у морской анемоны Anthopieura elegantissima (тип кишечнополостных). Мышиные антитела к одному из клонов данного вида подавляют развитие трансплантационного отторжения только того клона, который был взят для получения антител. С помощью моноклональных клоноспецифических антител был выделен антиген, ответственный за развитие отторжения. Им оказался низкомолекулярный, чувствительный к протеазам полипептид с мол. массой 10 кД. Система гистосовместимости описана также и у наиболее успешных беспозвоночных - оболочников . У Botryllus sp. аллораспознавание контролируется одним высокополиморфным главным и несколькими минорными локусами. Получены прямые доказательства гомологии между антигенами I класса главного комплекса гистосовместимости млекопитающих и наиболее древних позвоночных животных - хрящевых рыб . При использовании клонированной кДНК в геноме акулы Triakis stylla обнаружен ген, нуклеотидная последовательность которого гомологична последовательности, контролирующей третий домен тяжелой цепи антигена I класса MHC . У другого вида - акулы-няньки (Ginglymostoma cirratum) - выявлен участок ДНК, кодирующий полипептид, аминокислотная последовательность которого гомологична бета-цепи антигена II класса MHC млекопитающих. Дивергенция антигенов гистосовместимости на два класса у хрящевых рыб закрепилась в эволюции. Этими антигенами обладают костные рыбы , амфибии , рептилии , птицы . Таким образом, сравнительные данные по выявлению антигенов, провоцирующих реакции отторжения трансплантатов, указывают на очень раннее зарождение системы гистосовместимости. Уже на уровне губок и кишечнополостных эта система имеет свое проявление. Правда пока непонятно, имеется ли филогенетическая связь этой системы низших многоклеточных с классической системой гистосовместимости, описанной первоначально для млекопитающих (мышь, человек), а затем и для низших позвоночных животных (хрящевые и костные рыбы, амфибии, рептилии). Трансплантационный иммунитет: общая характеристика Основные закономерности отторжения чужеродной ткани были выявлены при трансплантации кожных лоскутов между инбредными линиями мышей. При первичной пересадке аллотрансплантата в первые два дня устанавливается общее кровообращение между трансплантатом и реципиентом, края пересаженной кожи срастаются с кожей хозяина. Внешне в течение 4-5 дней трансплантат кажется прижившимся. Однако именно в этот внешне благополучный период формируются эффекторные механизмы отторжения. И к 6-7 дню наблюдается отечность трансплантата, прекращается его кровоснабжение, развиваются геморрагии. В зоне локализации трансплантата скапливаются клетки воспалительной реакции , среди которых доминируют лимфоциты . Начинается процесс деструкции трансплантата. К 10-11 дню трансплантат погибает, и его пересадка на исходного донора не приводит к восстановлению жизнеспособности. Такова в самых общих чертах картина отторжения первичного трансплантата (англ. first set rejection ). При повторной пересадке трансплантата от того же донора реакция отторжения развивается приблизительно в два раза быстрее - за 6-8 дней. Первоначальная незначительная васкуляризация трансплантата быстро сменяется тромбозом сосудов и клеточным некрозом. Иногда наблюдается особо острая форма вторичного отторжения ( second set rejection ) по типу " белого трансплантата ". При этой форме вторичного отторжения не происходит васкуляризации трансплантата. Процесс отмирания ткани начинается сразу после пересадки. Трансплантат остается тонким и депигментированным. Реакция вторичного отторжения специфична и не наблюдается при пересадке трансплантата от постороннего донора на исходного реципиента. В этом случае аллотрансплантат отторгается по варианту первичной пересадки (first set rejection). Основными факторами, провоцирующими отторжение, являются антигены гистосовместимости; кодирующие их гены носят название генов совместимости. Всего существует более 30 локусов гистосовместимости, и они различны по степени вызываемого их продуктами отторжения. Аллоантигены, кодируемые генами MHC, вызывают особенно сильную реакцию отторжения; это те самые молекулы, которые презентируют антигены T-клеткам. Продукты аллельных вариантов других генов гистосовместимости - минорные антигены гистосовместимости - сами по себе (т.е. при условии полной идентичности по молекулам МНС между донором трансплантата и реципиентом) вызывают менее сильную реакцию отторжения, которая приобретает хронический характер. Однако в сочетании несколько минорных (слабых) антигенов могут вызвать сильную реакцию отторжения. Картина отторжения почечного транслантата у людей в основном аналогична той, которая описана для мышей при отторжении первичного кожного трансплантата. Гены MHC наследуются в соответствии с законами Менделя и экспрессируются кодоминантно. Иными словами, каждый индивид наследует два гаплотипа ("половинных набора") генов, по одному от каждого родителя; оба гаплотипа экспрессированы в равной степени. Молекулы (антигены) MHC распределены неодинаково среди клеток разных типов. В обычных условиях молекулы MHC класса I экспрессирует большинство ядерных клеток (у некоторых видов также эритроциты и тромбоциты), тогда как экспрессия молекул MHC класса II ограничена антигенпрезентирующими клетками , такими как дендритные клетки и активированные макрофаги , и B-лимфоцитами . У некоторых видов эти молекулы обнаруживаются также на активированных T-клетках и эндотелии сосудов. Экспрессию антигенов MHC регулируют цитокины - интерферон-гамма и фактор некроза опухолей . Оба эти агента служат мощными индукторами экспрессии MHC клетками многих типов, которые до этой активации экспрессируют молекулы MHC лишь в слабой степени. И это обстоятельятельство играет существенную роль в реакции отторжения трансплантата. 21.Иммунофериентный анализ, или метод (ИФА) - выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазной и или щелочной фосфатазой). После соединения антигена с меченой ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции - интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики сальмонеллеза, микоплазмозов и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях - 1010 - 1012 г/л.
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе. Первичные иммунодефициты у животных
Иммунопатогенез аутоиммунных болезней. Механизм аутоиммунных процессов и болезней сходен с механизмом аллергии немедленного и замедленного типов и сводится к образованию аутоантител, иммунных комплексов и сенсибилизированных Т–лимфоцитов–киллеров. Оба механизма могут сочетаться или один из них преобладает. Сущность аутоиммунных процессов заключается в том, что под влиянием возбудителей инфекционных и инвазионных болезней, химических веществ, лекарств, ожога, ионизирующего облучения, кормовых токсинов изменяется антигенная структура органов и тканей организма. Возникшие аутоантигены стимулируют синтез в иммунной системе аутоантител и формирование сенсибилизированных Т–лимфоцитов–киллеров, способных осуществлять агрессию против измененных и нормальных органов, вызывая повреждения печени, почек, сердца, головного мозга, суставов и других органов. Морфологические изменения при аутоиммунных болезнях характеризуются воспалительными и дистрофическими изменениями в поврежденных органах. В клетках паренхимы выявляются зернистая дистрофия и некроз. В кровеносных сосудах отмечается мукоидное и фибриноидное набухание и некроз их стенок,тромбоз, вокруг сосудов формируются лимфоцитарно-макрофагальные и плазмоцитарные инфильтраты. В соединительной ткани стромы органоввыявляются дистрофия в форме мукоидного и фибриноидного набухания, некроз исклероз. В селезенке и лимфатических узлах выражена гиперплазия, интенсивная инфильтрация лимфоцитами, макрофагами и плазматическимиклетками. Существует определенный спектр проявления аутоиммунной патологии. Для одних характерны поражения органов — органоспецифичность. Примеромможет служить болезнь Хасимото (аутоиммунный тиреоидит), при которойнаблюдаются специфические поражения щитовидной железы, включающиемононуклеарную инфильтрацию, разрушение фолликулярных клеток и образованиезародышевых центров, сопровождающихся появлением циркулирующих антител копределенным компонентам щитовидной железы. Генерализованные или неорганспецифические характеризуются аутоиммуннойреакцией с антигенами, общими для различных органов и тканей, в частности,с антигенами клеточного ядра. Примером такой патологии является системнаякрасная волчанка, при которой аутоантитела не обладают органнойспецифичностью. Патологические изменения в этих случаях затрагивают многиеорганы и представляют собой в основном поражения соединительной ткани сфибриноидным некрозом. Часто поражаются и форменные элементы крови. Вместе с тем, аутоиммунный ответ на собственные антигены с участиемклеточного и гуморального звеньев иммунитета направлены прежде всего насвязывание, нейтрализацию и элиминацию из организма старых, разрушенныхклеток, продуктов тканевого метаболизма. В условиях нормальногофизиологического состояния степень возможности аутоиммунных процессовстрого контролируется. Признаками аутоиммунной патологии, когда нарушается аутоиммунныйгомеостаз, может быть появление забарьерных антигенов из таких тканей какхрусталик глаза, нервная ткань, тестикулы, щитовидная железа, антигенов,появившихся под влиянием неадекватных воздействий на организм фактороввнешней среды инфекционного или неинфекционного происхождения, генетическиобусловленных дефектов иммуноцитов. Развивается сенсибилизация каутоантигенам. Взаимодействующие с ними аутоантитела могут быть условноразделены на несколько групп: аутоантитела, вызывающие повреждение клеток,что лежит в основе аутоиммунных заболеваний; аутоантитела сами по себе невызывающие, но утяжеляющие течение уже возникшего заболевания (инфарктмиокарда, панкреатит и другие); аутоантитела–свидетели, не играющиесущественной роли в патогенезе заболевания, но возрастание титра которыхможет иметь диагностическое значение. Заболевания связанные с поражением тканей аутоантителами, могут бытьобусловлены:1) антигенами;2) антителами;3) патологией органов иммуногенеза.Аутоиммунная патология, обусловленная антигенами Особенностью этой патологии является то, что ткани собственногоорганизма, либо без изменений своего антигенного состава, либо после егоизменения под влияние факторов внешней среды воспринимаются иммунологическим аппаратом как чужеродные. При характеристике тканей первой группы (нервной, хрусталика глаза, тестикулов, щитовидной железы) следует отметить две кардинальныеособенности: 1) они закладываются позднее иммунного аппарата, аследовательно к ним сохраняются иммунокомпетентные клетки (в отличие оттканей, закладывающихся раньше иммунного аппарата и выделяющих факторы,уничтожающие иммунокомпетентные клетки к ним); 2) особенности кровоснабжения этих органов таковы, что продукты их деградации не попадаютв кровь и не достигают иммунокомпетентных клеток. При повреждениигематопаренхиматозных барьеров (травма, операция) эти первичные антигеныпопадают в кровь, стимулируют выработку антител, которые проникая черезповрежденные барьеры действуют на орган. Для второй группы аутоантигенов решающим является то, что поддействием внешнего фактора (инфекционной или неинфекционной природы) тканьизменяет свой антигенный состав и фактически становится для организмачужеродной.Аутоиммунная патология, обусловленная антителами Имеет несколько вариантов: 1. Попадающий в организм чужеродный антиген имеет детерминанты, сходные с антигенами собственных тканей организма, в связи с чем антитела, образовавшиеся на чухой антиген "ошибаются" и начинают повреждать собственные ткани. Чужеродный же антиген в дальнейшем может отсутствовать. 2. В организм попадает чужеродный гаптен, который соединяется с белком организма и на этот комплекс вырабатываются антитела, способные реагировать с каждым его отдельным компонентом, в том числе и со своим белком, даже в отсутствие гаптена. 3. Реакция похожа на 2-тип, только в организм попадает чужеродный белок, реагирующий с гаптеном организма и, вырабатывающиеся на комплекс антитела, продолжают реагировать с гаптеном даже после выведения из организма чужого белка.Аутоиммунная патология, обусловленная органами иммуногенеза Иммунный аппарат не содержит иммунокомпетентных клеток к тканямсобственного организма, закладывающимся в эмбриогенезе раньше иммуннойсистемы. Однако такие клетки могут появиться в процессе жизни организма врезультате мутаций. В норме они либо уничтожаются, либо подавляютсясупрессорными механизмами. По этиопатогенезу аутоиммунную патологию разделяют на первичную и вторичную. Аутоиммунные болезни являются первичными. К аутоиммунным заболеваниям относят диабет, хронический тиреоидит,атрофический гастрит, язвенный колит, первичный цирроз печени, орхиты,полиневриты, ревмокардит, гломерулонефрит, ревматоидный артрит,дерматомиозит, гемолитическую анемию. Патогенез первичной аутоиммунной патологии у человека и животных имеетпрямую связь с генетическими факторами, определяющими природу, местолокализации, степень выраженности сопровождающих их проявлений. Главнуюроль в продетерминированности аутоиммунных заболеваний играют гены,кодирующие интенсивность и природу иммунных ответов на антигены — геныглавного комплекса гистосовместимости и гены иммуноглобулинов. Аутоиммунные заболевания могут формироваться с участием различныхтипов иммунологического повреждения, их сочетания и последовательности.Может превалировать цитотоксическое действие сенсибилизированных лимфоцитов(первичный цирроз, язвенный колит), мутантных иммуноцитов, воспринимающихнормальные тканевые структуры в качестве антигенов (гемолитическая анемия,системная красная волчанка, ревматоидный артрит), цитотоксических антител(тиреоидит, цитолитическая анемия), иммунных комплексов антиген–антитело(нефропатия, аутоиммунная кожная патология). Вторичная аутоиммунная патология развивается как следствие различныхпервичных повреждений органов и тканей неадекватными факторами внешнейсреды и носит название аутоиммунных процессов. Выйявление аутоантител: метод непрямой иммунофлюоресценции, В настоящее время наиболее часто используются 4 метода определения антиядерных антител - иммунофлюоресценция, иммуноферментный анализ, методы дот-бло та и вестерн-блота. Иммуноглобулины и антитела Измерение концентрации иммуноглобулинов. Обычно концентрация сывороточных иммуноглобулинов измеряется методом простой радиальной диффузии или автоматическими иммунотурбидометрическими методами. Реже используются радиоиммуноэлектродиффузия, радиоиммунный анализ и ELISA. Электорфорез и иммуноэлектрофорез не являются адекватными методами определения концентрации иммуноглобулинов. Иммуноэлектрофорез и иммунофиксация используются для выявления М-компонентов. Концентрацию иммуноглобулинов также можно измерить в секретах: слюне, слезах, в грудном молоке. В сыворотке некоторых больных, например, при общей вариабельной иммунной недостаточности (ОВИН, и CVID) и гипер-IgM синдроме, концентрация IgM может быть значительно увеличена за счет мономеров IgM. Простая радиальная диффузия или ELISA используются для определения субклассов IgG, однако стандарты и нормальные уровни еще недостаточно хорошо установлены. Определение субклассов IgG имеет ограниченные возможности, так как у некоторых больных с клиническими проявлениями иммунодефицита, обусловленного функциональными дефектами антител концентрации субклассов IgG нормальны, и наоборот, дефицит отдельных субклассов IgG нередко выявляется у клинически здоровых людей, имеющих эффективную продукцию антител. Количественная оценка субклассов IgА не всегда доступна и не имеет практического значения. Концентрация сывороточных иммуноглобулинов зависит от возраста и среды, окружающей пациента, поэтому необходимо учитывать возрастные нормы. Концентрации иммуноглобулинов не являются абсолютным критерием для диагностики первичных иммунодефицитов. Снижение концентрации иммуноглобулинов может быть вызвано как их потерей, так и сниженным синтезом. Степень потери иммуноглобулинов можно оценить непрямым методом, измеряя концентрацию альбумина в сыворотке (альбумин обычно теряется вместе с иммуноглобулинами, например, через желудочно-кишечный тракт). Ограничение разнобразия иммуноглобулинов и изменение соотношения - легких цепей наблюдаются при некоторых иммунодефицитах. Оценка образования антител после иммунизации. Иммунитет, опосредованный антителами (гуморальный иммунитет) можно оценить по уровню выработки антител на антигены с которыми население обычно широко контактирует и после активной иммунизации. Могут быть использованы антигены белковой или полисахаридной природы, последние - особенно уместны для больных с сино-пульмональными инфекциями. При подозрении на иммунодефицит или в случае его выявления для диагностических целей нельзя использовать живые вакцины (BCG и вакцины против полиомиелита, кори, краснухи и паротита). Активная иммунизиция BCG и любыми другими живыми вакцинами категорически противопоказана и при наличии или подозрении на любую форму первичного или вторичного иммунодефицита. Рекомендуются следующие исследования: 1."Естественные" антитела: А и В изогемагглюти-нины, гетероагглютинины и гетеролизины (т.е. направленные против эритроцитов барана или кролика), антистрептолизин и бактерицидные антитела против Escherichia coli. 2. Гуморальный ответ на обычную иммунизацию. а) Для неиммунизированных детей можно использовать коммерческую дифтерийно-столбнячную вакцину в рекомендуемых дозах. Через 2 недели после иммунизации в крови определяют противодифтерийные и/или противостолбнячные антитела. Можно поставить Schick тест. Также можно использовать убитую полиомиелитную вакцину (1.0 мл внутримышечно 3 раза через 2 недели); забор крови производится через 2 недели после последней инъекции, и определяется титр антител, обычно методом нейтрализации вируса. б) Пациентам, иммунизированным вакцинами дифтерии/столбняка (DT) или дифтерии/коклюша/ столбняка (DPT) проводят одну ревакцинацию, затем определяют концентрацию антител и/или проводят Schick тест. 3. Могут быть рекомендованы дополнительные виды активной иммунизации. а) Безопасным антигеном, "удобным" для применения является бактериофаг фХ 174 - бактериальный вирус, не инфицирующий человека; его можно использовать для измерения клиренса антигена при первичном и вторичном иммунных ответах. б) Для оценки гуморального ответа на углеводные антигены следует применять пневмококковые или менингококковые полисахариды или свободный от белков полисахарид Hemophilus b, а также тифоидный Vi-антиген. Через 2 недели в крови опреде-ляют концентрацию антител. Данные полисахаридные антигены не используются (и могут быть противопоказаны) для детей младше 2 лет, особенно если подозревается иммунодефицит, если они не конъюгированы с белками. Интерпретация результатов иммунизации полисахаридными антигенами у детей младше 5 лет затруднена. с) Другие антигены, полезные для оценки первичного иммунного ответа: i) убитая вакцина клещевого энцефалита, ii) вакцина гепатита В. 6.2.3. В лимфоциты. Подсчет В лимфоцитов основан на определении мембраносвязанных иммуноглобулинов или на использовании моноклональных антител к В клеточным антигенам (CD19, CD20) с помощью иммунофлуоресценции. Моноциты могут быть подсчитаны и отличены от В лимфоцитов и с помощью окраски на пероксидазу или эстеразу, при поглощения частиц латекса, нагруженных молекулами IgG, или с помощью специфических для моноцитов моноклональных антител, например, CD14. Обнаружение пре-В-клеток в костном мозге основано на использовании очищенных, меченных флуорохромом антител к цитоплазматическим тяжелым -цепям в клетках не выявляющих поверхностных иммуноглобулинов и цитоплазматических легких цепей. Аллергические реакции
Иммунотропные препараты В настоящее время большинство исследователей предлагают разделять все иммунотропные препараты на три группы:1) иммуностимуляторы;2) иммунодепрессанты (иммуносупрессоры);3) иммуномодуляторы. Так, для коррекции нарушений функции клеток моноцитарно-макрофагальной системы эффективны: метилурацил, пентоксил, нуклеинат натрия, полиоксидоний, ликопид, лисобакт, рибомунил и др. При дисфункции Т-клеточного звена иммунитета можно применить один из следующих препаратов: Т-активин, тимоген, тималин, вилозен, иммунофан, полиоксидоний, левамизол, нуклеинат натрия, эрбисол, диуцифон, витамины А, Е, микроэлементы и пр. При нарушении функции В-клеточного звена иммунитета необходимо назначение таких средств, как миелопид, полиоксидоний, препараты иммуноглобулинов, бактериальные полисахариды (пирогенал, продигиозан), иммунофан, спленин, микроэлементы и др. Для стимуляции натуральных киллеров применяются препараты интерферонов: естественных – эгиферон (человеческий лейкоцитарный), ферон (человеческий фибробластный), ИФН-γ (человеческий иммунный); рекомбинантных – реаферон, ладиферон, β-ферон, γ-ферон и др.; синтетических индукторов эндогенного интерферона – циклоферон, мефенамовая кислота, дибазол, кагоцел, амиксин, гроприназин, амизон, горчичники (индукторы интерферона в месте аппликации) и др. Для ослабления иммунного ответа (например, для подавления посттрансплантационных реакций), лечения аутоиммунных и аллергических заболеваний используют иммуносупрессоры. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||