Микрокапсулирование - это процесс заключения в оболочку микроскопических частиц твердых, жидких или газообразных лекарственных веществ. Размер заключенных в микрокапсулу частиц может колебаться в широких пределах: от 1 до 6500 мкм, т.е. до размера мелких гранул или капсул (6,5 мм). Наиболее широкое применение в медицине нашли микрокапсулы размером от 100 до 500 мкм. Современная технология дает возможность наносить покрытия на частицы размером менее 1 мкм.
Существующие методы микрокапсулирования делятся на три основные группы: физические, физико-химические и химические.
Физические методы
Физические методы микрокапсулирования многочисленны. К ним относятся методы дражирования, распыления, напыления в псевдосжиженном слое, диспергирования в несмешивающихся жидкостях, экструзионные методы, электростатический метод и др. Суть всех этих методов заключается в механическом нанесении оболочки на твердые или жидкие частицы лекарственных веществ.
Использование того или иного метода находится в зависимости от того, является ли «ядро» (содержимое микрокапсулы) твердым или жидким веществом.
Метод дражирования. Применим для микрокапсулирования твердых лекарственных веществ. Последние в виде однородной кристаллической массы (с требуемым размером частиц) во вращающемся дражировочном котле опрыскивается из форсунки раствором пленжообразователя. Образующиеся пленки высыхают в токе нагретого воздуха, подаваемого в котел. Толщина оболочки микрокапсулы зависит от температуры, концентрации и скорости пульверизации раствора пленкообразователя. Микрокапсулы с твердым ядром, получаемые методом дражирования, называются также микродраже.
Метод распыления. Применяется обычно для микрокапсулирования твердых веществ, которые перед этим должны быть переведены в состояние тонких суспензий. При получении таких микрокапсул, обычно имеющих жировую оболочку, ядра суспендируются в растворе или расплаве жировых веществ с последующим распылением и сушкой суспензии в распылительной сушилке. Получаемые сухие микрокапсулы имеют размер 30-50 мкм.
Методы диспергирования в несмешивающихся жидкостях. Применим для капсулирования жидких веществ. В частности, капельный способ, применяемый для получения мягких капсул, может быть использован и для микрокапсул. Для этого скорость потока струи воды в наружной трубе должна быть настолько велика по сравнению со скоростью движения жидкого лекарственного вещества и расплавленного пленкообразователя, чтобы поток воды отрывал капельки требуемого размера.
Обычно этот способ технологически осуществляется следующим образом. Нагретую эмульсию масляного раствора лекарственного вещества, стабилизированную желатином (эмульсия типа М/В), диспергируют в охлажденном жидком парафине с помощью мешалки. В результате охлаждения мельчайшие капельки покрываются быстро застудневающей желатиновой оболочкой. Застывшие шарики отделяют рт жидкого парафина, промывают органическим растворителем и сушат. Размер микрокапсул, получаемых таким способом, обычно колеблется в пределах 100-150 мкм.
Метод "напыления" в псевдосжиженном слое. Этот метод применяется в аппаратах, принципиальная конструкция которых сходна с СП-30 и СГ-30, применяемых в таблеточном производстве или гранулировании.
Наиболее просто процесс напыления протекает при микрокапсулирования твердых лекарственных веществ. Твердые ядра сжижают потоком воздуха или другого газа и «напыляют» на них раствор (или расплав) пленкообразующего вещества с помощью форсунки. Затвердение жидких оболочек происходит в результате испарения растворителя или охлаждения, или того и другого одновременно.
В случае микрокапсулирования жидких лекарственных веществ последние эмульгируют (если они нерастворимы в воде) или растворяют (если они водорастворимы) при нагревании в водном растворе пленкообразователя (например, желатины). Нагретую эмульсию (раствор) разбрызгивают с помощъю форсунки в псевдосжиженную систему с гидрофобизированным крахмалом. Капельки, представляющие собой жидкие микрокапсулы, попадая в эту систему, покрываются мельчайшими частицами крахмала, прилипающими к желатиновой оболочке, и быстро высыхают.
Метод микрокапсулирования с помощью центрифугирования. Под воздействием центробежной силы частицы капсулируемых лекарственных веществ (твердых или жидких) проходят через пленку раствора пленкообразователя, покрываются ею, образуя микрокапсулу. Пленкообразователями применяются вещества, растворы которых обладают достаточным поверхностным натяжением (желатин, натрия альгинат, поливиниловый спирт и некоторые др.) и оптимальной вязкостью. От этих параметров будет зависеть размер и форма микрокапсул.
Физико-химические методы
Основным физико-химическим методом является микрокапсулирование с использованием явления коацервации.
В настоящее время процесс коацервации высокомолекулярных соединений рассматривается как образование двухфазной системы в результате расслаивания. Одна фаза представляет собой раствор высокомолекулярного вещества в растворителе, вторая-раствор растворителя в высокомолекулярном веществе. Раствор, более богатый высокомолекулярным веществом, часто выделяется в виде капелек коацервата. При дальнейшем обезвоживании коацерваты переходят в осадок. Впоследствии оболочки капель подвергают затвердению для повышения механической прочности микрокапсул, которая осуществляется различными способами (охлаждением, испарением растворителя и др.).
Необходимо различать простую и сложную коацервацию.
Метод простой коацервации. Процесс образования микрокапсул простой коацервации протекает следующим образом.
Капсулируемое вещество (масло, масляные растворы витаминов, гормонов и других лекарственных препаратов) эмульгируют в растворе желатина при 50°С. Получается эмульсия М/В с возможной степенью дисперсности 2-5 мкм.
В раствор пленкообразователя (последний в данной системе является внешней средой) при постоянном помешивании добавляют 20% водный раствор натрия сульфата. Дегидратирующие свойства натрия сульфата вызывают коацервацию желатина. Образуется гетерогенная жидкая система с неоднородным распределением в ней растворенного вещества, состоящая из двух фаз - обогащенной и обедненной молекулами растворенного вещества (желатин).
Микрокапли коацервата с понижением температуры начинают концентрироваться вокруг капель масла, образуя вначале «ожерелье» из микрокапель коацервата. Затем микрокапли сливаются, покрывая каплю масла сплошной тонкой, пока жидкой пленкой желатина - образуется микрокапсула.
Для застудневания оболочек микрокапсул смесь быстро выливают в емкость с холодным раствором натрия сульфата.
Отфильтровывают микрокапсулы и промывают водой с целью удаления раствора натрия сульфата. Эта операция может быть проведена на нутч-фильтрах, рамных фильтрпрессах или с помощью центрифуг.
Метод сложной коацервации. Сложная коацервация сопровождается взаимодействием между положительными и отрицательными зарядами двух полимеров и вызывается обычно изменением рН. Сложные коацерваты могут быть одно-, двух - и трехкомпонентными. В однокомпонентных коацерватах оба полимера относятся к одной и той же группе химических соединений и частицы обоих являются амфионами. В этих системах положительные заряды одного амфиона притягиваются к отрицательным зарядам другого амфиона и наоборот. В двухкомпонентных коацерватах оба полимера являются разными соединениями и несут противоположные заряды: положительные макроионы - макрокатионы или отрицательные - макроанионы.
Разберем в качестве примера микрокапсулирование витаминов С и В. Тонко измельченные препараты диспергируют в растворе пленкообразователя: аскорбиновую кислоту в растворе этилцеллюлозы в метилэтикетоне или ацетилцеллюлозы в ацетоне, тиамина хлорид - в растворе ацетофталата целлюлозы в смеси ацетона и гексана. При медленном добавлении в эти системы высокомолекулярного осадителя (полисилоксановая жидкость) выделяется новая дисперсная фаза, которая в виде микрокапель локализуется вокруг кристалликов аскорбиновой кислоты, сливаясь затем в сплошную оболочку. Последующие операции обычные: отверждение оболочек микрокапсул, отделение микрокапсул от дисперсионной среды, промывка и сушка.
Химические методы
Получение микрокапсул химическим методом основано на реакции полимеризации и поликонденсации на границе раздела фаз вода - масло. Для получения микрокапсул этим методом в масле растворяют лекарственное вещество, мономер (например, метилметакрилат) и катализатор реакции полимеризации (например, перекись бензоила). Полученный раствор нагревают 15-20 мин при температуре 55°С и вливают в водный раствор эмульгатора. Образуется эмульсия типа М/В, которую выдерживают 4 ч для завершения полимеризации. Полученный полиметилметакрилат, нерастворимый в масле, образует вокруг капелек последнего плотную оболочку. Сформировавшиеся микрокапсулы отделяют от среды, промывают и сушат.
2 Микросферы
Микросферы - это матричные системы, часто диаметром 100-500 мкм, в которых диспергированно лекарственное вещество. Как правило, микросферы с контролируемым высвобождением веществ получают путем дисперсии спиртового раствора вещества в жидком парафине. Известен способ получения микросфер с НПВС (например, с ибупрофеном) на основе акриловых полимеров. Способ заключается в перемешивании этанольного раствора лекарственного вещества и эудражита L-100 с последующим их выливанием в водную фазу.
Образуются мелкодисперсные коацерваты, которые постепенно отвердевают и трансформируются в микросферы ибупрофена, обладающим по сравнению с обычными кристаллами ибупрофена лучшей сыпучестью, насыпной массой и прессуемостью.
Терапевтические системы с направленной доставкой лекарственных веществ к органу, ткани или клетке: носители лекарственных веществ второго поколения (нанокапсулы, наносферы, липосомы). Особенности их производства и оценка качества.
Носители лекарственных веществ II поколения (нанокапсулы, липосомы), эти носители обычно размером менее 1 мкм и объединяются в одну группу под названием коллоидных носителей. Разработаны методы получения нанокапсул с фенобарбиталом, диазепамом, преднизолоном, инсулином, простагландинами; наносфер с цитостатиками, кортикостероидами; создаются липосомы для доставки ферментов, хелатирующих и химиотерапевтических, противовоспалительных, противовирусных и белковой природы веществ
1 Наноносители
В отличие от макрокапсул (например, желатиновых) и микрокапсул (размером 500-10 мкм) наноносители предназначены не столько для перорального введения (хотя и оно применяется), сколько для инъекционного введения как внутривенного (транспорт к органам-мишеням либо длительная циркуляция в кровяном русле), так и внутримышечного (депо ЛВ или постепенное поступление наноносителей либо выделяемых ими ЛВ в кровоток). Также используется пероральное, ингаляционное и интраокулярное введение наноносителей. Возможна также интра - и трансдермальная подача ЛВ с помощью наноносителей. Широко применяются наноносители в косметике.
Наноносители могут быть двух видов:
1. наночастицы, представляющие монолитные, обычно сферические образования, содержащие ЛВ по всей массе наночастицы или только на ее поверхности. Выделение ЛВ из наночастицы происходит постепенно с контролируемой скоростью: а) только с поверхности; б) со всей массы наночастицы в результате ее распада или набухания. К наночастицам относятся также нанокристаллы, состоящие только из ЛВ, подвергнутого измельчению до соответствующих размеров, что позволяет им растворяться со скоростью, превышающей скорость растворения частиц более крупных размеров;
1. нанокапсулы представляют собой полые сферические контейнеры (с толщиной стенки
10-30 нм), содержащие жидкую среду, в которой растворено ЛВ. Высвобождение ЛВ из нанокапсулы происходит за счет диффузии ЛВ через стенку или разрыва капсулы. Скорость высвобождения регулируется дизайном нанокапсул и способом их получения.
Взаимодействие наноносителей с клетками зависит и от материала, из которого они изготовлены. Наиболее часто используют:
нанокристаллы ЛВ без дополнительного материала;
липиды (жиры) для получения липидных нанокапсул, т.е. липосом, и липидных наночастиц;
полимеризованные липиды (полимерные липосомы);
термически или химически модифицированный сывороточный альбумин;
химически модифицированные полисахариды (например, диальдегидкрахмал);
биодеструктирующиеся, т.е. распадающиеся постепенно в организме, полимеры и сополимеры (полиалкилцианоакрилаты, полиллактидгликолиды).
Нанокристаллы по сравнению с другими наносистемами имеют следующие преимущества:
100%) степень содержания ЛВ;
простая и предсказуемая подача ЛВ (скорость высвобождения растворимого ЛВ зависит от скорости растворения нанокристаллов);
распределение ЛВ в организме происходит как обычно;
простой и эффективный способ производства.
Обладая большой удельной поверхностью, нанокапсулы особенно пригодны для труднорастворимых ЛВ. При пероральном введении увеличивается абсолютная биодоступность, уменьшаются индивидуальная вариабельность и эффект потребленной пищи. Максимальная концентрация ЛВ в плазме достигается быстрее. Добавляемые иногда биостабилизаторы не только стабилизируют нанокристаллы (например, от агрегации), но и дают возможность контролировать их распределение в организме, время транспорта через желудочно-кишечный тракт, а также биоадгезию, т.е. прилипание к стенкам кишечника в определенном месте (мишени). Уменьшается терапевтическая доза ЛВ. Актуально применение нанокристаллов для анальгетиков, когда быстрое подавление боли и уменьшение вариабельности концентрации ЛВ в плазме играют решающую роль. Например, дисперсия нанокристаллов напроксена через 20 мин дает в 3-5 раз большую концентрацию ЛВ в плазме по сравнению с обычной суспензией или таблетками ЛВ и меньшую зависимость от содержимого желудка.
Нанокристаллы ЛВ часто включают в макрокапсулы, матричные таблетки и т.д. Добавление биоспецифических мукоадгезивов (веществ, склеивающихся со слизистой оболочкой) позволяет локализовать действие нанокристаллов ЛВ в определенной области желудочно-кишечного тракта.
Для плохо растворимых ЛВ суспензия нанокристаллов ведет себя аналогично раствору и может быть использована в аэрозолях, например для дипропионата беклометазона. Инъекционное введение нанокристаллов дает более длительное удержание ЛВ в месте введения, позволяет контролировать биораспределение ЛВ в организме и избежать поглощения ЛВ фагоцитирующими клетками.
2 Липосомы
Липосомы - это искусственно получаемые, замкнутые сферические частицы, образованные биомалекулярными липидными слоями, чаще всего фосфолипидами, в пространстве между которыми содержиться сфера формирования.
Липосомы подразделяются на:
1. мультитламелярные с диаметром 500-600 нм
2. моноламелярные с диаметром 200-1000 нм
3. малые моноламелярные с диаметром 25-50 нм
Для приготовления липосом обычно используют фосфолипиды.
Многослойные липосомы легко образуются при встряхивании водной дисперсии набухшего липида. При этом получается взвесь липосом с широким распределением частиц по размерам. Сравнительно гомогенную дисперсию липосом можно получить, пропустив их через поликарбонатные фильтры с заданным размером пор. Расстояние между соседними липидными бислоями составляет 2-3 нм, но может возрастать до 20 нм и более в случае заряженных бислоев. На 1 моль липида многослойные липосомы содержат 1-4 л воды. Они обладают свойствами идеального осмометра, меняя свой объем в ответ на изменение концентрации веществ в окружающей водной среде.
Малые моноламеллярные липосомы получают из многослойных при обработке их ультразвуком, при впрыскивании спиртового раствора липидов в водную среду, продавливанием под большим давлением воднолипидных дисперсий через небольшое отверстие, а также удалением детергента, солюбилизирующего липид, диализом или гель-фильтрацией. Такие липосомы содержат 0,2-1,5 л воды на 1 моль липида. Малые моноламеллярные липосомы не обладают осмотической активностью и не коагулируют в течение длительного времени.
Большие моноламеллярные липосомы имеют значительный внутренний объем воды (8-14 л на 1 моль липида) и обладают осмотической активностью. Обычно их получают удалением солюбилизирующего детергента в условиях контролируемого диализа или впрыскиванием раствора липида в легколетучем растворителе (диэтиловый эфир, петролейный эфир, пентан) в подогретую до 60°С воду.
Крупные однослойные липосомы могут быть также получены из малых липосом путем их слияния под действием Са2+ или в условиях термотропного фазового перехода. Получены также липосомы, образованные липидами (или подобными молекулами), которые способны полимеризоваться (содержат обычно связи С-С или ).
Полимеризация может осуществляться как в гидрофобной, так и в гидрофильной области бислоя и приводить к так называемым полимерным липосомам. Последние отличаются от обычных липосом большей стабильностью.
Липосомы широко используют в качестве модельных систем при изучении принципов молекулярной организации и механизмов функционирования биологических мембран. Они пригодны для изучения пассивного транспорта ионов и малых молекул через липидный бислой. Изменяя состав липидов в липосомах, можно направленно менять свойства мембран. Включением мембранных белков в липидный бислой получают так называемые протеолипосомы, которые используют для моделирования разнообразных ферментативных, транспортных и рецепторных функций клеточных мембран.
Липосомы используют также в иммунологических исследованиях, вводя в них различные антигены или ковалентно присоединяя к липосомам антитела. Они представляют собой удобную модель для изучения действия на мембраны многих лекарственных средств и других биологически активных веществ. Во внутренний водный объем липосом (в т. ч. полимерных) можно включать лекарства, пептиды, белки и нуклеиновые кислоты, что создает возможность практического применения липосом в качестве средства доставки разных веществ в определенные органы и ткани.
Наносфера – носитель, в котором равномерно распределено лекарственное средство.
В адресной доставке лекарств используются наночастицы – носители, размер которых не должен быть более одного микрона (тысячи нанометров). Системы доставки создаются путем помещения ЛС либо в нанокапсулу, в которой лекарство находится в полости, окруженной проницаемой мембраной, либо в наносферу, в которой лекарство диспергировано по всему объему. Существенным преимуществом таких систем доставки является защита активных лекарственных средств от распада и метаболизма. Также системы доставки получают путем связывания ЛС с поверхностью носителя– наночастицы, в этом случае оно не защищено от распада в организме под воздействием среды. При этом могут быть созданы сложные конъюгаты, состоящие из носителя, к которому присоединены молекулы фармацевтической субстанции, вектор, отвечающий за направленный транспорт, иногда фрагмент, обеспечивающий возможность отслеживания конъюгата, а также молекулы ПАВ на поверхности наночастиц, снижающие узнаваемость наночастиц макрофагами.
В качестве носителей ЛС выступают липосомы, полимерные наночастицы, углеродные наночастицы, клетки крови, наночастицы металлов, оксидов и др. Наночастицы в качестве носителей должны иметь малый размер и обеспечивать повышенную биодоступность фармацевтических субстанций. Широкий выбор носителей позволяет создавать системы доставки с варьированием скорости и места высвобождения ЛС.
Таким образом, создание систем доставки ЛС является актуальной научной и практически значимой задачей. В настоящем учебном пособии прослежены основные этапы становления области фармакологии и фармации «направленный транспорт лекарственных средств», рассмотрено современное состояние научных и практических достижений в этой области и сделана попытка прогнозирования тенденций дальнейшего развития этого направления.
В зависимости от агрегатного состояния и морфологических особенностей выделяют такие наночастицы: нанокристаллы, нанокапсулы, наносферы и полимерные мицеллы.
Нанокапсулы - липосомы (контейнеры для доставки лекарственных средств) нетоксичны, при определенных условиях могут поглощаться клетками. Мембрана липосомы может сливаться с клеточной мембраной, что приводит к внутриклеточной доставке их содержимого. Липосомы могут использоваться для транспортировки как гидрофильных, так и гидрофобных лекарственных веществ.
В зависимости от липидного состава, поверхностного заряда и размеров изменяются физико-химические свойства липосом и их биофармацевтические характеристики - такие, как скорость клиренса с участка инъекции и из плазмы крови, доставка к органу-мишени. Липосомы различного липидного состава включают в себя разное количество лекарственного вещества. Степень включения лекарственных веществ в липосомы зависит от строения, размеров, заряда, липидного состава липосом, а также от физико-химических свойств самих лекарственных веществ. Попав в организм, липосомы под воздействием различных систем разрушаются, высвобождая содержимое. В связи с этим возможность использования липосом в качестве носителей лекарств в значительной степени определяется быстротой разрушения липосом в организме.
На терапевтическую активность липосом как средства доставки лекарственного вещества большое влияние оказывают ее размер, строение липидного слоя и соотношение лекарственное вещество-липид. От размеров липосом и продолжительности их обработки ультразвуком зависят концентрация лекарственных веществ, включенных в них, и их распределение в организме. Вещество, заключенное в липосомы, защищено от воздействия ферментов, что увеличивает эффективность препаратов, подверженных биодеструкции в биологических жидкостях.
Преимуществом наночастиц как лекарственной формы является постепенное высвобождение лекарственного вещества, инкорпорированного в них, что увеличивает время его действия. Этот эффект наблюдался у препаратов ДОФА, инулина, цефазолина. Степень же фармакологического действия лекарственных веществ зависит от химического состава липосом. Одно из важных свойств липосом (как и других наночастиц) - соотношение размеров наночастиц и диаметра пор капилляров - стало основой для создания эффективных антираковых препаратов.Так как размер наночастиц больше диаметра пор капилляров,их объем распределения ограничивается областью введения. Например, при внутривенном введении они не выходят за пределы кровотока, то есть плохо проникают в органы и ткани. В результате резко понижается токсическое действие субстанции, ассоциированной с наночастицами. Это свойство послужило основой для направленной доставки химиотерапевтических препаратов в опухоли и очагивоспаления. Так как капилляры, снабжающие эти области кровью, как правило, сильно перфорированы, то наночастицы будут накапливаться в опухоли. Данное явление получило название - пассивное нацеливание.
Таким образом, существуют две причины, вследствие которых липосомальные препараты антиканцерогенных субстанций очень эффективны: уменьшение токсичности и пассивное нацеливание. Доказано, что липосомальные препараты обладают более пролонгированным действием, они менее токсичны, чем растворы, так как в меньшей степени накапливаются в органах, тогда как в крови их концентрация выше. Липосомы в незначительном количестве проникают в миокард и скелетные мышцы, вероятно, вследствие особенностей строения эндотелия этих органов. Они не поступают в систему органов выделения и поэтому не подвергаются гломерулярной фильтрации.
Наночастицы, включая НАНОСФЕРЫ и НАНОКАПСУЛЫ, могут быть аморфными или кристаллическими, а также иметь кристаллическое ядро и аморфную оболочку. Они способны адсорбировать и/или инкапсулировать лекарственный препарат, таким образом, защищая его от химической и ферментативной деградации. В нанокапсулах лекарство ограничено полостью, окруженной мембраной, в то время как наносферы являются матричными системами, внутри которых лекарство физически и однородно диспергировано. Недостаток наносфер заключается в том, что нельзя включать ЛВ, нерастворимые в липидах.
НАНОКАПСУЛЫ получают полимеризацией мицелл. Размер от 10 до 1000 нм. Наиболее распространенным механизмом связывания ЛВ, является адсорбция на осажденных частицах. При определенных усло виях (температура, pH среды, скорость перемешивания) солюбилизированный раствор ЛВ взаимодействует с полимером.
Используют биоразрушаемые полимеры: полисорбат-90, полиал-килцианакрилат, полиизобутилцианакрил, декстраны, альбумины сыворотки крови, желатин и др. Последние три полимера могут вызывать анафилактический шок при многократном введении. В организме Л В выделяется из наночастиц в результате десорбции с поверхности, диффузии из полимерной матрицы, а также в результате эрозии (биодеградации) матрицы. Препараты на основе таких частиц являются достаточно стабильными, их можно стерилизовать и хранить в лиофилизированном виде.
В настоящее время разработаны нанокапсулы с инсулином, фенобарбиталом, антибиотиками (доксорубицин) и др.
Капсулы. Современное состояние и перспективы развития.
Капсулы (от лат. capsula — футляр, оболочка, коробочка) — дозированная лекарственная форма, состоящая из лекарственного средства, заключённого в оболочку.
Чаще они предназначаются для приёма внутрь, реже для ректального, вагинального и других способов введения.
Основные цели процесса микрокапсулирования – это предохранение действующих веществ от воздействия внешних факторов, уменьшение летучести веществ, разделение веществ, способных к взаимодействию, уменьшение раздражающего действия, превращение газов и жидкостей в псевдотвердое тело, пролонгирование действия лекарственных средств.
Термин «микрокапсулирование» появился в технологической литературе в начале 60-х годов. С тех пор отмечается тенденция роста интереса к вопросам получения микрокапсул лекарственных веществ. Об этом свидетельствуют многочисленные публикации по данной проблеме, как у нас, так и за рубежом [8, 9, 14, 16, 22].
Микрокапсулы - капсулы, состоящие из тонкой оболочки из полимерного или другого материала, шарообразной или неправильной формы, размером от 1 до 2000 мкм, содержащей твердые или жидкие активные действующие вещества с добавлением или без добавления вспомогательных веществ (ОСТ91500.05.001-00) [15]. Чаще всего применяют микрокапсулы размером от 100 до 500 мкм. Частицы размером < 1 мкм называют нанокапсулами [25].
Микрокапсулы в настоящее время нашли применение в различных отраслях. В сельском хозяйстве и в быту широко используются микрокапсулированные инсектициды [9]. Микрокапсулы с витаминами, эфирными и жирными маслами входят в состав различных косметических средств (кремов, гелей, сывороток) [23]. Микрокапсулированные пробиотики используются в кормах и кормовых добавках в ветеринарии [24].
Однако в фармацевтической промышленности микрокапсулы не находят такого широкого практического применения, хотя имеется очевидная перспектива их использования. С помощью микрокапсулирования можно решить следующие проблемы: уменьшить реакционную способность лекарственных веществ, удлинить сроки годности лабильных и быстро портящихся лекарственных веществ, снизить токсичность субстанции, придать субстанции новые физические свойства - снизить летучесть, изменить плотность, замаскировать цвет, вкус, запах. Микрокапсулы дают возможность обеспечить пролонгированность действия лекарственных препаратов [13, 25].
Важная область применения микрокапсулирования в фармации - совмещение в общей дозировке лекарственных веществ, несовместимых при смешении в свободном виде. Микрокапсулирование используется для разделения реагирующих между собой лекарственных веществ, объединенных в одной лекарственной форме [25].
Микрокапсулированием стабилизируют неустойчивые лекарственные препараты (витамины, антибиотики, вакцины, сыворотки, ферменты). Так, известны патенты в области микрокапсулирования цефалоспоринов в конжаковой камеди, бета-лактамных антибиотиков - канамицина в альгинате натрия, а также канамицина, ампициллина, бензилпенициллина в натрий-карбоксиметилцеллюлозе [4, 5].
Примером использования микрокапсулирования для увеличения стабильности лекарственных препаратов может служить заключение в оболочки экстрактов лекарственного растительного сырья [2].
Одной из основных задач микрокапсулирования является достижение пролонгированного действия при пероральном введении с одновременным снижением максимального уровня концентрации в организме. Этим способом удается уменьшить число приемов препарата, ликвидировать раздражающее действие на ткани, связанное с прилипанием таблеток к стенкам желудка [9, 25].
Примером использования микрокапсул для снижения токсичности является микрокапсулирование новокаинамида, ацетилсалициловой кислоты и других лекарственных средств. Итальянские ученые осуществили микрокапсулирование кетопрофена - плохо растворимого анальгетика, хорошо сорбирующегося из желудочно-кишечного тракта, но вызывающего раздражение, и это позволило уменьшить негативное влияние лекарственного препарата на организм
Таким образом, микрокапсулирование - это перспективный метод создания инновационных лекарственных форм с пролонгированным действием, позволяющий расширить номенклатуру лекарственных препаратов и изменить подходы к лечению отдельных социально значимых заболеваний - туберкулеза, онкозаболеваний, токсикомании, требующих длительной терапии достаточно токсичными веществами.
Суспензии. Характеристика. Факторы, обеспечивающие стабильность суспензий. Стабилизаторы, их качественный и количественный подбор.
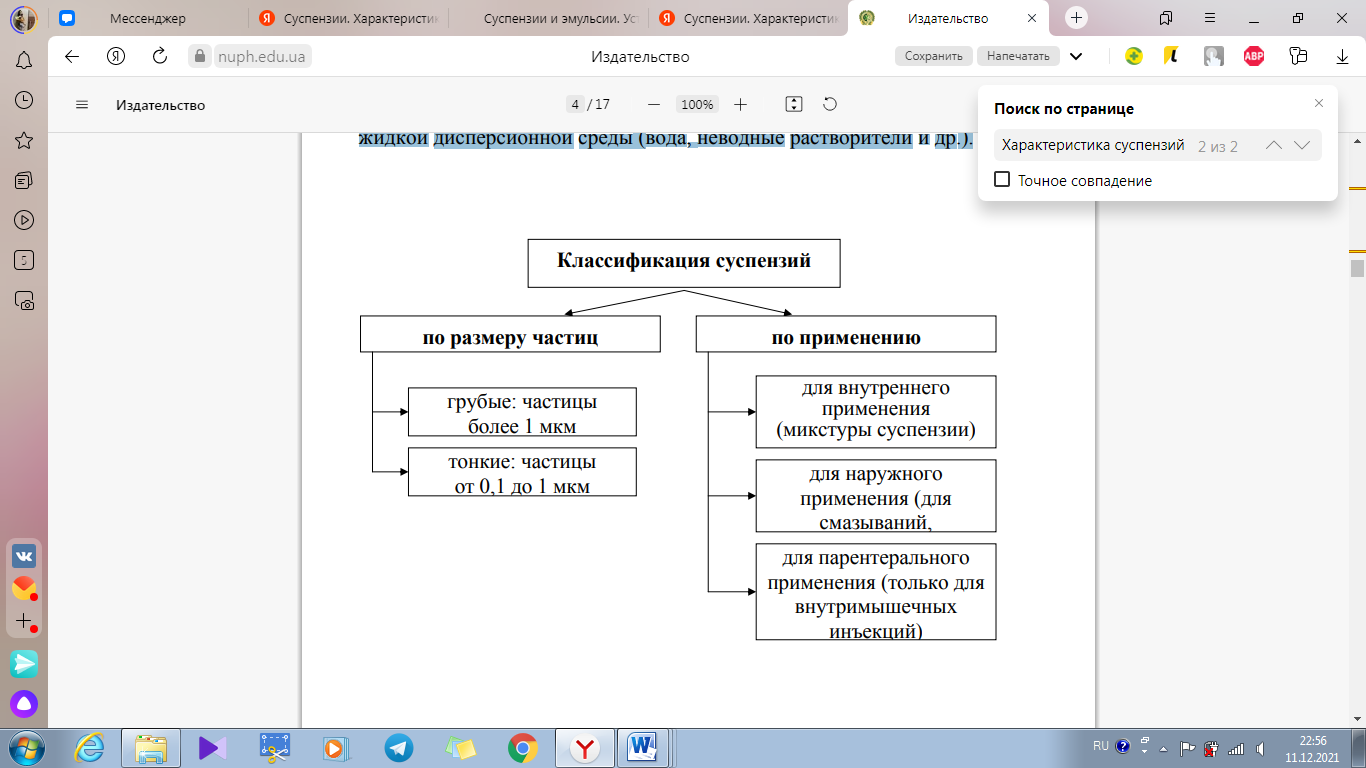
Суспензия — жидкая лекарственная форма, содержащая в качестве дисперсной фазы одно или несколько измельченных порошкообразных веществ, распределенных в жидкой дисперсионной среде. Суспензии выпускаются готовыми к применению или в виде порошков и гранул, предназначенных для приготовления суспензий, к которым перед применением прибавляют воду или другую жидкость. Размер частиц дисперсной фазы в суспензиях может быть в пределах от 0,1 до 1 мкм (в тонких суспензиях) или более 1 мкм (в грубодисперсных суспензиях).
По способу применения суспензии классифицируют: для внутреннего, наружного и парентерального. Суспензии для парентерального применения вводят в организм только внутримышечно. Не допускается изготовление суспензий, содержащих сильнодействующие и ядовитые вещества, употребление которых при неточном дозировании может привести к нежелательным последствиям.
Суспензии – жидкая лекарственная форма, содержащая в качестве дисперсной фазы одно или несколько мелкоизмельченных порошкообразных лекарственных веществ, распределенных в жидкой дисперсионной среде.
Суспензии (взвеси) – микрогетерогенные дисперсные системы, состоящие из твердой дисперсной фазы (лекарственные вещества) и жидкой дисперсионной среды (вода, неводные растворители и др.).

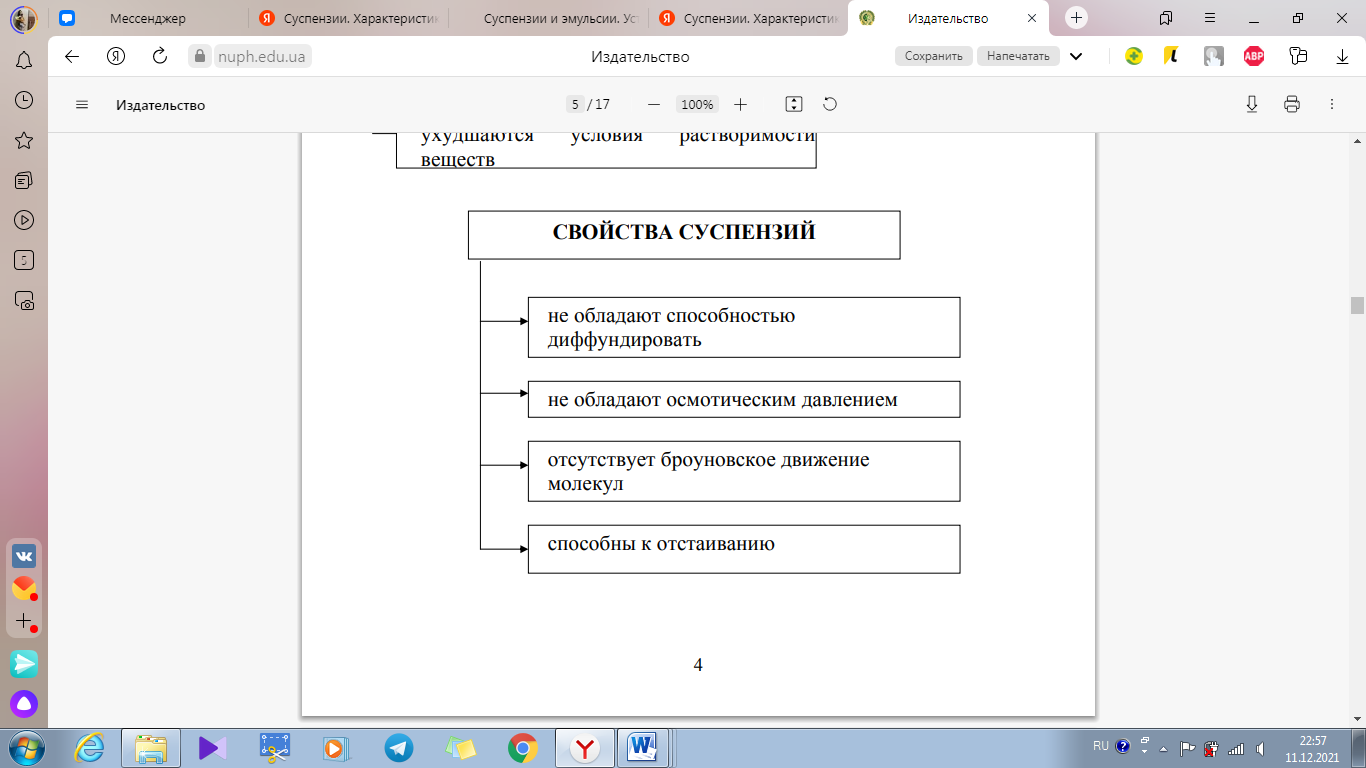
Флокуляция – всплывание больших хлопьевидных агрегатов гидрофобного вещества на поверхность воды.
Седиментация – оседание частиц лекарственного вещества.
Агрегативная устойчивость – это устойчивость против сцепления частиц.
Седиментационная устойчивость – это устойчивость против оседания частиц, связанных только с их размером.
Возможные факторы устойчивости: адсорбционно-сольватный, электростатический, структурно-механический, энтропийный, гидродинамический.
Если стабилизатор является ионогенным веществом, то обязательно действует электрический фактор устойчивости: на поверхности частиц образуется двойной электрический слой, возникает электрокинетический потенциал и соответствующие электростатические силы отталкивания, препятствующие слипанию частиц.
Суспензии гидрофобных веществ.
Различают 2 подгруппы:
1. С не резко выраженными гидрофобными свойствами (терпингидрат, фенилсалицилат, сульфаниламиды).
2. С резко выраженными гидрофобными свойствами (ментол, тимол, камфора, сера).
Суспензии гидрофобных веществ готовят со стабилизатором. В качестве стабилизатора используют растворы ВМС – желатозы (продукт частичного гидролиза желатина), абрикосовой камеди, крахмала, метилцеллюлозы и др. Желатозу используют чаще других.
На 1,0 вещества с нерезко выраженными гидрофобными свойствами используют 0,5 г желатозы, а с резко выраженными – 1,0 г желатозы.
Кроме лекарственного вещества и стабилизатора для приготовления пульпы берут жидкость в количестве равном полусумме гидрофобного вещества и стабилизатора.
Для предварительного измельчения трудно и затруднительно измельчаемых веществ используют эфир или этанол (аналогично порошкам).
Количество стабилизатора на 1,0 г гидрофобного вещества Количество стабилизатора, г
|
На 1,0 г вещества
|
с резко выраженными гидрофобными свойствами: камфора, ментол и др.
|
с нерезко выраженными гидрофобными свойствами: терпингидрат, фенилсалицилат и др.
|
Абрикосовая камедь
|
0,5
|
0,25
|
Желатоза
|
1,0
|
0,5
|
5% раствор метилцеллюлозы
|
2,0
|
1,0
|
Твин-80
|
0,2
|
0,1
|
Для получения устойчивых суспензий гидрофобных веществ необходимо введение вспомогательных веществ (стабилизаторов). В качестве стабилизаторов используются ВМС и ПАВ твин-80, поливинол, аэросил, эфиры целлюлозы, бентониты, детергенты. Выбор конкретного стабилизатора и его количество обусловлен свойствами стабилизирующего вещества, степенью его гидрофобности. Для стабилизации лекарственных веществ с резко выраженными гидрофобными свойствами обычно в аптечной практике используют желатозу в соотношении 1:1, а с нерезко выраженными свойствами - 1:0,5.
Технологические схемы получения суспензий различными методами.
Технологическая схема получения суспензий
1 стадия. Подготовительная стадия.
1) устанавливают факт наличия суспензии на основании конкретных свойств веществ;
2) определяют концентрацию твердой суспендируемой фазы - от ее количества зависит способ получения суспензии. Согласно приказу МЗ РФ № 308 от 21.10.97 г. суспензии с содержанием нерастворимых твердых ЛВ до 3% готовятся массообъемным способом, а 3 и более % изготавливают по массе;
3) определяют к какой группе относится суспендируемые вещества:
- если гидрофильные - стабилизатор не требуется
- если гидрофобные - проводят расчет стабилизатора.
С нерезко выраженными свойствами - на 1 г вещества добавляют 0,5 г желатозы или аравийской камеди; 0,1 г твина-80; 0,25 г абрикосовой камеди.
Для веществ с резко выраженными свойствами добавляют эти же стабилизаторы, но в соотношении 1:1, твина-80 в 2 раза больше, т.е. 0,2 г на 1 г ЛВ, также в качестве стабилизатора используется 5 % раствор МЦ.
4) определяют общий объем ЛФ (он может быть в мл или в г). Сахарный сироп и этанол могут быть выписаны и в г, и в мл. Перевод осуществляется через плотность.
2 стадия. Подготовка дисперсионной среды путем растворения сухих растворимых веществ (если таковые имеются). После растворения солевой раствор фильтруется.
3 стадия. Собственно суспендирование.
Производство суспензий должно обязательно проходить стадию первичной пульпы, когда твердая фаза измельчается в присутствии оптимального количества жидкой фазы. Наивысшая степень дисперсности достигается при оптимальном соотношении дисперсной фазы и дисперсионной среды, называемом правилом Дерягина. Соотношение твердая фаза/жидкая фаза = 1,6:2,5, т.е. 0,4 - 0,6 мл жидкости на 1,0 г измельчаемой твердой фазы. При указанном соотношении обеспечивается максимальное трение частиц друг о друга и от поверхности пестика и ступки.
Кроме того, при выполнении этого правила смачивающая дисперсионная среда оказывает максимальное расклинивающее действие, так называемый эффект Ребиндера, способствующее измельчению, т.к. образование микротрещин служит главной причиной понижения прочности твердых тел. Следует иметь ввиду, что активным расклинивающим действием обладают лишь смачивающие жидкости.
В случаях, если дисперсионная среда преобладает над дисперсной фазой более чем в 15-30 раз (т.е. содержание твердой фазы не более 3%), то используют разновидность метода диспергирования - прием взмучивания, который заключается в следующем: полученную тончайшую пульпу разбавляют небольшим количеством (5-10-ти кратным) дисперсионной среды и оставляют на некоторое время в покое (2-3 мин.). При этом полученная полидисперсная система быстро разделяется на 2 слоя грубо- и мелкодисперсный. Грубые, недостаточно диспергированные частицы быстро выделяются в осадок, в то время как тонкие частицы остаются во взвешенном состоянии.
Тонкую суспензию сливают с осадка в отпускной флакон, осадок вновь тщательно растирают, вновь разбавляют новой порцией жидкости, отстаивают и сливают с осадка. Эту операцию повторяют до тех пор, пока вся дисперсная фаза не перейдет в тонкую суспензию. При правильном приготовлении весь осадок должен перейти во взвешенное состояние после добавления последней порции жидкости, указанной в рецепте.
Эмульсии. Характеристика. Факторы, влияющие на стабильность эмульсий. Вспомогательные вещества в технологии эмульсий.
1. Характеристика эмульсии
Эмульсии – однородная по внешнему виду лекарственная форма, состоящая из взаимно нерастворимых тонко диспергированных жидкостей, предназначенная для внутреннего, наружного или парентерального применения.
Эмульсии – микрогетерогенные системы, состоящие из взаимно не растворимых, тонко диспергированных жидкостей, чаще всего воды и масла. Эмульсии представляют собой грубодисперсные системы, в которых жидкость, взвешенная в виде капелек, называется дисперсной фазой, а жидкость, в которой распределена дисперсная фаза, называется дисперсионной средой.
2. Достоинства эмульсий:
возможность назначать в одной лекарственной форме несмешивающиеся жидкости, что очень важно для точности их дозировки;
с раздроблением масла увеличивается его свободная поверхность, что способствует более быстрому действию лекарственных веществ, растворенных в нем, а также ускоряется процесс гидролиза жиров ферментами желудочно-кишечного тракта, что ведет к более быстрому терапевтическому эффекту;
в эмульсиях имеется возможность смягчить раздражающее действие на слизистую оболочку желудка некоторых лекарственных веществ;
имеется возможность маскировки неприятного вкуса и запаха жирных и эфирных масел, смол, бальзамов и некоторых лекарственных средств, облегчается прием вязких масел, которые плохо дозируются;
эмульсии являются ценными лекарственными средствами в детской фармакотерапии.
3. Недостатки эмульсий:
малая стойкость, т.к. они быстро разрушаются под влиянием различных факторов;
эмульсии являются благоприятной средой для развития микроорганизмов;
относительная длительность приготовления (при этом требуются соответствующие технологические приемы, практический опыт);
необходимость применения эмульгаторов, чтобы удержать фазу в диспергированном состоянии
Устойчивость эмульсий зависит от следующих факторов:
– наличия стабилизатора, способного существенно понизить свободную энергию на границе раздела фаз;
– степени покрытия поверхности капель эмульсии адсорбированными молекулами ПАВ или высокомолекулярного соединения.
Устойчивыми становятся эмульсии, поверхность капель в которых покрыта адсорбционным слоем стабилизатора не менее чем на 60 %.
Предельно устойчивые эмульсии получаются при полном насыщении адсорбционного слоя и механической прочности адсорбционной пленки или слоя бронирующего стабилизатора.
Эмульгаторы'>Вспомогательные вещества, применяемые в технологии эмульсий
Термодинамическая устойчивость эмульсий обеспечивается введением в их состав эмульгаторов.
Эмульгаторы - вещества, молекулы которых состоят из липофильной и гидрофильной частей. Распределяясь на границе раздела фаз, эмульгаторы снижают поверхностное натяжение капель жидкости, тем самым стабилизируют эмульсии от расслоения.
Наиболее часто в технологии эмульсий используются следующие эмульгаторы:
- природные: желатоза, камеди, сухое молоко, яичный порошок, трагакант;
- синтетические: лаурилсульфат натрия, натрия додецилсульфосукцинат и производные сорбитана олеата: Span? и Tween?;
- полусинтетические: натрия КMЦ, MЦ (табл. 21.1). Свойства эмульгаторов представлены в главе 4 «Вспомогательные
вещества».
Таблица 21.1. Соотношение количества эмульгатора и масляной фазы для получения эмульсий
Эмульгатор
|
Количество эмульгатора (г) на 10,0 г масляной фазы
|
Желатоза
|
5,0
|
Эмульгатор Т-2
|
1,5
|
Твин-80
|
2,0
|
Mетилцеллюлоза
|
1,0 (в виде 2% раствора)
|
Крахмал
|
5,0 (в виде 10% клейстера)
|
Сухое молоко
|
10,0
|
Бентониты
|
1,75
|
Камеди, в том числе: акации, гуары
|
3,0-5,0
|
Яичный желток (порошок)
|
5,0
|
Промышленное получение эмульсий, используемая аппаратура.
|
 Скачать 1.82 Mb.
Скачать 1.82 Mb.






