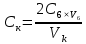Применение воды очищенной в фармацевтическом производстве. Краткая характеристика контролируемого процесса 5 офс
 Скачать 183.33 Kb. Скачать 183.33 Kb.
|
Установление точной концентрации растворов соляной кислотыОтбирают пипеткой с одной отметкой 10 см3 раствора кислоты с концентрацией 0,05 моль/дм3 или 25 см3 раствора с концентрацией 0,02 моль/дм3, переносят в коническую колбу, добавляют соответственно 90 см3 или 75 см3 очищенной воды и 10 капель раствора смешанного индикатора. Титруют раствором буры из бюретки вместимостью 10 см до перехода окраски раствора от малиновой к интенсивно зеленой. В случае использования в лаборатории измерений по варианту 1, точную концентрацию растворов кислоты можно установить потенциометрическим титрованием. Для этого 10 см3 раствора кислоты с концентрацией 0,05 моль/дм3 или 25 см раствора с концентрацией 0,02 моль/дм3 помещают в стакан вместимостью (100 - 150) см3, добавляют очищенную воду и приливают раствор буры до (3,9 ± 0,2) ед. pH. Затем прибавляют раствор буры по 1 - 2 капли до (4,50 ± 0,05) ед. pH. Титрование повторяют и, если расхождение в объемах раствора буры не превышает 0,05 см3, за результат принимают среднее арифметическое значение объёмов. В противном случае повторяют титрование до получения объёмов, различающихся не более, чем на 0,05 см3. Точную концентрацию растворов кислоты рассчитывают по формуле:
где Ск - концентрация раствора соляной кислоты, моль/дм3; Сб - концентрация раствора буры, моль/дм3; Vб - объём раствора буры, израсходованный на титрование, см3; Vк - объём раствора соляной кислоты, взятый для титрования, см3. Устранение мешающих влиянийПри анализе проб сточных вод по варианту 1 поверхность электродов может загрязняться жирами, нефтепродуктами, ПАВ и другими пленкообразующими веществами. Это проявляется в замедлении изменения pH при добавлении титранта, вследствие чего требуется более 1,5 - 2 мин для установления равновесия. При анализе таких проб электроды надо регулярно очищать растворителями, указанными в инструкции по эксплуатации электродов, а при отсутствии указаний - этиловым спиртом. Измерениям по варианту 2 мешают мутность и взвешенные вещества и окраска проб воды, а также наличие в ней свободного хлора, которые затрудняют фиксацию изменения окраски индикатора. Мешающее влияние взвешенных веществ устраняют фильтрованием через воронку ВФ с пористым стеклянным фильтром, бумажный или мембранный фильтр 0,45 мкм. Первые (15 - 20) см3 фильтрата отбрасывают. При окраске пробы воды, не позволяющей чётко зафиксировать изменение окраски индикатора, следует выполнять измерения по варианту 1. Свободный хлор в концентрациях свыше 0,5 мг/дм3 связывают добавлением к пробе раствора тиосульфата натрия из расчёта, что 0,1 см3 раствора тиосульфата натрия концентрацией 0,1 моль/дм3 удаляет 0,35 мг свободного хлора в пробе. Выполнение измерений по варианту 1В стакан вместимостью (100 - 150) см3 отбирают пипеткой с одной отметкой аликвоту анализируемой воды в соответствии с таблицей 2. Таблица 2 - Объём аликвоты пробы воды, отбираемый для измерения концентрации гидрокарбонатов, и используемые концентрации раствора соляной кислоты
Аликвоту объемом 100 см3 допускается вместо пипетки отбирать мерным цилиндром, предварительно проверенным на точность градуировки способом калибрования мерной посуды, рассчитанной на выливание. Если требуется аликвота пробы 25 см3, то добавляют к ней очищенную воду до 50 см3. Стакан с пробой помещают на магнитную мешалку, опускают в раствор якорь мешалки и электроды и измеряют исходное значение pH пробы. Если pH пробы не превышает (8,30 ± 0,05) ед. pH, опускают наконечник бюретки в пробу и титруют при постоянном перемешивании раствором кислоты из бюретки вместимостью 5 см3 или 10 см3 в зависимости от предполагаемой концентрации гидрокарбонатов. До достижения pH около 5 раствор кислоты добавляют быстро, далее добавляют по каплям и ожидают установления равновесия (30 - 90) с при (4,50 ± 0,05) ед. pH. Регистрируют израсходованный объем раствора кислоты. Повторяют титрование с такой же аликвотой пробы и, если расхождение между параллельными титрованиями не превышает 0,05 см3 при концентрации кислоты 0,02 моль/дм3 и 0,1 см3 при концентрации кислоты 0,05 моль/дм3, за результат принимают среднее арифметическое значение объемов раствора кислоты. При расходе на титрование менее 2,0 см3 кислоты концентрацией 0,05 моль/дм3 титрование проводят заново, используя раствор кислоты концентрацией 0,02 моль/дм3, или увеличивают объём аликвоты пробы. Если при использовании бюретки вместимостью 10 см3 на титрование пробы расходуется более 10 см3 кислоты концентрацией 0,05 моль/дм3, титрование проводят заново из бюретки вместимостью 25 см3. Если pH пробы воды превышает (8,30 ± 0,05) ед. pH, проводят титрование медленно, добавляя раствор кислоты по каплям, и, по достижении (8,30 ± 0,05) ед. pH, регистрируют израсходованный объем раствора кислоты. Далее продолжают титрование до (4,50 ± 0,05) ед. pH и регистрируют общий израсходованный объём кислоты. Повторяют титрование с такой же аликвотой пробы и, если расхождение между параллельными титрованиями не превышает 0,05 см3 при концентрации кислоты 0,02 моль/дм3 и 0,1 см3 при концентрации кислоты 0,05 моль/дм3, за результат принимают среднее значение объемов раствора кислоты. Если расхождение объемов титранта между параллельными титрованиями больше указанных выше значений, рассчитывают массовую концентрацию гидрокарбонатов для каждого параллельного титрования и оценивают приемлемость результатов измерений, сравнивая расхождение с пределом повторяемости r .В случае неприемлемости результатов измерений устанавливают и устраняют причины недопустимого расхождения. |