Курс лекций по общей микробиологии основам вирусологии двух частях
 Скачать 4.07 Mb. Скачать 4.07 Mb.
|
|
Интегративный тип взаимодействия (вирогения). Характеризует-ся встраиванием (интеграцией) нуклеиновой кислоты вируса в хромосому клетки. При этом вирусный геном реплицируется и функционирует как со-ставная часть клеточного генома. Интеграция вирусного генетического ма-териала с ДНК клетки характерна для определенных групп вирусов: бакте-риофагов, опухолеродных (онкогенных) вирусов, некоторых инфекцион-ных вирусов (вирус гепатита В, аденовирус, ВИЧ). Для интеграции с хро-мосомой клетки необходима кольцевая форма двунитчатой вирусной ДНК. ДНК-содержащих вирусов (вирус гепатита В) их ДНК обладает свойст-вом встраиваться в геном клетки при участии ряда ферментов. У некото-рых РНК-содержащих вирусов (ВИЧ, онкогенные вирусы) процесс инте-грации более сложный и является обязательным в цикле их репродукции. этих вирусов сначала на матрице РНК с помощью вирусспецифического фермента обратной транскриптазы (ревертазы) синтезируется ДНК-копия, которая затем встраивается в ДНК клетки. ДНК вируса, находящаяся в со-ставе хромосомы клетки, называется ДНК-провирусом. При делении клет-ки, сохраняющей свои нормальные функции, ДНК-провирус переходит в геном дочерних клеток, то есть состояние вирогении наследуется. ДНК-провирус несет дополнительную генетическую информацию, в результате чего клетки приобретают ряд новых свойств. Так, интеграция может явиться причиной возникновения ряда аутоиммунных и хронических забо- 90 леваний, разнообразных опухолей. Под воздействием ряда физических и химических факторов ДНК-провирус может исключаться из клеточной хромосомы и переходить в автономное состояние, что ведет к репродукции вируса. КУЛЬТИВИРОВАНИЕ И ИНДИКАЦИЯ ВИРУСОВ Культивирование вирусов человека и животных проводят с целью лабораторной диагностики вирусных инфекций, для изучения вопросов патогенеза и иммунитета, получения диагностических и вакцинных препа-ратов, применяют в научно-исследовательской работе. Поскольку вирусы являются абсолютными паразитами, их культивируют или на уровне орга-низма, или на уровне живых клеток, выращиваемых вне организма в ис-кусственных условиях. В качестве биологических моделей для культиви-рования используют лабораторных животных, развивающиеся куриные эмбрионы и культуры клеток. Лабораторные животные (белые мыши, хлопковые крысы, кролики, хомяки, обезьяны и др.) в начальный период развития вирусологии были единственной экспериментальной биологической моделью, которую ис-пользовали для размножения и изучения свойств вирусов. На основании развития типичных признаков заболевания и патоморфологических изме-нений органов животных можно судить о репродукции вирусов, то есть проводить индикацию вирусов. В настоящее время применение этой моде-ли для диагностики ограничено из-за невосприимчивости животных ко многим вирусам человека. Куриные эмбрионы предложены в качестве экспериментальной мо-дели для культивирования вирусов в середине 30-х гг. прошлого века Ф. Бернетом. К достоинствам модели относятся возможность накопления вирусов в больших количествах, стерильность объекта, отсутствие скры-тых вирусных инфекций, простота техники работы. Для культивирования вирусов исследуемый материал вводят в различные полости и ткани кури-ного зародыша. Индикацию вирусов осуществляют по характеру специфических по-ражений оболочек и тела эмбриона, а также феномену гемагглютинации - склеиванию эритроцитов. Явление гемагглютинации впервые было обна-ружено в 1941 г. при культивировании в куриных эмбрионах вирусов гриппа. Позднее было установлено, что гемагглютинирующими свойства-ми обладают многие вирусы. На основе этого феномена была разработана 91 техника реакции гемагглютинации (РГА) вне организма (in vitro), которая широко применяется для лабораторной диагностики вирусных инфекций. Куриные эмбрионы не являются универсальной биологической моделью для вирусов. Почти неограниченные возможности появились у вирусоло-гов после открытия метода выращивания культур клеток. Метод культур клеток - выращивание различных клеток и тканей вне организма на искусственных питательных средах - разработан в 1950-х гг. Дж. Эндерсом с сотрудниками. Подавляющее большинство вирусов спо-собно размножаться на культурах клеток. Для приготовления таких куль-тур используют самые разнообразные ткани человека, животных и птиц. Большое распространение получили культуры клеток из эмбриональных и опухолевых (злокачественно перерожденных) тканей, обладающих по сравнению с нормальной тканью взрослого организма более активной спо-собностью к росту и размножению. В зависимости от техники приготовле-ния и культивирования различают три типа культур клеток и тканей: одно-слойные культуры клеток; культуры суспензированных клеток; органные культуры. Наибольшее практическое применение получили однослойные куль-туры, растущие на поверхности стекла лабораторной посуды в виде моно-слоя клеток. Однослойные культуры клеток в зависимости от числа жизне-способных генераций, в свою очередь, подразделяются на первичные, или первично-трипсинизированные (способны размножаться однократно), пе-ревиваемые, или стабильные (способны перевиваться в лабораторных ус-ловиях в течение неопределенно длительного срока), и полуперевиваемые (способны размножаться в течение 40-50 пассажей). Культуры суспензи-рованных клеток растут и размножаются во взвешенном состоянии при постоянном интенсивном перемешивании среды. Они могут быть исполь-зованы для накопления большого количества вирусов. Некоторые вирусы лучше размножаются в органных культурах, которые представляют собой кусочки органов животного и человека, выращиваемых вне организма и сохраняющих свойственную данному органу структуру. В зависимости от свойств вируса подбирают наиболее чувствительную к данному вирусу культуру клеток, на которой возможна его репродукция. размножении вирусов в культуре клеток свидетельствуют сле-дующие признаки: - цитопатический эффект; 92 образование в клетках включений; образование бляшек; феномен гемадсорбции; «цветная» реакция. Цитопатический эффект (ЦПЭ или ЦПД) - видимые под микроско-пом морфологические изменения клеток вплоть до их гибели, возникаю-щие в результате повреждающего действия вирусов. Характер ЦПЭ, вы-званного разными вирусами, неодинаков. Включения представляют собой скопления вирусных белков или клеточного материала, которые можно обнаружить в ядре или цитоплазме клеток при специальных методах окра-ски. Бляшки, или «негативные колонии» вирусов, - участки разрушенных вирусами клеток; их можно обнаружить при культивировании вирусов на однослойных клеточных культурах, покрытых тонким слоем агара. Бляш-ки, образуемые разными вирусами, отличаются по величине, форме, вре-мени появления, поэтому реакцию бляшкообразования используют для дифференциации вирусов. Феномен гемадсорбции - способность клеточ-ных культур, зараженных вирусом, адсорбировать на своей поверхности эритроциты. Механизмы реакций гемадсорбции и гемагглютинации сход-ны. Многие вирусы обладают гемадсорбирующими свойствами. «Цветная» реакция основана на разнице в цвете индикатора питательной среды, ис-пользуемой для культур клеток. При росте клеток, не пораженных виру-сом, накапливаются продукты метаболизма, что приводит к изменению цвета индикатора питательной среды. При репродукции вирусов в культу-ре нарушается нормальный метаболизм клеток и среда сохраняет первона-чальный цвет. БАКТЕРИОФАГИ Бактериофаги (от «бактерия» и греч. phagos - пожиратель) - вирусы бактерий, обладающие способностью специфически проникать в бактериаль-ные клетки, репродуцироваться в них и вызывать их растворение (лизис). История открытия бактериофагов связана с именем канадского ис-следователя Ф. д'Эрелля (1917 г.), который обнаружил эффект лизиса бак-терий, выделенных из испражнений больного дизентерией. Такие явления наблюдали и другие микробиологи (Н.Ф. Гамалея, 1898 г.; Ф. Туорт, 1915 г.), но лишь Ф. д'Эрелль, предположив, что имеет дело с вирусом, выделил этот «литический фактор» с помощью бактериальных фильтров и 93 назвал его бактериофагом. В дальнейшем выяснилось, что бактериофаги широко распространены в природе. Их обнаружили в воде, почве, пище-вых продуктах, различных выделениях организмов людей и животных, то есть там, где встречаются бактерии. В настоящее время эти вирусы выяв-лены у большинства бактерий как болезнетворных, так и неболезнетвор-ных, а также ряда других микроорганизмов (например грибов). Поэтому в широком смысле слова их стали называть просто фагами. Фаги различают-ся по форме, структурной организации, типу нуклеиновой кислоты и ха-рактеру взаимодействия с микробной клеткой. Морфология. Большинство фагов под электронным микроскопом имеют форму головастика или сперматозоида, некоторые - кубическую или нитевидную формы. Размеры фагов колеблются от 20 до 800 нм у ни-тевидных фагов. Наиболее полно изучены крупные бактериофаги, 65А 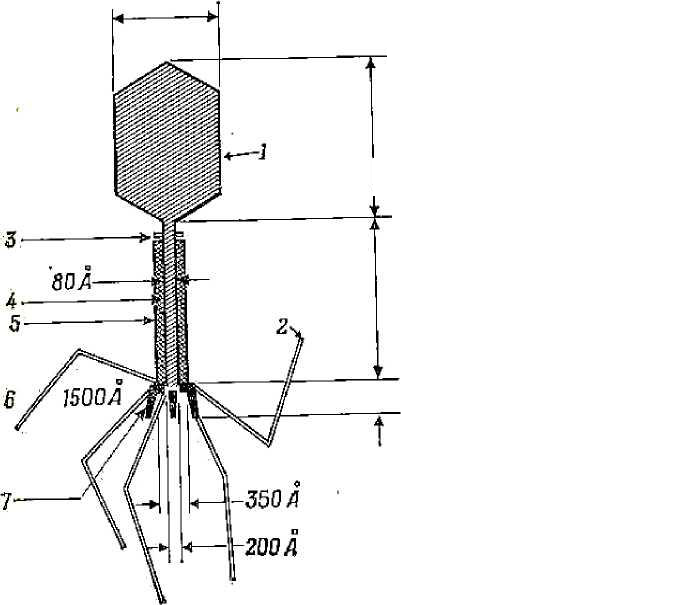 имеющие форму сперматозоида. Они состоят из вытянутой 950Л икосаэдрической головки размером 65 - 100 нм и хвостового А отростка длиной бо-
кращаться, фаги с короткими от- ростками, аналогами отростков, без отростка. 94 Химический состав. Фаги состоят из двух основных химических компонентов - нуклеиновой кислоты (ДНК или РНК) и белка. У фагов, имеющих форму сперматозоида, двунитчатая ДНК плотно упакована в ви-де спирали внутри головки. Белки входят в состав оболочки (капсида), ок-ружающей нуклеиновую кислоту, и во все структурные элементы хвосто-вого отростка. Структурные белки фага различаются по составу полипеп-тидов и представлены в виде множества идентичных субъединиц, уложен-ных по спиральному или кубическому типу симметрии. Кроме структур-ных белков, у некоторых фагов обнаружены внутренние (геномные) белки, связанные с нуклеиновой кислотой, и белки-ферменты (лизоцим, АТФ-аза), участвующие во взаимодействии фага с клеткой. Резистентно сть. Фаги более устойчивы к действию химических и физических факторов, чем бактерии. Ряд дезинфицирующих веществ (фе-нол, этиловый спирт, эфир и хлороформ) не оказывают существенного влияния на фаги. Высокочувствительны фаги к формалину и кислотам. Инактивация большинства фагов наступает при температуре 65 - 70 °С. Длительное время они сохраняются при высушивании в запаянных ампу-лах, замораживании при температуре -185 °С в глицерине. Взаимодействие фага с бактериальной клеткой. По механизму взаимодействия различают вирулентные и умеренные фаги. Вирулентные фаги, проникнув в бактериальную клетку,автономно репродуцируются вней и вызывают лизис бактерий. Процесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и похож на процесс взаимодействия вирусов человека и животных с клеткой хозяина. Однако у фагов, имеющих хвостовой отросток с сокращающимся чехлом, он имеет особенности. Эти фаги адсорбируются на поверхности бактериальной клетки с помощью фибрилл хвостового отростка. В результате активации фагового фермента АТФазы происходит сокращение чехла хвостового от-ростка и внедрение стержня в клетку. В процессе «прокалывания» клеточ-ной стенки бактерии принимает участие фермент лизоцим, находящийся на конце хвостового отростка. Вслед за этим ДНК фага, содержащаяся в головке, проходит через полость хвостового стержня и активно впрыски-вается в цитоплазму клетки. Остальные структурные элементы фага (кап-сид и отросток) остаются вне клетки (рис. 13). После биосинтеза фаговых компонентов и их самосборки в бактери-альной клетке накапливается до 200 новых фаговых частиц. Под действием 95 фагового лизоцима и внутриклеточного осмотического давления происхо-дит разрушение клеточной стенки, выход фагового потомства в окружаю-щую среду и лизис бактерии. Один литический цикл (от момента адсорб-ции фагов до их выхода из клетки) продолжается 3 0 - 4 0 мин. Процесс бактериофагии проходит несколько циклов, пока не будут лизированы все чувствительные к данному фагу бактерии. Инфекция Головка Фаг прикрепляется к  ДНК бактерии Отросток ДНК впрыскивается в бактерию Фаговая частица Ранняя стадия развития Поздняя стадия развития Синтез ферментов для регуляции ДНК 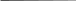    Начало репликации  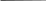 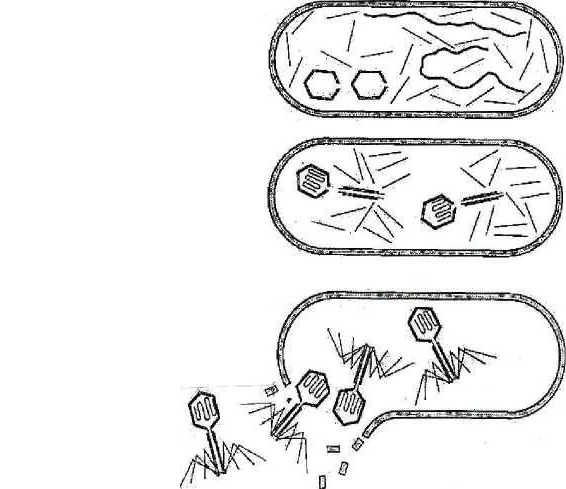 ДНК фага реплицируется синтезируются головки и отростки ДНК упаковывается в головки; к головкам присоединяются отростки Клетка разрушается с освобождением фагового потомства Рис. 13. Цикл литического развития фага 96 Взаимодействие фагов с бактериальной клеткой характеризуется оп-ределенной степенью специфичности. По специфичности действия разли-чают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий. Умеренные фаги лизируют не все клетки в популяции,с частью изних они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении репли-цируется синхронно с геномом бактерии, не вызывая ее лизиса, и переда-ется по наследству от клетки к клетке неограниченному числу потомков. Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая про-фаг, получила название лизогенной. Это название (от греч. lysis - разложе-ние, genea - происхождение) отражает способность профага самопроиз-вольно или под действием ряда физических и химических факторов ис-ключаться из хромосомы клетки и переходить в цитоплазму, то есть вести себя как вирулентный фаг, лизирующий бактерии. Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомоло-гичным или близкородственным фагом и, кроме того, приобретают допол-нительные свойства, которые находятся под контролем генов профага. Из-менение свойств микроорганизмов под влиянием профага получило назва-ние фаговой конверсии. Последняя имеет место у многих видов микроор-ганизмов и касается различных их свойств: культуральных, биохимиче-ских, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную фор-му, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микроб-ная клетка станет лизогенной, она приобретет новые свойства. Таким обра-зом, умеренные фаги являются мощным фактором изменчивости микроор-ганизмов. Умеренные фаги могут нанести вред микробиологическому произ-водству. Так, если микроорганизмы, используемые в качестве продуцентов вакцин, антибиотиков, продуктов питания и других биологических ве - 97 ществ, оказываются лизогенными, существует опасность перехода уме-ренного фага в вирулентную форму, что неминуемо приведет к лизису производственного штамма. Практическое использование фагов. Применение фагов основано на их строгой специфичности действия. Фаги используют в диагностике инфекционных заболеваний: с помощью известных (диагностических) фагов проводят иденти фикацию выделенных культур микроорганизмов. Вследствие высокой спе цифичности фагов можно определить вид возбудителя или варианты (ти пы) внутри вида. Фаготипирование имеет большое эпидемиологическое значение, так как позволяет установить источник и пути распространения инфекции; с помощью тест-культуры можно определить неизвестный фаг в исследуемом материале, что указывает на присутствие в нем соответст вующих возбудителей. Фаги применяют для лечения и профилактики инфекционных болез-ней. Производят брюшнотифозный, дизентерийный, синегнойный, стафи-лококковый фаги и комбинированные препараты. Способы введения в ор-ганизм: местно, энтерально или парентерально. Умеренные фаги используют в генетической инженерии и биотехно-логии в качестве векторов для получения рекомбинантных ДНК. 3.6. Регуляторные системы прокариот (механизмы саморегуляции) Для осуществления реакций окисления в окружающей среде долж-ны быть акцепторы водорода (электронов): для аэробов это О2, а для ана-эробов или могут быть органические вещества или органические субпро-дукты расщепления углеводов, или неорганические соединения (NO3-, SO42- и т.п.). Благодаря обмену источников углерода бактерии синтезируют промежуточные продукты, необходимые для образования основных био-полимеров. Окисление источников энергии приводит к накоплению АТФ, что позволяет бактериям обеспечивать себя энергией, необходимой для биосинтеза субъединиц биополимеров и их активации. Активированные субъединицы полимеризуются и образуют макромолекулы, которые само-регулируются, формируя субклеточные и клеточные структуры. В резуль- 98 тате биомасса клетки удваивается за определенный срок (клеточный цикл), она размножается путем бинарного деления. одно и то же время в бактериальной клетке совершается огромное количество биохимических процессов, завершающихся в конечном счете увеличением биомассы. Это предполагает наличие у нее совершенных ме-ханизмов саморегуляции, чутко реагирующих на все изменения условий ее жизни. В настоящее время эти механизмы разделяют на две основные группы: а) группа неспецифических механизмов регуляции роста и раз-множения; б) группа специфических механизмов саморегуляции. неспецифическим механизмам относится совокупность действий различных физико-химических факторов, регулирующих общую скорость всех основных процессов жизнедеятельности. К ним относятся: темпера-тура, рН, rH2, концентрация ионов, степень обеспечения среды кислоро-дом, давление и др. Неспецифический характер этой формы регуляции за-ключается в том, что она влияет, прежде всего, на общую кинетику био-синтетических процессов. Регулируя оптимальное соотношение всех ука-занных факторов, можно получить максимальную скорость размножения бактерий и максимальный выход биомассы в соответствующих производ-ствах. Действие физико-химических факторов опосредуется через специ-фические механизмы саморегуляции клетки. Она носит многоступенчатый характер и отличается выраженной универсальностью, вытекающей из то-го, что специфическая саморегуляция связана с ферментами, катализи-рующими биохимические реакции, а все ферменты имеют одинаковую хи-мическую природу. Взаимодействие на уровне фермент - субстрат являет-ся важнейшим пусковым моментом всей клеточной системы саморегуля-ции. Именно на этом уровне происходит интеграция неспецифических и специфических механизмов саморегуляции клетки. Специфичность взаимодействия фермента с субстратом детермини-рована генетически - она обусловлена последовательностью расположения аминокислот в белковой молекуле и определяемыми ею вторичной, тре-тичной и четвертичной структурами молекулы фермента. В связи с этим никаких дополнительных механизмов регуляции на уровне фермент - суб-страт не требуется. Синтезированный фермент готов в любой момент, если не изменена его аллостерическая структура, вступить в реакцию с соответ- 99 ствующим субстратом. Как известно, скорость ферментативной реакции можно выразить уравнением V=К+2[E0][S]/Km+[S], где К+2 - константа субстрата; E0 - начальная концентрация фермента; Km - константа Михаэлиса; - концентрация субстрата. При увеличении концентрации S, когда S>Km, скорость фермента-тивной реакции v будет стремиться к некоторой постоянной величине vмакс - максимальной скорости реакции: V = K+2[E0] = vмакс. То есть при малых величинах концентрации субстрата скорость ре-акции будет находиться в линейной зависимости от S, а при очень высокой концентрации субстрата скорость реакции v будет стремиться к макси-мальной vмакс и мало зависеть от дальнейшего увеличения концентрации S. В свою очередь, при условии, когда S > Е0, скорость реакции будет про-порциональна концентрации фермента. Колебание температурного режима оказывает на ферментативные реакции влияние таким же образом, как и на другие химические реакции. Отношение констант реакций К при более высокой Т2 и более низкой T1 температурах называется температурным коэффициентом: Q = К2/К1. Значение его обычно дается для интервала в 10 °С (Q10). Величину Q10 легко вычислить для любого температурного интервала AT по формуле QXo=K2-\QI K1 AT Скорость ферментативных реакций зависит также от концентрации водородных ионов. Величина оптимальной рН варьирует в зависимости от типа и свойств ферментов. Даже изоферменты, имеющие одинаковую спе-цифичность к субстрату, могут различаться по оптимуму рН. Существует специфический механизм саморегуляции скоростей от-дельных биохимических реакций, вытекающий из аллостерической приро-ды белков-ферментов: конечный продукт реакции (в случае накопления его некоторого избытка), взаимодействуя с молекулой фермента, так изме-няет ее конформацию, что она временно утрачивает свою активность. Этот 100 принцип саморегуляции, получивший название регуляции по типу отри-цательной обратной связи, или торможения конечным продуктом, но-сит универсальный характер. С его помощью создаются идеальные усло-вия для саморегуляции, так как он не требует никакой дополнительной за-траты энергии и вещества. Запуск реакций, ведущих к превращению суб-страта, осуществляется самим субстратом, а их остановка - конечным про-дуктом. Как только содержание конечного продукта достигает определен-ного уровня, дальнейший синтез его прекращается. Конечный продукт вы-ступает в роли регулятора собственного синтеза. Помимо этого уровня саморегуляции, определяющего кинетику еди-ничных ферментативных реакций, общую скорость и координацию боль-шинства биохимических процессов, существует высшая форма клеточной саморегуляции, осуществляемая на генетическом уровне. В соответствии с химическими сигналами, поступающими как из внешней среды, так и эн-догенным путем, клетка автоматически запускает (индуцирует) или подав-ляет (репрессирует) синтез соответствующих ферментов. Эффекты индук-ции и репрессии противоположны по своим проявлениям, они представ-ляют собой две стороны одного и того же процесса, а именно регуляции образования ферментов. Благодаря механизмам индукции и репрессии, реализуемым с помощью соответствующих генов (регуляторов, операто-ров, промоторов, аттенуаторов т.п.) и белков (репрессоров, активаторов, апорепрессоров и т.п.), клетка в соответствии с химическими сигналами осуществляет автоматический контроль биосинтеза необходимых ей в данное время ферментов. Одним из проявлений регуляции синтеза ферментов на уровне гено-ма служит постоянная или временная катаболитная репрессия. Суть ее в том, что некоторые источники углерода, принимающие участие в энерге-тическом обмене, например глюкоза, способны подавлять биосинтез опре-деленных ферментов. бактерий обнаружены различные системы, способные восприни-мать из внешней среды физические и химические сигналы. У многих пато- генных бактерий (E.coli, Y.pestis, Y.pseudotuberculosis) обнаружены термо- индуцибельные системы, контролирующие синтез факторов патогенности. Например, у E.coli при температуре 18-20 °С практически не происходит синтез факторов адгезии (пилей). Повышение температуры до 37 °С инду-цирует их образование. Такой же температурозависимый контроль синтеза 101 факторов патогенности обнаружен у возбудителей чумы, дизентерии (ши-геллы) и других заболеваний. Целесообразность этих систем очевидна: факторы патогенности необходимы для обеспечения их существования в организме животных или человека, то есть при 37 °С. Другим примером того, как бактерии реагируют на физические сиг-налы, является феномен «теплового шока», описанный в 1952 г. Ф. Ритос-сой. Он заключается в том, что нагревание среды до 42 °С активирует ра-боту ряда генов, вследствие чего в 5 - 20 раз увеличивается синтез почти 20 белков, играющих ключевую роль в жизни клеток. Главную роль в сис-теме теплового шока играет ген (позитивный регулятор) htpR (heat tem-perature protein regulator), картированный на 76-й минуте хромосомной карты E. coli. Обнаружена система и «холодового шока»: снижение температуры роста с 37 до 10 °С у E.coli вызывает увеличение в 3 - 300 раз синтеза 13 белков, изменяющих ход ее биосинтетических процессов в новых усло-виях роста. Обе эти системы связаны друг с другом и с другими система-ми, в том числе с системой, регулирующей клеточное деление. Восприятие химических сигналов бактериями осуществляется с по-мощью так называемых сенсорно-регуляторных систем. Сенсорно-регуляторная система состоит из белка-рецептора (сенсора), который рас-полагается почти, но не всегда на мембране, и белка-регулятора, локализо-ванного в цитоплазме. Примером такой системы является система осмоти-ческой регуляции у E.coli: ее сенсором является белок EnvZ, а регулятором - белок OmpR (система EnvZ / OmpR). Белок EnvZ получает информацию из периплазмы, в которой располагается его N-концевой домен. С-концевой домен располагается в цитоплазме и в присутствии АТФ С-домен фосфо-рилируется, а затем передает фосфорную группу белку-регулятору OmpR. Этот белок контролирует работу двух генов - ompC и ompF, кодирующих синтез белков-поринов наружной мембраны. При большом количестве взаимодействующих систем для их согла-сованности, то есть для саморегуляции жизненных процессов клетки, ре-шающее значение имеет соблюдение трех основных условий: во-первых, регулирования количественного и качественного состава самих ферментов строгом соответствии с сигналами, поступающими из окружающей сре-ды; во-вторых, приспособляемости, то есть корреляции между степенью физиологической активности клетки и условиями среды, которая возника- 102 ет как неизбежное следствие установления взаимосвязи между динамиче-скими системами клетки; в-третьих, внешних условий - наличия необхо-димых субстратов, температуры, рН и др., которые индуцируют одни сис-темы и лимитируют активность других систем. Целесообразность поведения живой системы складывается из сово-купности согласованно протекающих в ней саморегулируемых и взаимо-связанных реакций, то есть она обусловлена самой организацией живой системы. Конечным результатом регуляции протекающих в клетке биосинте-тических и катаболитических процессов является воспроизведение потом-ства, а показателем сбалансированности функционирующих систем слу-жит скорость роста бактерий. 103 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
