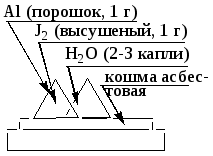
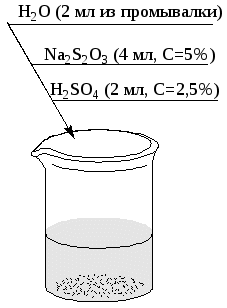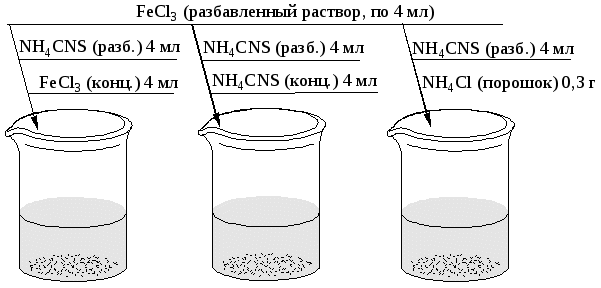Химия лабы и индивид зад. Лабораторная работа по теме гальванические элементы Опыт Гальванический элемент с деполяризатором катионом металла. По заданию преподавателя из перечисленных электродов составьте элемент
 Скачать 5.58 Mb. Скачать 5.58 Mb.
|
|
7. Лабораторная работа ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ Опыт 1. Изучение скорости реакций в зависимости от концентрации (рис. 5). Реакция протекает по уравнению Na2S2O3+H2SO4 Na2SO4+S+SO2+H2O при комнатной температуре (tкомн).
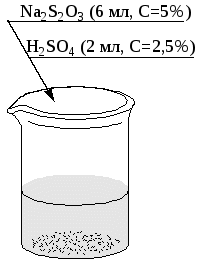
Рис. 5. Схема выполнения опыта: а, б и в – пробирки. Данные опыты используются в следующем опыте. Опыт 2. Изучение влияния температуры на скорость химической реакции (рис. 6).  Рис. 6. Схема выполнения опыта: а – пробирка (данные опыта 1: t1= tкомн, пробирка в); б – пробирка в водяной бане (раствор нагреть до t2= t1+10оС); в – пробирка в водяной бане (раствор нагреть до t3 = t2+10оС) Опыт выполняется в пробирках. Исходные растворы отбирают из бюреток. Помутнение раствора, возникающее вследствие выделения свободной серы, свидетельствует о завершении реакции. Отсчет времени вести по секундомеру или по часам. Результаты опытов 1 и 2 записать в виде табл. 3. Таблица 3
По данным опытов построить графики выражающие: а) зависимость скорости (V1, V2 и V3) от концентрации; б) скорости реакции (V1| = V1, V2|, V3|) от температуры. По результатам опыта сделать вывод. Опыт 3. Влияние размеров частиц на скорость химической реакции (рис.7).
В выводах объяснить, какую роль играет степень измельчения твердых веществ в гетерогенных реакциях.
Результаты опытов 4 – 7 записать в виде табл.4. Таблица 4
Опыт 8. Химическое равновесие. Влияние концентрации на химическое равновесие. Реакция взаимодействия хлорного железа с роданистым аммонием (рис.12)
Реакция взаимодействия: FeCl3+3NH4CNS 3NH4Cl+Fe(CNS)3 Рис.12. Схема проведения опыта: а, б, в, г – пробирки с различными растворами солей. Результаты записать в виде табл.5. Таблица 5
В выводах объяснить изменение окраски растворов в пробирках и принцип Ле Шателье. ИНДИВИДУАЛЬНЫЕ ЗАДАЧИ 1 вариант. 1. Сформулируйте закон действия масс и рассмотрите его применение на конкретном примере. 2. Как изменится скорость реакции образовании NO N2+O2=2NO, если объем газовой смеси уменьшить в 2 раза? 3. Как возрастают скорости реакции при повышении температуры от 50 до 100оС, если температурный коэффициент реакции равен 2? 4. Константа равновесия для реакции 2N2+O2=2N2O составляет 1,21. Равновесные концентрации были: [N2]=0,72 моль/л, [N2O]=0,84 моль/л. Найти исходную концентрацию кислорода. 5. Константа равновесия гомогенной системы CO – HO =CO – H при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации были: [CO]исх=3 моль/л, [HO]исх=2 моль/л. (ответы: [CO]р = 1,8 моль/л ; [HO]р = 0,8 моль/л). 6. В какую сторону при понижении температуры будут смещаться равновесия следующих систем:
2 вариант. 1. Можно ли утверждать, что изменение концентраций реагирующих веществ повлекло за собой изменение константы равновесия? 2. Напишите выражение для скорости прямой и обратной реакции каждого из следующих процессов: а) N2+O2 2NO; б) N2+3H2 2NH3; в) CO+Cl2 COCl2. Вычислите, во сколько раз увеличатся или уменьшатся скорости этих реакций, если при неизменной температуре: а) уменьшить концентрацию каждого вещества в 2 раза; б) увеличить давление в 3 раза. 3. Во сколько раз возрастает скорость химической реакции при повышении температуры от 20 до 120оС (температурный коэффициент реакции равен 2). 4 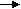  . Вычислите константу химического равновесия реакции 2NO+ O2 2NO2 и исходные концентрации NO и O2, если при химическом равновесии концентрации были: [NO]р = 0,004 моль/л , [O2]р = 0,04 моль/л, [NO2]р = 0,004 моль/л. . Вычислите константу химического равновесия реакции 2NO+ O2 2NO2 и исходные концентрации NO и O2, если при химическом равновесии концентрации были: [NO]р = 0,004 моль/л , [O2]р = 0,04 моль/л, [NO2]р = 0,004 моль/л.5. Константа равновесия реакции FeO+CO CO2+F равна 0,5. Найти равновесные концентрации оксида (II) и диоксида углерода (IV), если начальная концентрация [CO] равна 0,1 моль/л; [CO2] =0,02 моль/л. 6. Как влияет повышение давления на равновесие следующих систем:
3 вариант. 1. Какие факторы влияют на скорость химической реакции? Почему скорость реакции резко возрастает при нагревании? 2. Напишите формулу для расчета скорости следующих реакций, протекающих в гомогенной системе: А+В АВ, 2А+В А2В, 4NH3-O2=2H3-6H2O. Как изменятся скорости первых 2 реакций, если концентрации веществ А и В увеличить в 2 раза? 3. При повышении температуры от 10 до 50оС скорость реакции увеличилась в 16 раз. Вычислите температурный коэффициент скорости этой реакции. (Ответ: 2). 4. Вычислите константу равновесия для гомогенной системы CO(г)+ H2O(г) CO2(г)+H2(г), если равновесные концентрации реагирующих веществ: [CO]p = 0,004 моль/л; [H2O]p=0,064 моль/л; [CO2]p=0,016 моль/л; [H2]p=0,019 моль/л. (Ответ: 1). 5. При 250оC константа равновесия диссоциации 2HI I2+H2 равна 0,0156. Определите число молей H2, I2 и HI в состоянии равновесия, если вначале был взят 1 моль/л HI. 6. В каком направлении сместится равновесие при повышении температуры в следующих обратимых реакциях:
4 вариант. 1. Какое состояние системы реагирующих веществ называется химическим равновесием? 2. Как изменятся скорости прямых и обратных реакций в следующих случаях: H2+Cl2 2HCl, 2H2+O2 2H2O, N2O4 2NO2, если при неизменной температуре уменьшить концентрации каждого вещества в 2 раза? 3. При повышении температуры на 10оС скорость некоторой реакции увеличилась в 2 раза. Определите, во сколько раз увеличится скорость этой же реакции при повышении температуры на 50 и 100оС (Ответ: в 32 раза; в 1024 раза). 4. При некоторой температуре концентрации веществ в равновесной системе, выражаемой уравнением N2O4 2NO2, были [N2O4]p=0,0055 моль/л; [NO2]р=0,0189 моль/л. Вычислите константу равновесия. (Ответ: 0,0305). 5 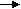  . Обратимая реакция протекает согласно уравнению 3А+2В С+D. Константа равновесия равна 1/3. Вычислите равновесные концентрации веществ [A], [B], [C], [D] моль/л, если начальные концентрации были: [A]=2 моль/л, [В]=4 моль/л. . Обратимая реакция протекает согласно уравнению 3А+2В С+D. Константа равновесия равна 1/3. Вычислите равновесные концентрации веществ [A], [B], [C], [D] моль/л, если начальные концентрации были: [A]=2 моль/л, [В]=4 моль/л.6. Напишите выражение константы равновесия для каждого из следующих обратимых процессов: 2NO2 N2O4, 2NO2 2NO+O2, FeO+H2 Fe+H2O, 3H2O+N2 2NH3, C+H2O(r) H2+CO. Как сместится равновесие в каждом из указанных случаев при увеличении давлении? 5 вариант. 1. От каких факторов зависит скорость химических реакций? Какие молекулы характеризуется повышенной реакционной способностью? 2. Как изменится скорость прямой реакции N2+3H2 2NH3, если при неизменной температуре в 2 раза повысить давление? 3. Вычислите температурной коэффициент реакции, зная, что с повышением температуры на 70оС скорость реакции возрастает в 128 раз. 4. Константа равновесия обратимой реакции, протекающей по уравнению CO+H2O H2+CO2, при некоторой температуре равняется 1. При состоянии равновесия концентрация веществ были: [H2O]р=0,03 моль/л; [CO]р=0,04 моль/л. Вычислите исходную концентрацию [CO2]. (Ответ: 0,093 моль/л). 5. Константа равновесия реакции А+В С+D равна 4. Найдите концентрации веществ в состоянии равновесия, если вначале А и В было взято по 2 моль/л? 6. В каком направлении будет смещаться равновесие с повышением температуры и давления для следующих обратимых реакций:
6 вариант. 1. Каким образом повышение давления влияет на скорость химической реакции? 2. Определите, как изменится скорость реакции 2А+В2 2АВ, если давление увеличить в 4 раза,(Ответ: 64 раза). 3.Температурный коэффициент скорости некоторых ферментативных процессов достигает 7. Приняв скорость ферментального процесса при 20°С за 1, укажите, чему могла бы быть равна скорость этого процесса при 50°С. 4. При нагревании N02 в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 2NO + О2 установилось при следующих концентрациях: [NO2]p= 0.06 моль/л, [NO]p=0,24 моль/л, [О2]р=0,12моль/л. Найдите константу равновесия для этой температуры и исходную концентрацию. 5. Обратимая реакция выражается уравнением А+В C+D. Константа равновесия равна 1. Начальная концентрация вещества [А] равна 2 моль/л. Рассчитайте, сколько процентов вещества [А] подвергается превращению в при условии, что начальная концентрация вещества [В] равна 10 моль/л.(Ответ: 83,3%). 6. Определите, в какую сторону сместится равновесие реакции при повышении давления в системах:
7 вариант. 1. Роль диффузий и измельчения частиц реагента в установлении скорости химического равновесия. 2. Процесс получения какого вещества имеет наибольшую скорость, если в единицу времени образуется 8,5 г H2S и 8,5 г NH3? 3. Сколько времени будет протекать реакция при температуре: a) 200°C, б) 100°С, если известно, что при 160°С она заканчивается за 100 мин? Температурный коэффициент равен 2. 4. Константа скорости реакции 3 А + 2 В С равна 0,4. Начальная концентрация вещества А равна 0,3 моль/л, вещества В-0,5 моль/л. Найдите начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,060 моль/л. 5. Рассчитайте константу равновесия для реакции CH4+2O2 CO2+2H2O, если известно, что исходные концентрации [CH4] =3 моль/л, [O2]=4 моль/л и что к моменту равновесия прореагировало 50% кислорода. 6. Напишите выражение для константы равновесия для каждого из следующих обратимых процессов:
Как сместится равновесие в каждом из указанных случаев при увеличении давления? 8 вариант. 1. Каким образом увеличение температуры влияет на изменение скорости химических реакций? 2. Напишите математические выражения скоростей химических реакций, протекавших по уравнениям
При составлении математических выражений нужно учитывать агрегатное состояние реагирующих веществ. 3. Вычислите, во сколько раз увеличится, скорость химической реакции, если повысить температуру системы от 20 до 100оС, приняв значение температурного коэффициента скорости реакции равным 3. 4. Вычислите константу равновесия К реакции 2НBr H2+Br2,если первоначальное количество бромистого водорода было равно 0,809 моль/л, а к моменту равновесия прореагировало 5%исходного вещества. (Ответ: 0,9 .10-4). 5  . Константа равновесия гомогенной системы СО(г)+Н2О(г) СО2(г)+Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации [CO] = 0,10 моль/л; [H2O]=0,40 моль/л. . Константа равновесия гомогенной системы СО(г)+Н2О(г) СО2(г)+Н2(г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации [CO] = 0,10 моль/л; [H2O]=0,40 моль/л.6. Напишите выражение константы равновесия для каждой реакции: N2+O2 2NO, CO+Cl2 COCl2, N2+3H2 2NH3. Укажите, в какую сторону изменяется равновесие этих реакций: а) при уменьшении концентрации каждого вещества, б) увеличении давления. 9 вариант. 1. Каков физический смысл константы скорости химических реакций? 2  . Окисление NOкислородом идет по уравнению 2N0 + О2 2NO2. Как изменится скорость реакции, если увеличить концентрацию в 2 раза при постоянной концентрации О2? . Окисление NOкислородом идет по уравнению 2N0 + О2 2NO2. Как изменится скорость реакции, если увеличить концентрацию в 2 раза при постоянной концентрации О2?3. Во сколько раз изменится скорость реакции, температурный коэффициент которой равен 2, при повышении температуры на 120оС? 4. Равновесие реакции H2 +I2 2HI установилось при следующих концентрациях участвующих в ней веществ: [H2]р=0,4 моль/л, [I2] p=0,5 моль/л, [HI]p = 0,9 моль/л. Определите исходные концентрации йода и водорода и рассчитайте константу равновесия.(Ответы: [H2]=0,85 моль/л, [I2] = 0,95 моль/л; Кравн = 4,05). 5. При состоянии равновесия обратимой реакции разложения пятихлористого фосфора PCl5 PCl3+Cl2 исходные концентрации участвующих в реакции веществ были: [PCl5] = 0,005 моль/л; [PCl3]=0,06 моль/л; [Cl2] = 0,080 моль/л. Вычислите равновесные концентрации этих веществ. 6. Какие из приведенных реакций являются гомогенными и какие - гетерогенными:
Напишите уравнения констант равновесия для 2 последних реакций, учитывая агрегатное состояние веществ. 10 вариант. 1. Что называется катализатором? Какова его роль в химической реакции? 2. Напишите математическое выражение закона действующих масс для реакции 2SO2+O2=2SO3. 3. Температурный коэффициент скорости некоторой реакции равен 1,5. Определите, во сколько раз увеличится скорость данной реакции при повышении температуры на 30оС. (Ответ: 3,4 раза). 4. При состоянии равновесия системы 2 NО + J2 2NO2 концентрация оксида азота оказалась равной 0,56 моль/л; кислорода -0,028 моль/л, двуоксида азота - 0,44 моль/л. Вычислите исходные концентрации NO и O2. 5. Константа равновесия химической реакции H2(r) + I2(r) =2HI(r) при некоторой температуре равна 4. Рассчитайте равновесную концентрацию HI, если исходные концентрации H2 и I2 равны соответственно 0,030 и 0,012 моль/л.(Ответ: 1.71.10-2 моль/л). 6. Определите, в каком направлении сместится равновесие следующих обратимых реакций: 2SO2+O2 2SO3+Q, N2+O2 2NO – Q, N2+3N2 2NH3+Q, N2O4 2NO2 – Q при понижении температуры, при понижении давления. 11 вариант. 1. Как объяснить, что изменение концентрации KCNS или NH4CNS вызывает более эффективное смещение равновесия, чем изменение концентрация FeCl? 2. Напишите математическое выражение скорости гомогенных реакций: а) 2А+3В А2В3; б) N2O4 2NO2. 3. При повышении температуры от 10о до 50оС скорость реакции увеличилась в 16 раз. Вычислите температурный коэффициент скорости этой реакции. (Ответ: 2). 4. При синтезе аммиака в некоторых условиях в равновесии находятся 0,1 моль/л [N2]p; 0,2 моль/л [H2]p и 0,8 моль/л [NH3]p. Вычислите константу равновесия и рассчитайте исходные концентрации азота и водорода. (Ответ: К=800; [N2]исх=0,5 моль/л; [H2]исх=1,4 моль/л). 5. Рассчитайте константу равновесия для реакции CH4+2O2 CO2+2H2O, если исходные концентрации были: [CH4] =3 моль/л, [O2]=4 моль/л и к моменту равновесия прореагировало 50% кислорода. 6. Почему при изменении давления смещается равновесие реакции N   2+3H2 2NH3 и не смещается равновесие реакции N2+O2 2NO? 2+3H2 2NH3 и не смещается равновесие реакции N2+O2 2NO?12 вариант. 1. Напишите математическое выражение правила Вант-Гоффа. 2. Чему равна константа скорости химической реакции для уравнения А+В АВ? Каков физический смысл константы скорости реакции? 3. Определите, во сколько раз увеличится скорость химической реакции при повышении температуры от 0 до 50оС, если температурный коэффициент скорости равен 3. (0твет: в 243 раза). 4. Обратимая гомогенная химическая реакция выряжается уравнением А(г)+2В(г) С(г). При установлении равновесия концентрации участвующих в реакции веществ были: [А]р = 0,06 моль/л, [В]р=0,12 моль/л, [С]р= 0,0216 моль/л. Вычислите константу равновесия и исходные концентрации веществ А и В. (Ответы: К= 25; [а]исх= 0,0816 моль/л; [В]исх=0,1632 моль/л). 5. Обратимая, реакция выражается уравнением А +В С+ D. Константа равновесия равна 1. Начальные концентрации были [A]=3 моль/л, [B]=2моль/л. Вычислите равновесные концентрации всех участвующих в реакции веществ. 6. Определите, как будет влиять увеличение температуры и давления на состояние равновесия в следующих реакциях: N2+O2 2NO – Q, N2+3H2 2NH3+Q, H2+Cl2 2HCl+Q, CO+H2O CO2+H2 – Q. 13 вариант. 1. Как используется принцип Ле Шателье в промышленности. 2. Как изменится давление в замкнутой равновесной системе 2NO2↔2NO+O2, если равновесие сместится вправо? 3. Во сколько раз возрастет скорость химической реакции при повышении температуры с 10 до 400С, если известно, что с повышением температуры на 100С скорость химической реакции возрастет в 2 раза? 4. Равновесие гомогенной системы 4HCI(г)+O2(г)= 2H2O(г)+2CI2(г) установилось при следующих концентрациях реагирующих веществ: [H2C]p = 0,14моль/л; [CI2]p = 0,14 моль/л; [HCI]p= 0,20 моль/л; [О2]p= 0,32 моль/л. Вычислите исходные концентрации хлористого водорода и кислорода. (Ответы: [HCI]исх = 0,28 моль/л; [О2]исх = 0, 39 моль/л.) 5. Обратимая реакция идет согласно уравнению 3А+2В ↔С + 2D. Константа равновесия равна 1/3. Вычислите равновесные концентрации веществ [A], [В], [С], [D] в моль/л, если начальные концентрации были [А] = 2 моль/л, [В] = 4 моль/л. 6. С учетом увеличения давления покажите, как сместится равновесие при каждом из указанных случаев: NO2↔N2O4, 2NO2↔2NO+O2, 3H2+N2↔2NH3, FeO+H2↔Fe+H2O(г). Напишите выражение константы равновесия. Сформулируйте принцип Ле Шателье. 14 вариант 1. Какими силами обусловливается адсорбция? 2. Процесс получения какого вещества имеет наибольшую скорость, если в единицу времени образуется 10г HCI, 11г CO2 и 8,5г H2O? 3. Сколько времени будет протекать реакция при температуре 1000С, если известно, что при 1600С она заканчивается за 10 мин? Температурный коэффициент реакции равен 2. 4. При некоторой температуре равновесие в гомогенной системе 2NO+ O2↔2NO2 установилось при следующих концентрациях реагирующих веществ: [NO]p = 0,2 моль/л; [О2]p = 0,1 моль/л, [NO2]= 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и O2. (Ответы: К=2,5; [NO]= 0,3 моль/л; [О2] = 0,15 моль/л). 5. Вычислите равновесные концентрации в обратимой химической реакции 2SO2 + O2 2SO3; CO(г) + H2O CO2(г) + H2(г), если исходные концентрации смеси были: [СО]=2 моль/л, [Н2О]=3 моль/л. Константа равновесия К = 1 (при t = 850оС). 6. Равновесие реакции 2SO2 + O2 2SO3 при следующих концентрациях веществ [SO2]р = 0,1 моль/л, [O2] = 0,05 моль/л. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||