Химия лабы и индивид зад. Лабораторная работа по теме гальванические элементы Опыт Гальванический элемент с деполяризатором катионом металла. По заданию преподавателя из перечисленных электродов составьте элемент
 Скачать 5.58 Mb. Скачать 5.58 Mb.
|
|
HI + КОН → КI + H2O; СО + H2O → H2СO3; 2КI + Cl2 → 2KCl + I2; 2Cr + 6HCl → 2CrCl3 + 3H2↑. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Pt в 1М SnCl2 и 1М SnCl4; 2) Pt в 0,05М H2SO4, РO2=1. Укажите виды поляризации этих электродов. Как поляризация сказывается на работе гальванического элемента? Вариант 9. 1. Вычислите потенциал электрода, на котором установилось равновесие Co3+ + ē ↔ Co2+ при [Co3+] = 10-2 моль/л, [Co2+] = 10-1 моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве катода? Как при этом изменится значение равновесного потенциала? 2. Условная схема электрода – Ag+│Ag. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС?
2Cu + O2 + 4HCl → 2CuCl2 + 2H2O; Zn(OH)2 +2HCl → ZnCl2 + 2H2O; Zn +Pb(NO3)3 → Zn(NO3)3 + Pb; Zn + 2HCl → ZnCl2 + 2H2↑. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1)Pt в 0,0001M NaOH, РO2=1; 2) Al в 0,03 моль/л Al 2(SO4)3 . Укажите виды поляризации этих элементов. Как поляризация отражается на работе гальванического элемента? Вариант 10. 1. Вычислите потенциал электрода, на котором .установилось равновесие S(т) + 2ē ↔ S2- при [S2-] = 10-4 моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится величина разновесного потенциала? 2. Условная схема электрода – Н2О│О2, Рt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода имеет стандартное значение? Составьте схему элемента, спомощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3.Сравните окислительную активность серебряного электрода при стандартных условиях и при [Ag+] = 10-3 моль/л РCI2=1. Составьте схему элемента указанных электродов. Вычислите его ЭДС. Как называется такой элемент? Долго ли он будет работать? 4.Укажите химические реакции, которые могут быть использованы для организации гальванического элемента: NН3+ Н2О → NН4OH; 2FeCl3 + Cu → 2FeCl2 + CuCl2; 2Н2 + O2 → 2Н2О; CuCl2 + Zn → ZnCl2 + Cu↓. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Pt в 1M KMnO4 и 1M MnSO4, pH=2; 2) Cu в 0,0002 моль/л CuSO4. Укажите виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 11. 1. Вычислите потенциал электрода, на котором установилось равновесие Cr2O72- + 14H+ + 6ē ↔ 2Cr3+ + 7Н2О при [Cr2O72-] = [Cr3+] =10-2 моль/л, рН = 3. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве катода? Как при этом изменится значение равновесного потенциала? 2. Условная схема электрода – Sn2+│Sn. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода имеет стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Сравните окислительную активность кислородного электрода в 1M растворе NаОН и 1 моль/л растворе H2SO4, если РO2=1. Составьте схему элемента из указанных электродов. Вычислите его ЭДС. Как называется такой элемент? Долго ли он будет работать? 4. Укажите химические реакции, которые можно использовать для организации гальванического элемента? Н2 + CuCl2 → Cu + 2HCl; Mn + H2SO4 → MnSO4 + H2↑; 2NаОН + CuCl2 → Cu(ОН)2 +2NаCl; CuO + H2SO4 → CuSO4 + Н2О. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Mn в 0,002 моль/л МnCl2; 2)Pt в 0,001M HCl, РCl2=1. Укажите виды поляризации этих электродов. Как отражается поляризация на работе гальванического элемента? Вариант 12. 1. Вычислите потенциал электрода, на котором установилось равновесие Fe3+ + ē ↔ Fe2+ при [Fe2+] = [Fe3+] = 10-1 моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала? 2. Условная схема электрода – J-│J2, Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода имеет стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Сравните окислительную активность водородного электрода в 1M растворе HCl и 1моль/л растворе Ва(ОН)2, если РO2=1. Составьте схему элемента из указанных электродов. Вычислите его ЭДС. Как называется такой элемент? Долго ли он будет работать? 4.Укажите химические реакции, которые можно использовать для организации гальванического элемента: 2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl; HCl + NаОН →NаCl + Н2О; F2 + 2HCl → 2HF + Cl2; CaCO3 + 2HCl →CaCl2 + CO2 + Н2О. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Pt в растворе с рН=9, РО2=1; 2) Аg в 0,001 моль/л AgNO3. Укажите виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 13. 1. Вычислите потенциал электрода, на котором установилось равновесие 2Н2О + 2 ē ↔ H2↑+ 2OН– при рН = 10, РH2 = 1 .Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве катода? Как при этом изменятся значение равновесного потенциала? 2. Условная схема электрода – Cd2+|Cd. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода имеет стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Сравните окислительную активность йодного электрода в стандартных условиях и при [J–]=10–2 моль/л. Составьте схему элемента из указанных электродов. Вычислите его ЭДС. Как называется такой элемент? Долго ли он будет работать? 4. Укажите химические реакции, которые могут быть использованы для организации гальванического элемента: NaCl + AgNO3 → AgCl + NaNO3; Pb(NO3)2 + 2NaI → PbI2 + 2NaNO3; Cl2 + 2NaI→2NaCl + I2; ZnO + 2HCl → ZnCl2 + H2O. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Pt в 1М K2Cr2O7 и 1М Cr2(SO4)3, pH=1; 2) Pt в 1М NaOH, РO2=1. Укажите виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? 2. Лабораторная работа по теме «Коррозия металлов и защита от коррозии» Опыт 1. А) Образование гальванической пары (гальванического элемента) на поверхности металла. Схема проведения опыта (рис.13). 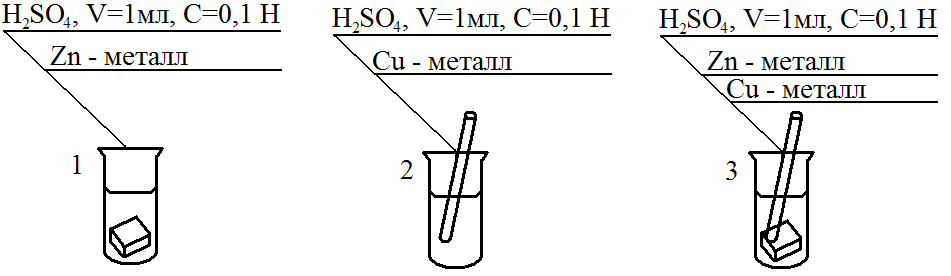 В две пробирки налить одинаковое количество раствора H2SO4 концентрации 0,1 моль/л. В одну пробирку опустить кусочек чистого цинка, в другую - медную проволоку. Убедиться, что выделение водорода на меди не происходит. Затем внести медную проволоку в пробирку с цинком так, чтобы ее конец прикасался к поверхности цинка. Наблюдать интенсивное выделение водорода на медной проволоке. Объяснить явление, составить схему работы гальванического элемента. Б). Определение скорости коррозии цинка и цинко-медной пары металлов. Прибор определения скорости коррозии металлов: 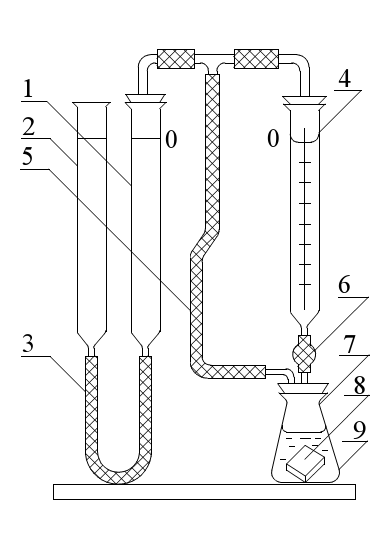 1 - бюретка для определения объема водорода; 2 - бюретка с минимальным уровнем окрашенной воды ; 3 - резиновая трубка, соединяющая реакционную колбу с бюреткой 1; 6 - затвор бюретки 4; 7 - реакционная колба; 8 - цинковая пластинка (в первой части опыта) и медно-цинковая пара (во второй части опыта ); 9 - раствор соляной кислоты. Последовательность опыта. Бюретки 1 и 2 заполняют подкрашенным раствором воды в объеме 30%, бюретка 4 заполняется раствором хлороводородной кислоты концентрации 5 моль/л. При подготовке бюретки к работе из нижней части стеклянного наконечника путем открывания краника или шарикового затвора в резиновой трубке вытесняют воздух и заполняют раствором кислоты. При этом уровень раствора устанавливают на нулевом делении по нижнему мениску (рис.15). 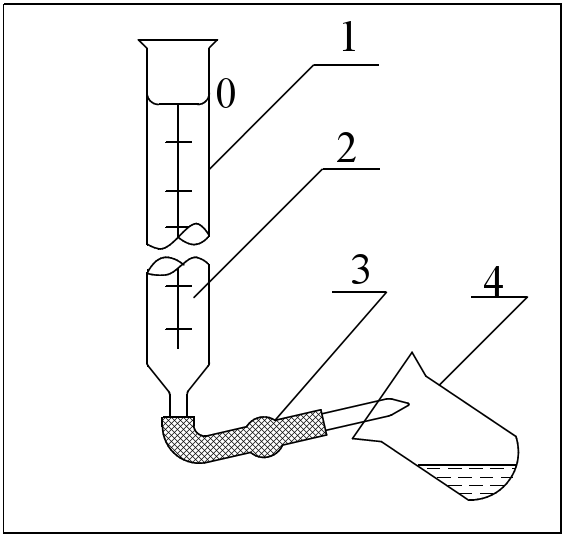 Рис. 15. Схема вытеснения воздуха: 1-бюретка с соляной кислотой; 2- раствор соляной кислоты; 3- шариковый клапан – затвор; 4- химический стакан. После подготовки бюреток и прибора в реакционную колбу помещают пластинку цинка и присоединяют колбу с бюреткой. 4. Затем поднятием или опусканием бюретки 2 или 1 проверяют герметичность системы в целом. Убедившись в герметичности прибора, записывают первоначальный уровень раствора в бюретке 1. Затем в реакционную колбу вносят раствор кислоты в объеме 6 мм. В рабочем журнале записывают объем выделившегося водорода с интервалом 30 с. Форма записи показана в табл.9.Продолжительность эксперимента 3-5 минут. Таблица 9.
На основании полученных данных вычислите относительные скорости коррозии металла W(Zn)=V/t. По результатам вычисления постройте график, выражающий зависимость скорости реакции от времени. Время реакции откладывается по оси абсцисс, скорость – по оси ординат. Аналогичный опыт выполняют на этом приборе с медно-алюминиевой пластиной. Результаты опыта записать так же, как в таблице 3. По полученным данным, сравнивая их, определяем характер коррозии металла. Опыт 2. Коррозия оцинкованного и луженого железа. В две пробирки налейте по 5 мл воды и по 1 капле раствора Н2SO4 концентрации 2 моль/л и К3[Fe(CN)6]. В одну пробирку опустите полоску оцинкованного железа, в другую - луженого. Обнажение железа имеется на месте среза полосок. Через 5-10 мин. наблюдайте в одной из пробирок появление синего окрашивания. Объясните опыт. Составьте схемы работ гальванического элемента, учитывая, что кислая среда. Опыт 3. Электрозащита металла от коррозии. В U-образную трубку налить раствор NaCl концентрации 0,5 моль/л и добавить по 3-5 капель раствора К3[Fe(CN)6]. В один конец опустите железный стержень, соединенный с отрицательным полюсом источника постоянного электрического тока (катод) и в другой - угольный электрод, соединенный с положительным полюсом (анод). Наблюдайте и объясните результаты опыта. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ К САМОСТОЯТЕЛЬНОЙ РАБОТЕ Вариант 1.
Вариант 2.
Вариант 3.
Вариант 4.
Вариант 5.
Вариант 6.
Вариант 7.
Вариант 8.
Вариант 9.
Вариант 10.
Вариант 11.
Вариант 12.
3. Лабораторная работа по теме «Электролиз» Опыт 1. Электролиз раствора сульфата натрия. Прибор соберите по схеме, как показано на рис.17. Зарисуйте его. Бюретки и U – образная трубка должны быть собраны герметично. Герметичность системы проверьте путем поднятия или опускания одной из бюреток. Если при этом уровень жидкости остается стабильно на одном уровне, то прибор герметичен. В начале опыта зафиксируйте в журнале: начало опыта и начальный уровень жидкости в бюретках 1 и 5. Электролиз проводите в течение 3 –10 минут до получения 5 – 100 мл газа в одной из бюреток. Затем выключите выпрямитель. Запишите конец опыта. Определите точный объем выделившихся газов в бюретках 1 и 5 и заметьте изменение цвета индикатора. Для определения точного объема выделившихся газов в спаренных бюретках столбики жидкости приведите к одинаковому уровню и по разности уровней жидкости до и после опыта (h0 и hk ) определите объемы газов в электродных зонах V = hk -h0(для упрощения расчета объем выделившихся газов не приводите к нормальным условиям). 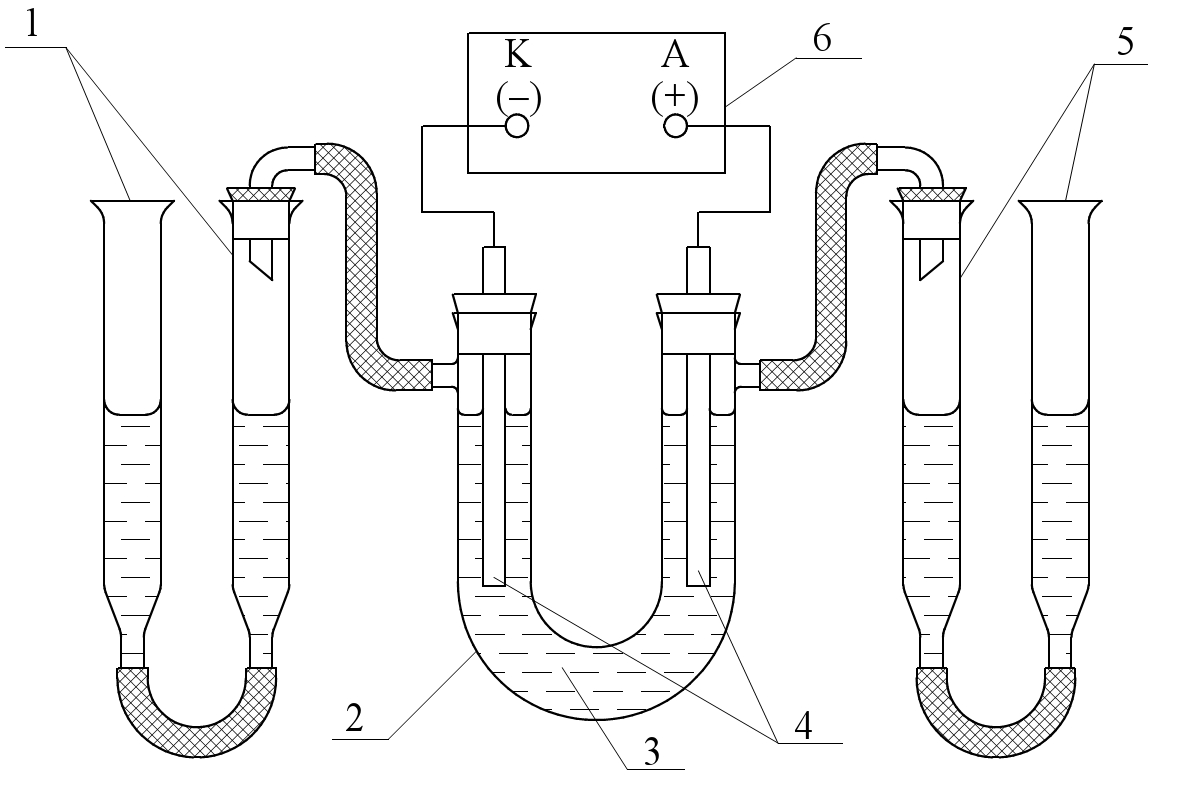 Рис.17. Прибор для количественного определения выделяющихся веществ в реакционных зонах при электролизе раствора сульфата натрия: 1 и 5 – бюретки спаренные; 2 - U-образная трубка; 3 – раствор сульфата натрия и 3 – 4 капли метилового оранжевого; 4 – графитовые электроды; 6 – выпрямитель. Запишите электродные процессы. Объясните изменение окраски индикатора. Вычислите по объему выделившегося газа массу вещества, разложившегося при электролизе. Рассчитайте Еразл. Составьте ЭХС внутреннего гальванического элемента, который образуется в процессе электролиза. Необходимо учесть, что раствор метиловый оранжевый имеет цвет: а) в кислой среде – красный; б) в нейтральной – оранжевый; в) в щелочной – бледно-желтый. Задание 1.Объясните, с какой целью при промышленном электролизе воды в нее вводят электролиты: H2SO4, Na2SO4, NaOH? Какой электролит наиболее целесообразен? Ответ обоснуйте. 2 .Запишите катодные и анодные реакции при электролизе растворов: H2SO4, Na2SO4, NaOH. Рассчитайте соответствующие электродные потенциалы, принимая pH растворов равным соответственно 0; 7; 14. 3. Изобразите графически зависимость равновесных потенциалов катода и анода от pH раствора. 4. Подтвердите расчетом независимость напряжения разложения воды от состава раствора. Отметьте, как это проявляется на графике. Дайте объяснение? Опыт 2 Электролиз раствором иодида калия. 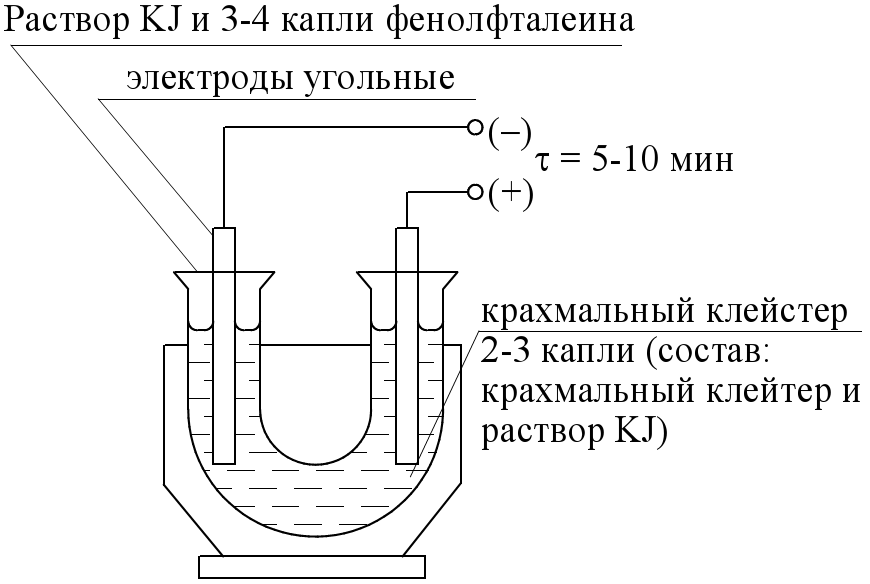 Результаты наблюдения:
Задание. Можно ли электролизом водного раствора фторида калия получить фтор? Ответ обоснуйте. Опыт 3. Электролиз раствора хлорида меди (или сульфата меди), (рис.18.). Результаты наблюдения:
на поверхности электрода – катода?
Задание. Вычислите, при какой силе тока надо проводить электролиз хлорида меди, чтобы в течение 20 минут получить примерно 2 г меди. Опыт 4. (опыт 4 – продолжение опыта 3). Электролиз с растворимым анодом. Поменяйте полярность внешнего источника тока: катод присоедините к положительному источнику тока, анод – к отрицательному полюсу. Пропустите ток в течение 5 –8 мин. Результаты наблюдения:
Задание. С какой целью проводят электролиз с растворимым анодом в промышленности? Приведите примеры. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ К САМОСТОЯТЕЛЬНОЙ РАБОТЕ. Вариант 1 1. Напряжения разложения расплавов MgCI2, KCI равны соответственно 2,7 и 3,5 В. Можно ли получить магний или калий электролизом карналлита MgCI2 · KCI · 6H2O, предварительно обезводив этот минерал? Запишите уравнения электродных реакций. Вычислите массу карналлита, содержащего 32 % MgCI2, расходуемого на получение 1 т магния. 2. Напишите уравнения электродных реакций при электролизе водного раствора ZnSO4 (электроды графитовые). Какой внутренний гальванический элемент при этом образуется? Какова его роль? Рассчитайте напряжение разложения. 3. Неочищенный никель содержит примеси Cu, Fe, Co, и небольшое количество металлов платиновой группы. Учитывая, что окисление никеля идет с большой анодной поляризацией (∆ Еa = 0,3 – 0,5 В), укажите, что произойдет с указанными примесями при электролитическом рафинировании никеля. Напишите уравнения электродных реакций при рафинировании. 4. Определите время, необходимое для нанесения платинового покрытия толщиной 3,6 мкм. Плотность осаждаемого металла 21,47 · 103 кг/м3, выход по току 100%, рекомендуемая плотность тока 10 А/м2. Напишите уравнение электрокристаллизации платины из водного раствора H2[PtCI6]. 5. Какова сущность электрохимического полирования? Когда целесообразно его применять? Вариант 2. 1.Укажите раствор или расплав CaCI2 применяется при электролитическом получении кальция? Запишите уравнения электродных реакций и вычислите, сколько времени потребуется для получения 1 кг металла. Сила тока 2000 А, выход по току 70 %. 2. Напишите электродные уравнения при электролизе водного раствора KCI (электроды графитовые). Какой внутренний гальванический элемент при этом образуется? Какова его роль? Рассчитайте напряжения разложения. 3. При выплавке из руд получается черновая медь, в которой 4 % составляют примеси (Ni, Fe, Ag, Pb, Zn, Au). Напишите уравнения электродных реакций при электролитическом рафинировании меди, которое ведут в растворе CuSO4 c добавкой H2SO4. Что происходит с примесями? Для чего добавляют H2SO4? Ответ обоснуйте. 4. Серебрение используется для уменьшения сопротивления электрических контактов. Определите время, необходимое для нанесения слоя серебра толщиной 5 мкм. Плотность серебра 10,49 . 103 кг/м3, выход по току 98%, рекомендуемая плотность тока 10 А/м2. Электролит К[Аg(СN)2]. Напишите уравнения электродных реакций. 5. Какова сущность электрохимического метода получения копий металлических изделий? Вариант 3. 1.Натрий получают электролизом расплава NaCl. Раньше ее получали из расплава NaOH. Напишите уравнения электродных реакций для обоих случаев. Укажите причины, из-за которых прежний метод экономически нецелесообразен. 2. Напишите уравнения электродных реакций при электролизе водного раствора NiSO4. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. Неочищенное серебро содержит примеси Au,Cu, Pb, Pt, Pd. Процесс рафинирования серебра ведут в растворе AgNO3, с добавкой НNO3. Напишите уравнения основной реакции на катоде и возможных побочных процессов, которые снижают катодный выход по току, отравляют атмосферу и уменьшают содержание кислоты в электролите. Что происходит с примесями? Ответ обоснуйте. 4. Рассчитайте толщину отложившегося при электролизе на железной проволоке слоя олова. Плотность олова 7,29 . 103 кг/м3, длина проволоки 2 м, ее диаметр 0,0004м, ток силой 2,5 А в течение 30 мин пропускали через раствор SnCl2. Выход по току 93%. Напишите уравнения электродных реакций. 5. В чем заключается сущность анодного и катодного электрохимического травления металлов. Вариант 4. 1. Лантаноиды имеют значения стандартных электродных потенциалов: Е0 La3+/La= -2,4В, ЕСе3+/Cе= -2,2 В. Е0 Pr3+/Pr= -2,3 В и т.п. Электролизом галидов лантаноидов (расплавов или растворов?) не удается выделить на катоде индивидуальный металл, а получают «мишметалл», содержащий все лантаноиды. Дайте объяснение указанному факту. 2. Напишите уравнения электродных реакций при электролизе раствора CoSO4. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. В процессе электролитического рафинирования золота используют раствор соляной кислоты. Учитывая большую склонность золота к комплексообразованию, напишите уравнение основного анодного процесса. Что происходит с примесями Au,Cu, Pb, Pt при рафинировании? Возможно ли соосаждение с золотом указанных примесей? Ответ обоснуйте. 4. Цинкование применяется для защиты деталей от коррозии. Рассчитайте время, в течение которого надо пропустить ток в 1,5 А через раствор цинковой соли, чтобы покрыть пластинку слоем цинка толщиной 2,5 · 10-5 м, если общая площадь поверхности пластинки 0,1 м2, выход по току 90,5%. Плотность цинка 7,13 · 103 кг/м3. 5. Что называют гальваностегией? Приведите примеры. Вариант 5. 1. Бериллий получают электролизом соли BeCI2. Укажите, раствор или расплав соли подвергался электролизу. Дайте обоснование. Запишите электродные уравнения и вычислите выход по току металла, если при силе тока 2000 А в течение часа образуется 285 г металла. 2. Напишите уравнения электродных реакций при электролизе водного раствора CdSO4. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. Неочищенная медь содержит примеси Zn, Mn, Au, Ag. Что произойдет с этими примесями при электролитическом рафинировании меди? Ответ обоснуйте. Напишите уравнения электродных реакций. Укажите, к какому электроду присоединяют черновую медь. 4. Никелирование широко применяется для получения защитных и декоративных покрытий. С этой целью железное изделие общей площадью поверхности 0,08 м помещено в качестве катода в раствор соли никеля. Рассчитайте толщину отложившегося слоя никеля. Плотность никеля 8,90•103 кг/м3. Сила тока 3,15 А. Время электролиза 42 мин. Выход по току 95%. 5. Как осуществляется электрохимическое оксидирование? Напишите уравнение электродной реакции при оксидировании стали. Вариант 6. 1. Электролизом расплавов или растворов получают Sc, Y, La? Значения электродных потенциалов: Е0 Sc3+/Sc = -2,08 В, Е0Y3+/Y = -2,37 В,Е0 La3+/La= -2,4 В. Запишите уравнения электродных реакций электролитического получения иттрия из его хлорида. 2. Напишите уравнения электродных реакций при электролизе водного раствора КJ. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. Электролитический хром имеет следующий состав в %: Cr – 99,80, Fe – 0,001, Pb – 0,002, Аl – 0, Mn – 0. Почему хром, полученный электролитическим методом, содержит Аl и Mn, хотя ионы всех указанных металлов имелись в электролите, из которого металл был выделен? Ответ обоснуйте. 4. Кадмирование применяется для покрытия резьбовых деталей, а также для того, чтобы получить более прочную сборку и плотную притирку деталей. Для этой цели применяют аноды из чистого кадмия, электролит СdSO4. За 40 мин работы электролизера анод потерял в массе 1,957 г. Чему равна сила тока? 5. В чем сущность электролитического рафинирования металлов? Вариант 7. 1. Алюминий получают электролизом Аl2О3 в расплавленном криолите Na3AlF6. При температуре процесса 1200 К оксид алюминия диссоциирует на ионы : 2Аl2О3↔Аl3+ + АlО33-; 2Аl2О3 ↔Аl3+ + АlО2-. Запишите уравнение электродных реакций. Объясните причину сгорания графитовых электродов, с какой целью Аl2О3 перед электролизом тщательно очищают и обезвоживают? 2. Напишите уравнения электродных реакций при электролизе водного раствора NaOH. Какой внутренний гальванический элемент при этом образуется и какова его роль? Вычислите напряжение разложения. 3. Неочищенный свинец содержит примеси Zn, Fe, Ag, Cu. Что произойдет с этими примесями при электролитическом рафинировании свинца? Ответ обоснуйте. Напишите уравнения электродных реакций. 4. С целью защиты от коррозии деталь была оцинкована за 1 ч 40 мин. Электролит ZnSO4. Масса металла покрытия составляет 7,85 г, выход по току 77,2%. Чему была равна сила тока? Напишите уравнения электродных реакций. 5. Какова сущность электрохимической обработки металлов? Когда целесообразно ее использовать? Вариант 8. 1. Хлор может быть выделен при электролизе расплавов и растворов хлоридов. Можно ли таким же методом получить фтор? Дайте обоснование. Напишите уравнения электродных реакций при электролизе раствора и расплава KF. 2. Напишите уравнения реакций, протекающих на электродах при электролизе водного раствора CoSO4. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте Еразл. 3. При электролитическом рафинировании кобальта аноды, содержащие, помимо кобальта, никель, железо, медь, в условиях процесса полностью окисляются. Требуется ли очистка электролита от указанных примесей для получения чистого катодного кобальта? Ответ обоснуйте. Напишите уравнения соответствующих электродных реакций. 4. Деталь хромируется с защитно-декоративной целью. Сила тока 3А. Определите продолжительность электролиза для нанесения на поверхность детали 1,3 г хрома. Выход по току 40%. 5. Что называют гальванопластикой? Где она находит применение? Вариант 9. 1. Сплав кальция с литием может быть получен электролитическим методом. Исходный электролит из солей LiCl и CaCl2. Раствор или расплав этих солей подвергается электролизу? Ответ обоснуйте. Напишите уравнения электродных реакций при электролизе. 2. Напишите уравнения электродных реакций при электролизе раствора серной кислоты. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. Черновое олово, поступающее на рафинирование, содержит примеси Fe и Cu. Что происходит с этими примесями при электролитическом рафинировании олова? Ответ обоснуйте. Напишите уравнения электродных реакций. Выделяется ли наряду с оловом водород, если перенапряжение олово водорода на олове при средних плотностях тока составляет около 0,5 В? 4. Определите время, необходимое для нанесения на деталь слоя меди толщиной 3 мкм. Плотность меди 8,93.103 кг/м3, выход по току 70%, плотность по току 100 А/м3, электролит- Na [Cu(CN)2]. Напишите уравнения электродных реакций. 5. При зарядке или разрядке аккумулятор работает как электролизер? Вариант 10. 1. Напишите уравнения электродных реакций при электролизе расплава едкого натра. Учитывая возможность перемешивания электродных продуктов, напишите уравнение их взаимодействия, снижающее выход по току катодного продукта на 50%. В анодной или катодной зоне взаимодействие продуктов наиболее опасно? В какой - благоприятно? Ответ обоснуйте. 2. Напишите уравнения электродных реакций, протекающих при электролизе раствора KJ. Какой внутренний гальваноэлемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. Железо, получаемое пирометаллургическим методом, всегда содержит углерод. Чистое железо (99,95% и выше) удается получить только электролитическим способом. Анодом при этом служит мягкая мартеновская сталь. Дайте обоснование, почему для получения высокочистого катодного железа электролит не должен содержать металлов, менее активных, чем железо (Cu, Ni, и др.). Напишите уравнения электродных реакций при электролитическом рафинировании железа. 4. Золотые покрытия применяют для защиты от коррозии точных приборов или отдельных деталей. Электролит- водный раствор K[Ag(CN)2] c добавкой KCN. Сила тока 1 А. Вычислите выход по току металла покрытия, если в течение 30 мин на поверхности детали выкристаллизовалось 288 г чистого золота. Напишите уравнения катодной реакции электрокристаллизации золота. 5. Какой процесс называют электрохимическим оксидированием? Напишите уравнение электродной реакции, протекающей при оксидировании алюминия. Вариант 11. 1. Напишите уравнения реакций, происходящих при получении магния электролизом расплава соли MgCl2. Почему перед электролизом электролит тщательно обезвоживают? 2. Напишите уравнения электродных реакций при электролизе раствора HBr. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. Стальную деталь никелируют с защитно-декоративной целью. Электролит NiSO4. Сила тока 5 А. Вычислите выход по току металла покрытия, если в течение 1 ч на поверхности детали выкристаллизовалось 3,4 г чистого никеля. Напишите уравнения электродных реакций. К какому полюсу источника тока следует присоединить деталь? 4. При электролитическом рафинировании кадмия в электролите содержатся ионы Cu2+, Zn2+. От каких ионов требуется тщательная очистка электролита? К какому электроду присоединяют черновой кадмий? Напишите уравнения электродных процессов. 5. Укажите, с какой целью используются процессы электролиза в металлургии. Вариант 12. 1. Напишите уравнения электродных реакций при электролизе расплава CaCl2. Можно ли выделить металлический кальций из водного раствора этой соли? Ответ мотивируйте. 2. Напишите уравнения реакций при электролизе раствора CuCl2. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. К какому электроду присоединяют черновой никель при рафинировании? Что произойдет с примесями железа и меди? Напишите уравнения электродных реакций. 4. Железнение применяют для восстановления размеров изношенных деталей. Электролит - FeSO4. Анод – малоуглеродистая сталь. Напишите уравнения электродных реакций. Рассчитайте массу железа, выделившегося электрокристаллизацией на детали, если электролиз проводился в течение часа при силе тока 10 А. Выход по току металла 85%. 5. Какие устройства называются электрохимическими преобразователями (хемотронами)? Вариант 13. 1. Напишите уравнения электродных реакций при электролизе расплава CaCl2. С какой целью электролит перед электролизом тщательно обезвоживают? 2. Напишите уравнения электродных реакций при электролизе раствора HCl. Какой внутренний гальванический элемент при этом образуется и какова его роль? Рассчитайте напряжение разложения. 3. К какому полюсу источника тока присоединяют черновую медь при рафинировании? Что происходит с примесями (Zn, Fe, Ni, Ag, Au) в процессе рафинирования? Напишите уравнения электродных процессов. 4. Для увеличения электропроводности стальную проволоку подвергают меднению. Определите продолжительность электролиза, если электрокристаллизацией на проволоку необходимо нанести 6,4 г меди. Сила тока 5 А. Выход по току 96%. Электролит – раствор CuSO4 c добавкой H2SO4 для повышения электропроводности раствора. Напишите уравнения электродных процессов. 5. Какова сущность электромеханического шлифования и заточки инструмента? 4. Лабораторная работа по теме «Взаимодействие металлов с водой, водными растворами кислот и щелочей» Опыт 1. Действие воды на металлы: а). (Надеть защитные очки!). В фарфоровую чашку, наполненную водой, осторожно (пинцетом) помещают маленький кусочек металлического натрия (вместо натрия можно взять кальций). Чашку покрывают стеклом, чтобы не происходило разбрызгивания, и наблюдают происходящую реакцию; после окончания ее в отдельной пробе исследуют индикатором (2-3 капли фенолфталеина) полученный раствор. б). В две пробирки наливают воду и насыпают в каждую небольшое количество порошка магния. Взаимодействует ли магний с холодной водой? Затем одну пробирку нагревают, а в другую добавляют раствор хлорида аммония. Хлорид аммония растворяет пленку гидроксида, покрывающую поверхность металла: 2NH4Cl + Mg(OH)2↓→ MgCl2 + 2NH4OH. В результате этой реакции образуется NH4OH – основание более слабое, чем Mg(OH)2, поэтому ее равновесие сдвинуто вправо. При удалении пленки Mg(OH)2 происходит бурное взаимодействие металла с водой. Заметное взаимодействие металла с водой при нагревании обусловлено увеличением растворимости Mg(OH)2. в). Проверяют отношение Аl, Zn, Cu к воде на холоде и при нагревании. Дайте объяснение проведенным опытам. Составьте уравнения реакций. Сформулируйте условия, необходимые для растворения Ме в воде. Опыт 2. Действие соляной и разбавленной серной кислот на Ме. Испытывают действие указанных кислот на Аl, Fe, Pb, Cu. (В пробирку с кислотой и железом в данном и последующих опытах добавляют раствор роданида калия для определения степени окисления Fe). Форма записи:
Сделайте выводы об условиях растворения Ме в кислотах, окисляющее действие которых обусловлено только ионами водорода. Опыт 3. Действие концентрированной серной кислоты на Ме. (ТЯГА!) Проверяют действие концентрированной серной кислоты на Al, Fe, Zn, Cu. Для этого в отдельные пробирки наливают по 2-3 мл кислоты (ρ=1,86 г/мл) и бросают по кусочку указанных металлов. Если на холоде реакция не идет, слегка нагревают пробирки. Дайте объяснение опытов, составьте уравнения реакций, пользуясь ТОВП. Составьте схему взаимодействия концентрированной серной кислоты с Ме различной активности. Дайте пояснения к схеме. По отношению к каким Ме проявляется пассивирующее действие концентрированной серной кислоты? Опыт 4.Действие азотной кислоты на металлы. (ТЯГА!) В отдельных пробирках испытывают действие разбавленной азотной кислоты (ρ = 1,2) на Аl, Fe, Cu. Испытывают действие концентрированной азотной кислоты (ρ = =1,4) на Аl, Cu. Алюминиевую проволоку помещают в пробирку с соляной кислотой. Наблюдают выделение газа. Вынимают проволоку, обмывают водой и на некоторое время снова погружают в концентрированную азотную кислоту. Затем, осторожно вынув ее из азотной кислоты, обмывают водой и снова опускают в соляную кислоту. Почему не происходит выделение газа? Дайте объяснения опытов, составьте уравнения реакций, пользуясь ТОВП. Составьте схему взаимодействия азотной кислоты с Ме различной активности. Дайте пояснения к схеме. По отношению к каким Ме проявляется пассивирующее действие концентрированной азотной кислоты? Какой процесс называют депассивацией? Как осуществляют депассивацию на практике? Опыт 5. Действие щелочи на металлы Аl, Fe, Cu. В отдельных пробирках испытывают действие раствора щелочи на Аl, Fe, Cu. Дайте объяснение проведенным опытам. Составьте уравнения реакций, пользуясь ТОВП. Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. |
