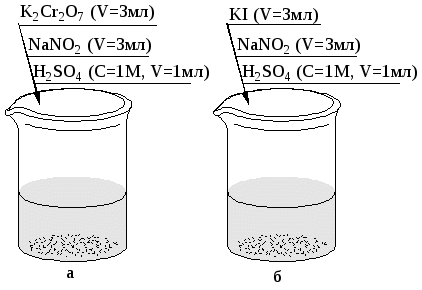Химия лабы и индивид зад. Лабораторная работа по теме гальванические элементы Опыт Гальванический элемент с деполяризатором катионом металла. По заданию преподавателя из перечисленных электродов составьте элемент
 Скачать 5.58 Mb. Скачать 5.58 Mb.
|
|
Индивидуальные задания к самостоятельной работе Вариант 1 1. Как действует вода на Nа и Аl? Сформулируйте условия, необходимые для растворения Ме в воде. 2. Как действует водный раствор щелочи на металлы Ni и Ga? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Мg и Сu в соляной кислоте? Сформулируйте условия, необходимые для растворения Ме в простой кислоте. 4. Какой металл – Сd или Аl – энергичнее взаимодействует с раствором соляной кислоты? Ответ мотивируйте. 5. Дайте анализ реакций: Fe + HNO3(разб.) → …; Fe + HNO3(конц.) → …; t Fe + HNO3(конц.) → … . 6. Дайте анализ реакции Аu + KCN + O2 + H2O → … Укажите роль КСN в этой реакции. 7. Перечислите растворители для металла Сu 8. Водные растворы HNO3 для травления высокоуглеродистых сталей неприменимы из-за их быстрого разъедающего действия. Более равномерное травление достигается действием HNO3 в метиловом спирте. Объясните эти факты. 9. Микроструктура Ni и его сплав выявляется действием азотной кислоты или серной кислоты с добавлением бихромата калия. Закончите уравнения реакций: Ni + HNO3 → …; Ni + K2Cr2O7 + H2SO4 → … . Вариант 2 1. Как действует вода на Cu и Li? Сформулируйте условия, необходимые для растворения Ме в воде. 2. Как действует водный раствор щелочи на металлы Cr и Pd? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Ag и Be в соляной кислоте. Сформулируйте условия, необходимые для растворения Ме в простой кислоте. 4. Какой металл – Zn или Ni – энергичнее взаимодействует с раствором серной кислоты? Ответ мотивируйте. 5.Дайте анализ реакций: AI + H2SO4 (конц) → …; t AI + H2SO4 (конц) → …; AI + HNO3 (разб) → … . 6. Дайте анализ реакции Pt + HNO3 + HCI →… . Укажите роль HCI в этой реакции. 7. Назовите растворители для металла Co. 8. Некий металл протравливается водным раствором HNO3 и этим же раствором с добавлением глицерина. Какой состав травителя более целесообразен, если требуется высокая скорость травления? Ответ мотивируйте. 9. Для травления медных сплавов применяются аммиачные растворы. С какой целью в эти растворы добавляется H2O2? Закончите уравнение реакции C  u + H2O2 + NH3 + H2O →… u + H2O2 + NH3 + H2O →…NH4OH Вариант 3 1. Как действует вода на K и Mn? Сформулируйте условия, необходимые для растворения Ме в воде. 2. Как действует водный раствор щелочи на металлы Ge и Cd? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Pb и Ag в уксусной кислоте? Сформулируйте условия, необходимые для растворения Ме в простой кислоте. 4. Какой металл – Fe или Co – энергичнее взаимодействует с водным раствором соляной кислоты? Ответ мотивируйте. 5. Дайте анализ реакций: Zn + HNO3 (разб) → … ; Zn + HNO3 (конц)→ …; Fe + H2SO4 (конц) → … . 6. Дайте анализ реакции Cu + NH3 + H2O + О2→… . Укажите роль NH3 в этой реакции. 7. Назовите растворители для металла Be. 8. Какой травитель сильнее действует на металл: водный раствор HNO3 или раствор HNO3 в изоамиловом спирте? Ответ мотивируйте. 9. Для выявления структуры золота применяют «царскую водку». Почему нельзя воспользоваться раствором азотной кислоты? Закончите уравнение реакции Au + HCI + HNO3 → … . Вариант 4. 1. Как действует вода на Co и Sn? Сформулируйте условия, необходимые для растворения Ме в воде. 2. Как действует водный раствор щелочи на металлы Mg и Zn? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Fe и TI в соляной кислоте? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл – Mg или Zn – энергичнее взаимодействует с водным раствором соляной кислоты? Ответ мотивируйте. 5. Дайте анализ реакции: Cr + HNO3 (разб)→ …; Cr + HNO3 (конц)→ …; t Cr + HNO3 (конц.)→ … . 6. Дайте анализ реакции Ti + HF + HNO3 → … . Укажите роль HF в этой реакции. 7. Назовите растворители для металла Fe. 8. Сравните интенсивность травления Ме водным раствором HNO3 и раствором HNO3 в пропиловом спирте? Ответ мотивируйте. 9. Для травления медных сплавов применяется раствор соли FeCI3. Почему для этих целей нельзя применять раствор FeCI2? Закончите уравнение реакции. Cu + FeCI3 → … Вариант 5 1. Как действует вода на Rb и Cr? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Sn и Mn? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Nb и Zn в разбавленном растворе серной кислоты? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл –Fe или Ni – энергичнее взаимодействует с водным раствором соляной кислоты? Ответ мотивируйте. 5. Дайте анализ реакций: Mg + HNO3 (разб)→ …; Mg + HNO3 (конц)→ …; AI + H2SO4 (конц)→ … . 6. Дайте анализ реакции Cu + KCN + O2 + H2O → … . Укажите роль KCN в этой реакции. 7. Назовите растворители для металла Ti. 8. Микроструктура титана и его сплавов выявляется растворами HF с добавлением HNO3. В качестве растворителя используют воду или глицерин. В каком случае травление происходит более интенсивно? Ответ мотивируйте. 9. Для выявления структуры платины применяют смесь кислот: HNO3, HCI. Почему нельзя воспользоваться раствором азотной кислоты? Закончите уравнение реакции Pt + HCI + HNO3 → … . Вариант 6 1. Как действует вода на Ca и Sn? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Co и Pb? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Ni и W в соляной кислоте? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл –Cr или Be – энергичнее взаимодействует с раствором щелочи? Ответ мотивируйте. 5. Дайте анализ реакций: Pb + HNO3 (разб)→ …; Pb + HNO3 (конц)→ …; Cr + H2SO4 (конц)→ … . 6. Дайте анализ реакции Rh + HNO3 + HCI → … . Укажите роль HCI в этой реакции. 7. Назовите растворители для металла Mg. 8. В каком растворителе –воде или пропиловом спирте – азотная кислота является более интенсивным травителем? Ответ мотивируйте. 9.Аммиачные растворы применяются для травления серебряных сплавов. С какой целью в эти растворы добавляется H2O2? Закончите уравнение реакции A  g + H2O2 + NH3 + H2O → … . g + H2O2 + NH3 + H2O → … .NH4OH Вариант 7 1. Как действует вода на Ba и AI? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Ag и AI? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Zn и Hg в разбавленном растворе серной кислоты? Сформулируйте условия, необходимые для растворения металла в растворе простой кислоты. 4. Какой металл –Mg или Ba – энергичнее взаимодействует с водой? Ответ мотивируйте. 5. Дайте анализ реакций: Fe + HNO3 (конц)→ …; Cu + H2SO4(конц)→ …; Mg + H2SO4 (конц)→ … . 6. Дайте анализ реакции Ag + KCN + H2O + O2 → … . Укажите роль KCN в этой реакции. 7. Назовите растворители для металла Ni. 8. С какой целью в травильный раствор, состоящий из HNO3 и HCI, добавляют глицерин? Ответ мотивируйте. 9  . Почему серебро не поддается травлению в HCI? Можно ли для этой цели использовать HNO3? Закончите уравнение реакции: . Почему серебро не поддается травлению в HCI? Можно ли для этой цели использовать HNO3? Закончите уравнение реакции:Ag + HCI + HNO3 → … . Вариант 8. 1. Как действует вода на Cs и W? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Са и TI? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Co и Au в растворе соляной кислоты? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл – Ве или Zn – энергичнее взаимодействует с водным раствором щелочи? Ответ мотивируйте. 5. Дайте анализ реакций: t Сr + HNO3 (конц)→ …; Cr + HNO3(конц)→ …; Zn + H2SO4 (конц)→ … . 6. Микроструктура циркония и его сплавов выявляется смесью разбавленных растворов HF и HNO3 Учитывая, что цирконий ведет себя подобно титану, закончите уравнение реакции: Zr + HF + HNO3 → … . Укажите роль HF в этой реакции. 7. Назовите растворители для металла Cr. 8. Пластичные сплавы индия отмечаются повышенной окисляемостью. Для их травления используют спиртовые растворы азотной кислоты. Почему не рекомендуется в этом случае водный раствор азотной кислоты? Ответ мотивируйте. 9. Универсальный растворитель для медных сплавов – раствор, содержащий NH4OH и H2O2. Можно ли медь растворить в растворе NH4OH без добавления Н2О2? Закончите уравнение реакции: C  u + H2O2 + NH3 + H2O →… . u + H2O2 + NH3 + H2O →… . NH4OH Вариант 9. 1. Как действует вода на Мg и Zn? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Ge и TI? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Co и Au в разбавленном растворе серной кислоты? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл – Zn или Fe – энергичнее взаимодействует с водным раствором щелочи? Ответ мотивируйте. 5. Дайте анализ реакций: Be + HNO3 (разб.)→ …; Al + HNO3(конц)→ …; t Al + H2SO4 (конц)→ … . 6. Основная цель для подбора реагентов для травления меди – достигнуть ее окисления за счет понижения окислительно-восстановительного потенциала меди в результате комплексообразования. Подберите такой реагент для окисления меди и закончите уравнение реакции Сu + реагент + H2О + О2 → … . Укажите роль HF в этой реакции. 7. Назовите растворители для металла Sn. 8. Общая микроструктура термически обработанных сплавов железа выявляется с помощью НСl на спирту. Почему используют спиртовые растворы кислоты, а не водные? Ответ мотивируйте. 9. Поясните, почему НF входит как составляющая в травители для ниобия и его сплавов наряду с НNO3? Учитывая, что координационное число Nb+5 равно 7, закончите уравнение реакции Nb + НF + HNO3→ … . Вариант 10. 1. Как действует вода на Li и Ti? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Al и Mg? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли Ca и Pd в соляной кислотe? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл – Al или Sn – энергичнее взаимодействует с водным раствором щелочи? Ответ мотивируйте. 5. Дайте анализ реaкций: Ag + HNO3 (конц)→ …; Ag + HNO3 (разб.)→ …; Fe + H2SO4 (конц)→ … . 6. Почему платина не поддается травлению в растворе НСl или НNO3? Что происходит с металлом, если действовать на него смесью кислот? Какова роль HCl? Закончите уравнение реакции Pt + HCl + HNO3 → … . 7. Назовите растворители для металла Zn. 8.Для выявления микроструктуры алюминия и его сплавов используют разбавленный раствор плавиковой кислоты НF. Если употребляют смесь НF и HNO3, то обязательным условием является добавление в эту смесь глицерина. С какой целью это делается? Ответ мотивируйте. 9. Структура чистого свинца и сплавов с преобладанием свинца легко выявляется реактивами, содержащими СН3СООН. Чем это можно объяснить? Почему не используют для травления НСl и H2SO4 (разб.)? Ответ подтвердите анализом соответствующих реакций. Вариант 11. 1. Как действует вода на Pb и Rb? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Mg и AI? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли металлы Pb и Pt в растворе уксусной кислоты? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл – Rb или Na – энергичнее взаимодействует с водой? Ответ мотивируйте. 5. Дайте анализ реакций: Ni + HNO3 (конц)→ …; Ni + HNO3(разб.)→ …; t Ni + H2SO4 (конц)→ … . 6. Дайте анализ реакции Os + HCl + HNO3 → … . Укажите роль HCl в этой реакции. 7. Назовите растворители для металла Pb. 8. Для выявления общей структуры ванадия применяют «царскую водку» с глицерином. С какой целью добавляют глицерин? Ответ мотивируйте. 9. Для выявления структуры серебра на него действуют раствором персульфата аммония и цианистого калия, при этом выделяется свободный кислород и происходит реакция: Ag + KCN + H2O + O2→ . Закончите уравнение реакции, пользуясь ТОВП. Вариант 12. 1. Поясните действие воды на металлы К и Fe. Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Ве и W? Сформулируйте условия, необходимые для растворения Ме в водном растворе щелочи. 3. Растворяются ли металлы Рb и Cu в разбавленном растворе сoляной кислоты? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл –Fe или Co – энергичнее взаимодействует с HCl? 5. Дайте анализ реакций: Fe + HNO3 (конц)→ …; Zn + H2SO4(конц)→ …; Al + H2SO4 (конц)→ … . 6. Дайте анализ реакции Zr + HNO3 + HF → … . Укажите роль HF в этой реакции. 7. Назовите растворители для металла Cu. 8. Какой травитель сильнее действует на Ме: водный раствор HNO3 или раствор HNO3 в изоамиловом спирте? Ответ мотивируйте. 9. Для травления медных сплавов применяется раствор FeCl3. Почему для этих целей нельзя применять раствор FeCl2? Закончите уравнение реакции Cu + FeCl3 → … . Вариант 13. 1. Как действует вода на Sn и Mg? Сформулируйте условия, необходимые для растворения металла в воде. 2. Как действует водный раствор щелочи на Be и Co? Сформулируйте условия, необходимые для растворения Ме в щелочи. 3. Растворяются ли Mg и Ca в растворе HF? Сформулируйте условия, необходимые для растворения металла в простой кислоте. 4. Какой металл – Na или Ca – энергичнее взаимодействует с водой? 5. Дайте анализ реакций: Mg + HNO3 (разб.)→ …; Сr + H2SO4(конц.)→ …; t Cr + H2SO4 (конц)→ … Ti + HF + HNO3)→ … . В последней реакции укажите роль НF. 6. Назовите растворители для металла Аg. 7. Почему добавление глицерина, этилового спирта к азотной кислоте уменьшает интенсивность окисления поверхности Ме при травлении? 8. При травлении металлографических шлифов используют реакцию: W + NaOH + H2O2→ Na2WO4 + H2O. Укажите роль обоих компонентов травителя в этой реакции. 5. Лабораторная работа ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Опыт 1. Влияние среды на окислительные свойства KMnO4 (рис. 30). 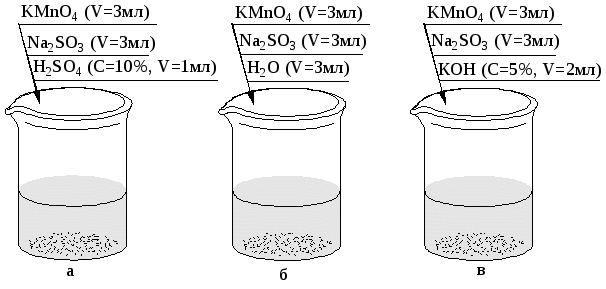 Рис. 30. Порядок проведения опыта: а – реакция в кислой среде; б – реакция в нейтральной среде; в – реакция в щелочной среде. С помощью таблицы редокс-потенциалов доказать возможность протекания предложенных реакций. Подобрать коэффициенты электронным методом. Опыт 2. Окислительно-восстановительные свойства с промежуточным значением окислительного числа (рис. 31). Подобрать коэффициенты к обоим реакциям электронно-ионным методом. Объяснить двойственность свойств NaNO2 на основе строения внешней электронной оболочки N3+.
Опыт 3. Установление возможности осуществления окислительно-востановительных реакций (рис. 32).
Рис. 32. Порядок проведения опытов: пробирка с трехвалентным раствором железа. Пользуясь таблицей окислительно-восстановительных потенциалов определить, может ли ион Fe3+ окислить ионы F-, Cl-, Br-, I-. Составить уравнение возможной реакции. |