Химия лабы и индивид зад. Лабораторная работа по теме гальванические элементы Опыт Гальванический элемент с деполяризатором катионом металла. По заданию преподавателя из перечисленных электродов составьте элемент
 Скачать 5.58 Mb. Скачать 5.58 Mb.
|
|
Содержание 1. Лабораторная работа по теме гальванические элементы Опыт 1. Гальванический элемент с деполяризатором – катионом металла. По заданию преподавателя из перечисленных электродов составьте элемент: Zn2+│Zn, Сu2+│Сu, Ni2+│Ni, Cd2+│Cd. Найдите по табл. 3 стандартные потенциалы электродов и запишите схему элемента, уравнения электродных процессов и токообразующей реакции. Покажите ход электронов во внешней цепи, а ионов - во внутренней. Вычислите ЭДС. Соберите элемент. Для этого в батарейный стакан 1 (рис. 4) вставьте пористый стакан 2. Во внутренний стакан и наружный поместите по одной выбранной металлической пластинке и залейте 1M растворами соответствующих сернокислых солей. Присоедините пластинки к вольтметру с большим внутренним сопротивлением и через 5 мин после замыкания цепи измерьте напряжение. Сделайте вывод, является ли исследуемый элемент практически поляризующимся. 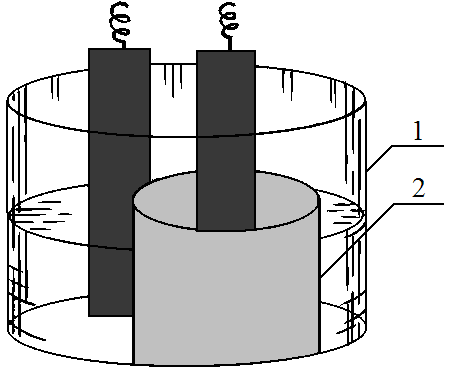 Рис. 4 Медно-цинковый элемент. Опыт 2. Определение природы газового электрода в элементе. В U - образную трубку налейте 3%-ый раствор хлорида натрия. Электроды - железный гвоздь и графитовый стержень - тщательно зачистите наждачной бумагой, промойте под краном проточной водой и погрузите в раствор. Замкните внешнюю цепь через вольтметр и наблюдайте работу элемента: наличие тока в цепи и его направление. Выключите вольтметр и замкните внешнюю цепь накоротко. Зарисуйте прибор и запишите наблюдения. Определите, с какой деполяризацией (водородной или кислородной) работает элемент. Для этого, пользуясь значениями электродных потенциалов железа (в 3%-ом растворе NaCl ЕСР = - 0,42), водородного и кислородного электродов в данной среде с учетом материала подкладки, запишите анодный и катодный процессы, уравнение токообразующей реакции и составьте схему работы элемента. (Прежде чем приступить к вычислению электродных потенциалов газовых электродов, определите, какое значение рН имеет водный раствор NaCl. Почему?). Убедитесь в наличии ионов железа, добавив в U - образную трубку 2-3 капли красной кровяной соли К3[Fe(CN)6], a наличие ионов ОН- проверьте, добавив 2-3 капли фенолфталеина. Отметьте изменение цвета. Дайте объяснение. Напишите ионное уравнение взаимодействия красной кровяной соли с ионами железа. Опыт 3. Поляризация при работе элемента и деполяризация. В проделанном опыте 2 снова включите вольтметр в цепь (не встряхивая электродов! Почему?). Наблюдайте уменьшение напряжения. Объясните наблюдаемое явление поляризации: почему и как меняется электродный потенциал катода (анода)? Какой электрод поляризуется в меньшей степени? Почему? Не размыкая внешней цепи элемента, добавьте в катодное пространство несколько капель раствора перекиси водорода. Наблюдайте и запишите изменение напряжения. Объясните процесс деполяризации в катодной зоне и роль перекиси водорода в этом процессе. ИНДИВИДУАЛЬНЫЕ ЗАДАНИЯ К САМОСТОЯТЕЛЬНОЙ РАБОТЕ. Вариант 1. 1.Вычислите потенциал электрода, на котором установилось равновесие Cl2↑ + 2ē ↔ 2Cl- при [Cl-]= 1 моль/л, РCl2=1. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала?
4.Укажите химические реакции, которые можно использовать для организации гальванического элемента: СuО + 2HCl → CuCl2 + H2O; Ni + CuSO4 → NiSO4 + Cu; H2S + NaOH → Na2S + H2O; SnCl2 + FeCl3 → SnCl4 + FeCl2. При использовании какой реакции ожидается максимальная ЭДС? 5. Составьте схему, напишите уравнения электродных процессов к токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Аl в 0,006 н Аl2(SO4)3; 2) PtвH2SО4 при pH = 3, РН2 = 1 Укажите виды поляризации этих электродов. Как поляризация сказывается на работе гальванического элемента? Вариант 2. 1. Вычислите потенциал электрода, на котором установилось равновесие Со2+ +2ē ↔ Со при [Со2+] =10-3моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве катода? Как при этом изменится значение равновесного электродного потенциала?
Ni + 2HCl → NiCl2 + H2; MgO + 2HCl → MgCl2 + H2O; Fe(OН)2 + 2HCl → FeCl2 + 2H2O; Cd+ CuCl2 → CdCl2 + Cu. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Pt в 0,005 моль/л Ва(OН)2 при РO2=1; 2) Рt в 0,05 М MgCl2 при РCl2=1. Укажите виды поляризации этих электродов. Как поляризация скажется на работе гальванического элемента? Вариант 3. 1. Вычислите потенциал электрода, на котором установилось равновесие O2 + 4Н++4ē ↔ 2Н2О при рН=4, РO2 = 1.Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала? 2.Условная схема электрода – Мn2+│Мn. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал укапанного электрода. Чему равна его ЭДС? 3. Сравните восстановительную активность цинкового электрода в щелочной и кислой среде при стандартных условиях. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент? 4. Укажите химические реакции, которые можно использовать для организации гальванического элемента: 2FeCl3 + 2KI → 2FeCl2 + I2 + 2KCl; SО3 + H2O → H2SО4; Na2CO3 + 2HCl → 2NaCl +CO2 + H2O; H2 + Cl2 →2HCl. При использовании какой реакции ожидается максимальная ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1)Cd в 0,01 моль/л CdCl2, α = 60%; 2)Pt в 0,1М NaOH при РH2=1. Укажите виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 4. 1. Вычислите потенциал электрода, на котором установилось равновесие Ni2++2ē ↔ Ni при [Ni] = 10-4моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится величина равновесного потенциала? 2. Условная схема электрода – Cl-│Cl2, Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Пользуясь формулой Нернста для водородного электрода, покажите, как изменяется его окислительная активность с изменением рН среды от 6 до 13. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент? Долго ли он будет работать? 4. Укажите химические реакции, которые можно использовать для организации гальванического элемента: BaCl2 + H2SО4 → BaSO4 + 2HCl; Н2 + О2 → 2Н2O ; CО2 + H2O → H2CО3; Zn+ 2AgNO3 → Zn(NO3)2 + 2Ag. При использовании какой реакции ожидается максимальная ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов:
2) Cr в 0,006 моль/л Cr2(SO4)3. Укажитевиды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 5. 1. Вычислите потенциал электрода, на котором установилось равновесие 2Н+ + 2ē ↔ H2↑ при рН=3, РН2=1. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать вкачестве катода? Как при этом изменится значение равновесного электродного потенциала? 2. Условная схема электрода – Со2+, Со3+│Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чемуравна его ЭДС?
Zn+ 2AgNO3 → Zn(NO3)2 + 2Ag; Al(OН)3 + NaOH → NaAlO2 + 2H2O; 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑; H2SО4 + 2NaOH → Na2SО4 +2 H2O. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Fe в 0,001M FeSO4; 2) Pt в 0,005 М H2SO4 РO2=1. Укажите виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 6. 1. Вычислите потенциал электрода, на котором установилось равновесие Sn4+ 2ē ↔ Sn2+ при [Sn4+]=10-4 моль/л, [Sn2+] =10-2 моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала? 2. Условная схема электрода – ОН-│О2, Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Сравните восстановительную активность никелевого электрода при стандартных условиях и при [Ni2+] = 10-3моль/л. Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент? Долго ли он будет работать? 4. Укажите химические реакции, которые можно использовать для организации гальванического элемента: MnО2 + 2HCl → MnCl2 + H2O; CaS + 2HCl → CaCl2 + H2S↑; Mn + 2HCl → MnCl2 + H2 ↑; H2 + I2 → 2HI. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Ni в 1М NiSO4; 2) Pt в 1М NaCl, РH2=1. Укажете виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 7. 1. Вычислите потенциал электрода, на котором уставилось равновесие J2(т)+2ē ↔ 2J- при [J-] =10-2 моль/л. Укажите тип электрода. Дайте характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве катода? Как при этом изменится значение равновесного потенциала? 2. Условная схеме электрода – Ni2+│Ni. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Сравните окислительную активность стандартного электрода в щелочной среде и в растворе с pН=10, РO2=1.Составьте схему элемента из указанных электродов. Вычислите ЭДС. Как называется такой элемент? Долго ли он будет работать? 4. Укажите химические реакции, которые могут быть использованы для организации гальванического элемента: Fe + CuSO4 → FeSO4 + Cu; Mg + 2HCl → MgCl2 + H2 ↑; 2NaOH + CuSO4 → Cu(OН)2 + Na2SO4; MgO + 2HCl → MgCl2 + H2O. При использовании какой реакции ожидается максимальное значение ЭДС? 5. Составьте схему, напишите уравнения электродных процессов и токообразующей реакции, вычислите ЭДС элемента, составленного из электродов: 1) Pt в 0,1М FeCl2 и 0,1М FeCl3; 2) Pt в 0,001 моль/л НCl, РH2=1. Укажете виды поляризации этих электродов. Как поляризация отражается на работе гальванического элемента? Вариант 8. 1. Вычислите потенциал электрода, на котором уставилось равновесие Cu2++ 2ē ↔ Cu при [Cu2+] = 10-3 моль/л. Укажите тип электрода. Дайте его характеристику. В какую сторону сместится равновесие, если электрод будет работать в качестве анода? Как при этом изменится значение равновесного потенциала? 2.Условная схема электрода – S2-│S, Pt. Укажите тип электрода. Дайте его характеристику. При каких условиях потенциал этого электрода будет иметь стандартное значение? Составьте схему элемента, с помощью которого можно измерить стандартный потенциал указанного электрода. Чему равна его ЭДС? 3. Сравните восстановительную способность стандартного водородного электрода и водородного электрода при рН=11, РH2=1. Составьте схему элемента из указанных электродов. Вычислите его ЭДС. Как называется такой элемент? Долго ли он будет работать? 4. Укажите химические реакции, которые можно использовать для организации гальванического элемента: |
