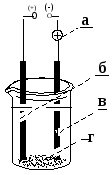
Химия лабы и индивид зад. Лабораторная работа по теме гальванические элементы Опыт Гальванический элемент с деполяризатором катионом металла. По заданию преподавателя из перечисленных электродов составьте элемент
 Скачать 5.58 Mb. Скачать 5.58 Mb.
|
|
7. Индивидуальные задания по теме «Строение атома» Вариант 1. 1. Что характеризует главное квантовое число? Какое значение имеет главное квантовое число для внешних электронов атома цинка? 2. Сформулируйте принцип Паули. Определите электронную емкость пятого энергетического уровня. 3. Напишите полные электронные формулы атомов железа и кобальта. Являются ли они электронами аналогами? 4. Напишите полные электронные формулы атомов с порядковыми номерами 75, 85, 95. Укажите, к какому семейству относится атомы этих семейств, определить их валентные электроны внешнего. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов фтора и иода в стационарном и возбуждённом состояниях. 7. Определите возможные окислительные числа атомов серы и кобальта. 8. Что называется потенциалом ионизации? Как изменяется значение ионизационного потенциала в периодах периодической системы элементов? 9. Определите свойства элементов с порядковым номером 49. Вариант 2. 1. Что характеризует орбитальное квантовое число? Сколько и какие значения может принимать орбитальное квантовое число при главном квантовом числе, равном 4? 2. Сформулируйте принцип наименьшей энергии. Какой энергетический подуровень атома заполняется раньше: 5s или 4p? Почему? 3. Напишите электронную формулу атома селена и его полного электронного аналога. 4. Напишите полные электронные формулы атомов с порядковым номером 72, 82, 92. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов S, S2-, S4+, S6+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов кислорода и теллура в стационарном возбуждённом состояниях. 7. Определите возможные окислительные числа атомов йода и железа. 8. Сравните радиусы атомов технеция и рения, йода и астата. Ответ мотивируйте. 9.Определите свойства элемента с порядковым номером 50. Вариант 3. 1. Что характеризует магнитное квантовое число? Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном квантовом числе l= 0? 2. Сформулируйте правило Гунда. Разместите шесть d- электронов по энергетическим ячейкам (орбиталям) d- подуровня. 3. Напишите полные электронные формулы атомов мышьяка и германия. Являются ли они электронными аналогами? 4. Напишите полные электронные формулы атомов с порядковыми номерами 74, 84, 94. Укажите, к какому семейству относятся атомы этих элементов. Определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов C, C4-, C2+, C4+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов фосфора и мышьяка в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов кислорода и осмия . 8. Что называется сродством к электрону? Как изменяется значение сродства к электрону в периодах периодической системы элементов? 9. Определите свойства элемента с порядковым номером 51. Вариант 4. 1. Что характеризует спиновое квантовое число? Сколько и какие значения может принять спиновое квантовое число при магнитном квантовом числе m2 = 0 ? 2. Сформулируйте принцип Пауля. Может ли быть на каком-либо подуровне атома р8 или d11 электронов? Почему? 3. Напишите электронную формулу атома цинка и его полного электронного аналога. 4. Напишите полные электронные формулы атомов с порядковыми номерами 76, 65, 95. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов N, N3-, N1+, N5+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможныевалентности атомов углероде и иода в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов фтора и рутения. 8. Что такое элоктроотрицательность? Как изменяется значение электроотрицательности в периодах периодической системы элементов? 9. Определите свойства элемента с порядковым номером 52. Вариант 5. 1. Сколько и какие значения может принимать магнитное квантовое число для данного орбитального квантового числа L=3? Как можно интерпретировать эти значения? 2. Сформулируйте принцип наименьшей энергии. Какой энергетический подуровень атома заполняется электронами раньше; 4Sили 3d? Ответ мотивируйте. 3. Напишите полные электронные формулы атомов калия и франция. Являются ли они электронными аналогами? 4. Напишите полные, электронные формулы атомов с порядковыми номерами 73, 83, 93. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите полные формулы атома и ионов Cl, Cl1, Cl5+, Cl7+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов неона и аргона в стационарном и возбужденном состояниях. 7. Определите возможные числа атомов cелена и рения. 8. Сравните радиусы атомов серебра и золота, цезия и франция. 9. Определите свойства элементов с порядковым номером 72. Вариант 6. 1. Сколько и какие значения может принимать орбитальное квантовое число для данного главного квантового числа n = 3. Как можно интерпретировать эти значения? 2. Сформулируйте правило Гунда. Разместите три электрона по энергетическим ячейкам (орбиталям) р- подуровня. 3. Напишите электронные формулы атомов йода и его полного электронного аналога. 4. Напишите полные электронные формулы атомов о порядковыми номерами 57, 81, 91. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов Br, Br1-, Br1+, Br7+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов гелия и криптона в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов астата и технеция. 8. Как изменяются значения атомных радиусов в периодах? Сравните радиусы атомов железа и кобальта. 9. Определите свойства элемента с порядковым номером 73. Вариант 7. 1. Какое квантовое число определяет количество энергетических состояний (орбиталей) в данном подуровне атома? Чему оно равно на s- , р- , d- , f- подуровнях? 2. Определите емкость q- подуровня (l=4), пользуясь принципом Паули. На каком энергетическом уровне возможен такой подуровень? 3. Напишите электронные формулы атомов ртути и таллия. Являются ли они электронными аналогами? 4. Напишите полные электронные формулы атомов с порядковыми номерами 53, 77, 100. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и иона Te, Te2+, Te4+, Te6+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов фтора и брома в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов серы и железа. 8. Что называется ионизационным потенциалом? Как изменяется значение ионизационного потенциала в главных подгруппах периодической системы элементов? 9. Определите свойства элемента с порядковым номером 74. Вариант 8. 1. Какое квантовое число определяет количество энергетических подуровней на данном энергетическом уровне атома? Чему оно равно на пятом энергетическом уровне? 2. Определите емкость f - подуровня (l= 3), используя принцип Паули. На каком энергетическом уровне возможен такой подуровень? 3. Напишите электронную формулу атома кремния и его электронного аналога. Есть ли у него полные электронные аналоги? 4. Напишите полные электронные формулы атомов о порядковыми номерами 52, 78, 102. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов As, As3-, As3+, As5+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов кислорода и селена в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов алюминия и астата. 8. Что называется сродством к электрону? Как изменяется значение сродства к электрону в главных подгруппах периодической системы элементов? 9. Определите свойства элемента с порядковым номером 75. Вариант 9. 1. Какое квантовое число определяет количество энергетических уровней в атоме? Чему оно равно для атомов рутения и палладия? Дайте необходимые пояснения. 2. Почему у атома калия формирование четвертого энергетического уровня идет при незавершенном третьем энергетическом уровне? 3. Напишите полные электронные формулы атомов аргона и неона. Являются ли они электронными аналогами? 4. Напишите полные электронные формулы атомов с порядковыми номерами 51, 67, 104. Укажите, к какому семейству относятся атомы этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов Se, Se2-, Se4+, Se6+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов неона и ксенона в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов фтора и марганца. 8. Сравните радиусы атомов кадмия и ртути, бария и радия. 9. Определите свойства элемента с порядковым номером 74. Вариант 10. 1. Сколько пространственных ориентаций имеет S-облако? Значением какого квантового числа это определяется? Как изображается условно? 2. Может ли заполнена электронами энергетическая следующим образом: ↑↑ ? Ответ мотивируйте. 3. Напишите полную электронную формулу атома урана. Назовите его электронные аналоги. 4. Напишите полные электронные формулы атомов с порядковыми номерами 50, 70, 105. Укажите, какому семейству относятся атомы этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные атома и ионов Sb, Sb3-, Sb3+, Sb5+. Дайте их окислительно-востоновительную характеристику. 6. Определите возможные валентности атомов фтора и астата в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов углерода и осмия 8. Что такое электроотрицательность? Как изменяется значение электроотрицательности в главных подгруппах периодической системе элементов? 9. Определите свойства элемента с порядковым номером 75. Вариант 11. 1. Сколько пространственных имеет р-облако? Значениями какого квантового числа это определяется? Как изображается условно? 2. Почему принцип Паули иногда называют запретом Паули? Может ли быть на каком- либо подуровне атома f13 или S3- электронов? 3. Напишите полные электронные формулы атомов радия и октания. Являются ли они электронными аналогами? 4. Напишите полные электронные формулы атомов с порядковыми номерами 73, 84, 99. Укажите, к какому семейству атома этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или к неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов P, P3+, P5+. Дайте их окислительно-восстановительную характеристику. 6. Определите возможные валентности атомов кислорода и полония в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов кремния и висмута, 8. Сравните радиусы атомов хрома и молибдена, молибдена и вольфрама. 9.Определите свойства элемента с порядковым номером 76. Вариант 12. 1. Сколько пространственных ориентации имеет d- облако7 Значением какого квантового числа это определяется? Как изображается условно? 2. Разместите восемь электронов по энергетическим ячейкам (орбиталям) f— подуровня. Каким правилом следует руководствоваться? 3. Напишите электронную формулу атома вольфрама и его полного экстренного аналога. 4. Напишите полные электронные формулы атомов с порядковыми номерами 56, 86, 91. Укажите, к какому семейству относятся атома этих элементов, определите их валентные электроны и электроны внешнего слоя. К металлам или неметаллам относятся эти элементы? 5. Напишите электронные формулы атома и ионов C, N2+ , S6+, C4+. Дайте их окислительно-восстоновительную характеристику. 6. Определите возможные валентности атомов, свинца и неона в стационарном и возбужденном состояниях. 7. Определите возможные окислительные числа атомов йода и вольфрама. 8. Как изменяется значения атомных радиусов в побочных подгруппах периодической системы элементов? Ответ мотивируйте. 9.Определите свойства элемента с порядковым номером 81. Вариант 13. 1. Сколько пространственных ориентации имеет f – облако? Значениями какого квантового числе это определяется? Как изображается условно? 2. Какой принцип позволяет определить последовательность заполнения энергетических уровней и подуровней в атоме? Сформулируйте этот принцип. 3. Напишите полные электронные формулы атомов рения и осмия. Являются ли они электронными аналогами? 4. Напишите полные электронные формулы атомов с порядковыми номерами 88, 84, 101.Укажите, к- какому семейству относятся атомы этих элементов, определите их валентные валентные электроны и электроны внешнего слоя.К металлам или к неметаллам относятся эти элементы? 5. Напишите полные электронные формулы атома и ионов S, Br1-, P3+, N3+. 8. Лабораторная работа по теме «Химическая связь» Опыт 1. Химическая связь. Теория поляризации ионов и свойства веществ. Кислотно-основные свойства оксидов, гидроксидов и солей. Оксид и гидроксиды магния и кальция (рис. 14). Расход этилового спирта для приготовления раствора фенолфталеина 0,30 мл.  Рис. 14. Порядок проведения опыта: а, б – пробирки с оксидом магния; в – пробирка с оксидом кальция. Опыт 2. Свойства фосфорного ангидрида и диоксида углерода (рис. 15).  Рис.15. Порядок проведения опыта: а – пробирка с Р2О5; б – пробирка для определения химических свойств СО2. Опыт 3. Получение и свойства гидроксидов алюминия и олова (рис. 16).  Рис. 16. Порядок проведения опыта: а – г – пробирки с соответствующими растворами. В пробирки вводить растворы Al3+ (5%-ный) и SnCl4 (30%-ный) по каплям до полного растворения осадков. Опыт 4. Получение кремниевой кислоты (рис. 17). Расход этилового спирта для приготовления раствора фенолфталеина 0,30 мл.  Рис. 17. Порядок проведения опытов: а – г – пробирки с раствором жидкого стекла Na2SiO3. Газообразный углекислый газ получают из аппарата Кипа. В пробирке проверяют характер среды введением в раствор жидкого стекла при помощи фенолфталеина. Опыт 5. Влияние силы кислоты основания, образующих соль, на степень гидролиза (рис. 18).  Рис. 18. Порядок проведения опыта: а – д – пробирки. Характер среды в пробирках а, б, в и д проверяют метилоранжем (МО), в пробирке г – фенолфталеином (ФФ). Напишите уравнения возможных реакций молекулярной и ионной форме. В растворе какой соли больше концентрация ионов H+ и, следовательно, степень гидролиза? Обьясните наблюдаемые явления, сравнив поляризующие действие Na+, Mg2+, Al3+ и силу соответствующих оснований. Теоретически докажите, степень гидролиза какой соли Na2SiO3 или Na3PO4 (при одинаковой полярности и температуры) - должна быть больше? Сделайте общий вывод о влиянии силы основания и кислоты, образующих соль, на степень ее гидролиза. Можно ли на основании теории поляризации ионов по периодической системе Менделеева вывести общие закономерности изменения степени гидролиза солей (по катиону, по аниону). Сделайте общий вывод о влиянии ионности химической связи на кислотно-основные свойства сложных веществ. Опыт 6. Окраска неорганических соединений (рис. 19). В области неорганической химии найдена зависимость между окраской и степенью ионности связи между атомами в молекуле. Ослабление степени ионности химической связи в молекуле способствует из появлению к усилению окраски веществ. На основании сравнения окраска поляризующих свойств ионов объясните изменение степени ионности в ряду соединений: а) TiO2, V2O5, Mn2O7 б) ZnS, CdS, HgS. В ряду Zn2+, Cd2+, Hg2+ поляризуемость ионов увелививается. Почему? Почему увеличение радиуса в ряду ионов Zn2+, Cd2+, Hg2+ приводит к увеличению их поляризующего действия? Сопоставьте окраску следующих соединений: PbCl2, PbI2, PbS. Установите влияние радиуса, заряда на деформируемость анионов и степень ионности химической связи указанных веществ. Опыт 7. Физические свойства веществ с различным типом связи и кристаллических решеток.
Опыт 8. Электропроводность расплавов и растворов. Плавление проводит в тигле, помещенном в муфельную печь (рис. 20).
Чем объясняется высокая температура плавления веществ, имеющих ионную решетку? Охарактеризуйте твердые вещества с различным типом кристаллических решеток и типом связи по электропроводности, температуре плавления, твердости. Опыт 9. Различие между двойными и комплексными солями (рис.21). 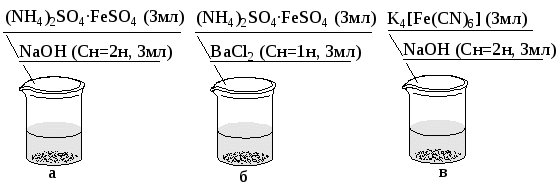 Рис. 21. Схема выполнения опыта: а, б- пробирки с двойной солью; в- пробирка с комплексным соединением. Выпадает ли белый осадок? На основании проделанных опытов запишите сокращенно ионные уравнения химических реакций и электролитическую диссоциацию соли Мора. |