Рабочая лекционная тетрадь по Контролю качества. Лекарственные средства, производные спиртов Спирт этиловый
 Скачать 1.99 Mb. Скачать 1.99 Mb.
|
|
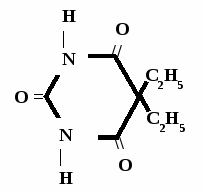
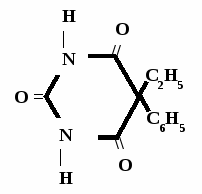
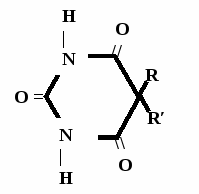
Н НО – Н  Н  Н  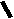 Н О = 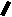 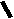 ↔ ↔ ↔ ↔  \\ О N | H \\ О N | H  \\ О N | H  ↨ ↨  ОН /  О //    Л N N актимный Лактамный Лактимный ф  Н  рагмент фрагмент фрагмент рагмент фрагмент фрагмент Н  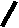 НО – 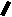 Н О = 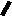 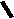 Н 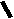  \ ОН N   \ ОН N  Для барбитуровой кислоты характерны кислотные свойства за счет подвижного атома водорода в 5-ом положении, а также в 1-ом и в 3-ем положениях. Производные барбитуровой кислоты содержат заместители при атоме углерода в 5-ом положении. Для них кето-енольная таутомерия невозможна, т.к. отсутствуют атомы водорода при атоме углерода в 5-ом положении.  Производные барбитуровой кислоты проявляют слабые кислотные свойства за счет лактимной формы. Производные барбитуровой кислоты проявляют слабые кислотные свойства за счет лактимной формы. О // H | N 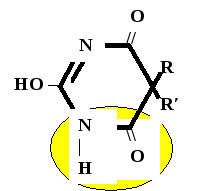  ОН /  N R  R   О = 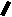 О = 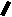 R′ 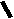 R′ 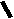 ↔ ↔ ↔ ↔ N | H  \\ О N | H  \\ О ↨ Н N   О //  R′ R \ ОН   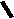 N  В медицине широко применяются барбитураты-кислоты (барбитал, фенобарбитал, бензонал и др.) и барбитураты-соли (барбитал-натрий, этаминал-натрий, гексенат, тиопентал-натрий и др.). О = Физические свойства Барбитураты-кислоты – Барбитал, Фенобарбитал- белые кристаллические порошки без запаха, нерастворимы в воде, р-рах щелочей, органических растворителях. Возгоняются при нагревании. Барбитураты-соли – Барбитал Na, Этаминал Na- растворяются в воде, плохо в органических растворителях. Разлагаются под действием влаги и углекислоты. Подлинность
 R O R Oto \ // + 5 NaOH → 2 NH3↑ + 2 Na2CO3 + CH – C / \ R′ ONa Na2CO3 + 2 HCl → CO2↑ + 2 NaCl + H2O Пузырьки газа R O R O \ // \ // CH – C + HCl → NaCl + CH – C / \ / \ R′ ONa R′ OH
А 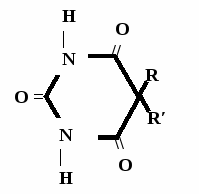 ) Если барбитурат-кислота – сине-фиолетовое окрашивание ) Если барбитурат-кислота – сине-фиолетовое окрашивание 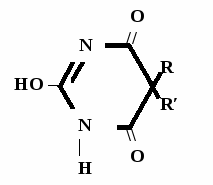 ↔ + NaOH → 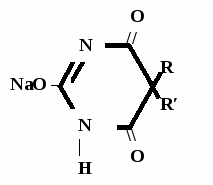 CaCl2 → + Co(NO3)2 → 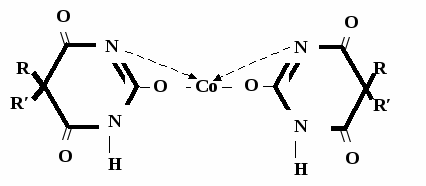 Б) Р-ция Романовой (выполняется в слабощелочной среде, т.к. в кислой среде комплекс разрушается). Р-ция отличия одного барбитурата от другого!   ↔ + NaOH →  K2CO3 + KHCO3 → + CuSO4 → 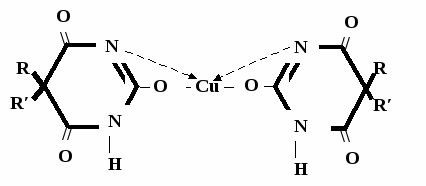 → Барбитал – синее окрашивание, при стоянии красно-сиреневый осадок Фенобарбитал - бледно-сиреневый осадок Барбитал Na - синее окрашивание, при стоянии красно- сиреневый осадок Этаминал Na - голубой осадок В) с AgNO3 → серебряная соль 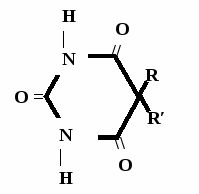 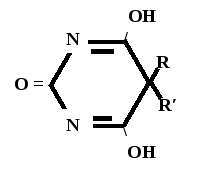 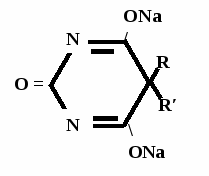 + Na2CO3 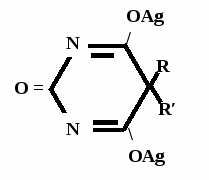 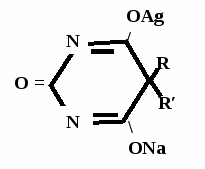 + AgNO3 → + AgNO3 → ↓ Однозамещенная соль Двузамещенная соль
 →  + HCl → ↓ + NaCl + HCl → ↓ + NaCltoпл.
Количественное определение
Метод основан на усилении слабых кислотных св-в пр-та при растворении его в растворителе протогенного характера. Методика: Тн пр-та растворяют в ДМФА (диметилформамид) + индикатор тимоловый синий и титруют 0,1 н р-ром NaOH в смеси бензола и этанола до синего окрашивания  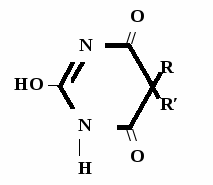 R R ДМФА O = ↔ + NaOH → 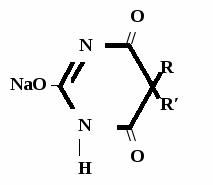 1 моль 1 экв. → + H2O fэкв. = 1 M1/z = М
Метод основан на кислотных св-вах препарата за счет ациформы Методика: Тн пр-та растворяют в спирте + индикатор тимолфталеин и титруют 0,1 н р-ром NaOH до голубого окрашивания   ↔ +NaOH →  1 моль 1 экв. → + H2O fэкв. = 1 M1/z = Mm
Метод основан на гидролизе водных р-ров натриевых солей с выделением эквивалентного кол-ва Na, которое оттитровывают HCI. Методика: Тн пр-та растворяют в воде + м/о и титруют 0,1 н р-ром HCI до розового окрашивания.   + HOH → ↓ + NaOH NaOH + HCl → NaCl + H2O 1 моль 1 экв. fэкв. = 1 M1/z = М 4. Метод аргентометрии Метод основан на способности барбитуратов образовывать однозамещенные и двузамещенные серебряные соли. А  ) без индикатора – выполняют в присутствии Na2CO3 и титруют АgNO3 до появления устойчивой мути ) без индикатора – выполняют в присутствии Na2CO3 и титруют АgNO3 до появления устойчивой мути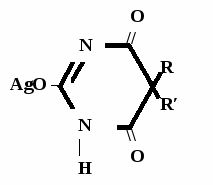 + Na2CO3 + АgNO3 - 2 NaNO3 - CO2 - H2O 1 моль 1 экв. 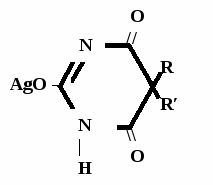 О // 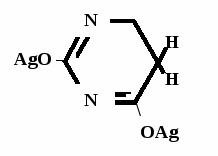 + Na2CO3 + Na2CO3 + AgNO3 → ↓ - 2 NaNO3 - CO2 - H2O fэкв. = 1 M1/z = М Б) с индикатором – хроматом калия – выполняют в присутствии буры и титруют АgNO3 до желто-оранжевого осадка  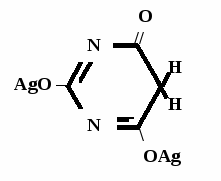 + 2 АgNO3 ↓ 2 AgNO3 + K2CrO4 → Ag2CrO4↓ + 2 KNO3 fэкв. = 1/2 M1/z = М/2
БАРБИТУРАТЫ – КИСЛОТЫ
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||