|
Рабочая лекционная тетрадь по Контролю качества. Лекарственные средства, производные спиртов Спирт этиловый
БАРБИТУРАТЫ – СОЛИ
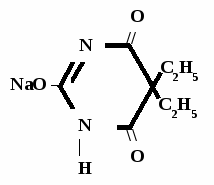
Барбитал-натрий
Мединал
|
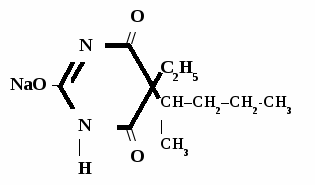
Этаминал-натрий
Нембутал
|
Barbitalum-natrium
Medinalum
Barbital Sodium*
|
Aethaminalum-natrium
Nembutalum
|
|
|
5,5-диэтилбарбитурат натрия
|
5-этил-5-(2-амил)-барбитурат натрия
|
Свойства
|
Белые кристаллические порошки, без запаха, горького вкуса. Гигроскопичны, легко растворимы в воде. Водные растворы имеют щелочную среду 9-11. Не растворимы в органических растворителях.
|
Нерастворим в спирте
|
Растворим в спирте
|
Подлинность
|
р-ция сплавления с NaOH
|
с солями тяжелых металлов, с Ca(NO)3 – общая р-ция – сине- фиолетовое окрашивание
|
р-ция Романовой- NaOH 1% + KHCO3 + K2CO3 + CuSO4
|
Синее окрашивание, при стоянии красно-сиреневый осадок
|
Голубой осадок
|
р-ция выделения кислотной формы с HCI
|
р-ции на катион Na
|
Количественное определение
|
Метод ацидиметрии, способ прямого титрования (ГФ и экспресс). Индикатор - м/о
|
Метод ФЭК
|
Метод аргентометрии
|
Применение
|
ФВ: инъекционные растворы, клизмы
|
Снотворное д-е
|
Снотворное, противосудорожное д-е. Наркотический эффект.
|
Хранение
|
Список II. В ХУТ, в сухом месте, т. к гигроскопичны.
|
ВИТАМИНЫ ПИРИМИДИНТИАЗОЛОВОГО РЯДА И ИХ ПРОИЗВОДНЫЕ
Тиамина хлорид
|
Тиамина бромид
|
Thiamini chloridum
Thiamine Chloride*
|
Thiamini bromidum
Thiamine Bromide*
|
Vitaminum B1
|
CH2 –N+
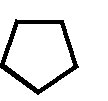
CH3
 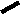

N
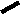   
– CH2 – CH2 – OH
Cl- • HCl
S
H3C
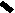
NH2
N

|
CH2 –N+

CH3
 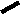

N
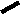 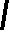  
– CH2 – CH2 – OH
Br- • HBr • 1/2H2O
S
H3C
NH2
N

|
4-метил-5 β -оксиэтил-N-(2′-метил- 4′- амино-5′-метилпиримидил)-тиазолий
|
хлорида гидрохлорид
|
бромида гидробромид
|
Свойства
|
Белый кристаллический порошок
|
Белый или со слегка желтоватым оттенком кристаллический порошок
|
С ощутимым запахом. Легко растворимы в воде, мало растворимы в спирте. Устойчивы к сильно кислой среде и устойчивы к действию окислителей. Легко разрушается в щелочной среде с образованием тиохромной формы.
|
Гигроскопичен
|
|
Подлинность
|
1. р-ция с NaOH, в качестве окислителя K3 [Fe(CN)6] → тиохром, который извлекается бутиловым (изоаминовым) спиртом. В УФ наблюдается синяя флюоресценция, которая изчезает при подкислении раствора и вновь появляется при подщелачивании.
|
2. экспресс анализ- р-ция с реактивом Неслера → желтое окрашивание → черное
|
3. с пикриновой к-той → желтый осадок
|
4. с р-ром йода → красно-коричневый осадок
|
5. с NaOH 15% → желтое окрашивание
|
6. сплав c кристаллическим NaOH → разрушение с образованием S, которая определяется р-ром нитропруссида Na → красно-фиолетовое окрашивание
|
7. (на хлорид-ион) — АgNO3 → белый
|
(на бромид-ион) — АgNO3→ желтоватый
|
|
(на бромид-ион – отличие) — с р-ром хлорамина + HCI + хлороформ → слой хлороформа окрашивается в желто- бурый цвет
|
Количественное определение
|
1. Метод неводного титрования (ГФ)
Метод основан на усилении слабых основных свойств препарата при растворении его в растворителе протогенного характера.
Методика: Тн пр-та растворяют в ледяной уксусной к-те + уксусный ангидрид+ индикатор кристаллический KBr и титруют 0,1 н р-ром хлорной к-ты до зеленого окрашивания
[Thiam]•Cl•HCl + 2 HClO4 + Hg(CH3COO)2 → [Thiam]•2HClO4 + HgCl2 + 2 CH3COOH
fэкв. = 1/2 M1/z = М/2
|
|
Метод аргентометрии после нейтрализации
Проводят нейтрализацию щелочью. Сумму бромид-ионов оттитровывают нитратом серебра. Расчеты ведут по разнице объемов (VAgNO3 – VNaOH)
2 AgNO3
[R3N]•Br•HBr + NaOH → [R3N]•Br + NaBr →
[R3N]•NO3 + 2 AgBr↓ + NaNO3
fэкв. = 1/2 M1/z = Mm/2
|
Метод алкалиметрии
Метод основан на вытеснении слабого органического основания более сильным минеральным
Методика: Тн пр-та растворяют в воде + индикатор бромтимоловый синий и титруют 0,1 н р-ром NaOH → до голубовато- зеленого окрашивания
|
[R3N]•Cl•HCl + NaOH → [R3N]•Cl + NaCl
|
[R3N]•Br•HBr + NaOH → [R3N]•Br + NaBr
|
fэкв. = 1 M1/z = 1
|
5. Метод аргентометрии по Фаянсу
Методика: Тн пр-та растворяют в воде + индикатор бромфеноловый синий и по каплям разведенную уксусную к-ту, титруем 0,1 н р-ром Ag NO3 до фиолетового окрашивания.
|
Применение
|
- при нарушении функций нервной системы, невриты, неврозы;
- при гипо- и авитаминозе витамина В1;
- энцефалопатия;
- пептическая язва желудка и ДПК;
ФВ: р-р для инъекций, комплексные препараты.
|
Хранение
|
В ХУТ, в защищенном от света месте без контакта с металлами (обр-ся неактивный дигидротиамин)
|
АЛКАЛОИДЫ
Это вещества основного характера, растительного реже животного происхождения. Получают синтетически.
Классификация алкалоидов
Производные пиридина и пиперидина (анабазин, никотин, лобелин)

N N
|
Н
Производные тропана (атропин, скополамин, гиосциамин))

N – CH3
Производные хинолина (хинин)
N
Производные изохинолина (все алкалоиды опия- папаверина г/хл, дротаверин)

N
Производные индола (резерпин, стрихнин)
N
|
Н
Производные пурина (теофиллин, теобромин, кофеин- обладают амфотерными свойствами)
 NH NH
N
N N
Физические свойства
Алкалоиды-основания
Алкалоиды-соли -
Химические свойства
∙∙
R3N + H+X- → [R3N+]X-
|
H
R3N • HCl + NaOH → NaCl + R3N↓ + H2O
Общеалкалоидные реакции
Реактив Бушарда, Вагнера или Люголя (KI + I2= KI3 перйодид калия) р-ция выполняется в кислой среде HCI – бурые осадки
Реактив Майера (HgI2 + КI = K2[HgI4] в нейтральной или слабокислой среде –осадки белые или желтоватые (исключение: кофеин и колхицин)
Реактив Драгендорфа (BiI3 + KI = K[BiI4] тетрайодависмутат калия) - осадки оранжевого цвета
Реактив Зонненштейна (H3PO4•12MoO3•2H2O – фосфорно-молибденовая к-та) сначала осадки желтого цвета → синие → зеленые (восстановление молибденовой к-ты). Это наиболее чувствительный реактив на алкалоиды.
Реактив Шейблера (H3PO4•12WO3•2H2O – фосфорно-вольфрамовая к-та) – белые осадки.
Раствор танина (свежеприготовленный 10%-ый водный раствор) – среда нейтральная или слабокислая - осадки белого цвета или желтоватые
Пикриновая кислота (1%-ый раствор) – желтые осадки (исключение: кофеин, теобромин, морфин).
Реактив Марки (раствор формалина в концентрированной серной кислоте) – разные окрашенные осадки
Реактив Фреде (раствор молибдата аммония (NH4)2MoO4 в концентрированной серной кислоте) – разные осадки
Реактив Марме (CdI2 + KI- йодид кадмия в йодиде калия) - дает желтые осадки.
Групповые реакции на алкалоиды
На производные тропана – Реакция Витали-Морена – на остаток троповой кислоты за счет фенильного радикала.
На производные хинина – Талейохинная проба
На производные пурина – Мурексидная проба
Количественное определение
Титриметрические методы
- неводное титрование – для всех алкалоидов
- ацидиметрия (нейтрализация) – для алкалоидов-оснований
- алкалиметрия (вытеснение) – для алкалоидов-солей
- йодометрия (обратное титрование) – для многих алкалоидов
- аргентометрия – для алкалоидов-солей галогеноводородных кислот
Гравиметрия (весовой метод)
Физико-химические методы (ФЭК, СФ, хроматография)
Лекарственные средства, производные изохинолина
У изохинолина в отличие от хинолина гетероатом азота находится во 2-ом положении.
N
N
хинолин изохинолин
В медицине применяются производные:
1) 1-бензилизохинолина,
2) фенантренизохинолина
Источником получения этих алкалоидов является опий – млечный сок незрелых плодов мака снотворного. Эти алкалоиды либо сами применяются в качестве ЛС, либо являются источниками получения их полусинтетических аналогов.
Производные 1-бензилизохинолина
Папаверина гидрохлорид
Papaverini hydrochloridum
Papaverine Hydrochloride*
H3C – O
H3C – O N
• HCl
H3C – O
6,7-диметокси-1-(3′,4′-диметокси-
H3C – O бензил)- изохинолина гидрохлорид
Свойства
Белый кристаллический порошок без запаха, слегка горьковатого вкуса. Медленно растворим в воде, легко растворим в горячей воде. Мало растворим в спирте. Гидролизуется.
Подлинность
с конц. серной к-той при нагревании → фиолетовый осадок
с конц. HNO3 при нагревании → желтый→ при дальнейшем нагревании оранжевый осадок
t плавления
УФ, ИК
(ОТЛИЧИЕ ОТ КОДЕИНА!!!)
|
|
|
 Скачать 1.99 Mb.
Скачать 1.99 Mb.






 NH
NH