Физ химия курс лекций. Лекция 1 Тема Химическая термодинамика
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
|
коррозии При достижении некоторой влажности воздуха, называемой критической, скорость коррозии резко увеличивается. Это соответствует появлению сплошной пленки влаги на поверхности металла вследствие ее конденсации. В чистом воздухе критическая влажность составляет 100 %, а в присутствии некоторых загрязнителей, в частности оксида серы (4), она снижается до 70 %. Зависимость скорости коррозии от температуры чаще носит экстремальный характер: с одной стороны, с повышением температуры растет скорость реакций, с другой стороны, уменьшается конденсация влаги на поверхность металла. Повышение давления ведет к увеличению количества растворенного кислорода в пленке влаги и деполяризации катодного процесса, что неизбежно вызывает ускорение сопряженной реакции окисления металла. Состав среды может оказывать множество воздействий: растворение продуктов коррозии, образование хорошо растворимых комплексных соединений, восстановление на катодных участках с ускорением катодных процессов, увеличение гигроскопичности продуктов коррозии и т.д. Даже пыль в атмосфере оказывает влияние на скорость коррозии: она облегчает капиллярную конденсацию влаги на поверхности или адсорбирует различные газы с их последующим растворением. 4.6.3. Вторичные продукты коррозии. Пассивация металла Первичными продуктами коррозии чаще всего являются катионы металлов и гидроксильные ионы. Вторичными продуктами называются соединения, которые образуются в результате взаимодействия первичных продуктов между собой и с веществами в коррозионной среде. Так, например, при коррозии железа происходят следующие вторичные реакции: Fe2+ + 2OH = Fe(OH)2 , 2Fe(OH)2 + H2O + 1/2O2 = 2Fe(OH)3 . Гидроксид железа (3) - более нерастворимое вещество, чем гидроксид железа (2). Далее гидроксиды преобразуются в сложные гидратированные оксиды переменного состава nFeO mFe2O3 zH2O , то есть в ржавчину бурого цвета. Многие активные металлы покрываются пленками защитных продуктов, которые защищают металл от дальнейшей коррозии: ржавчина на железе, сине-зеленая патина на меди nCu(OH)2 mCuCO3 zCuSO4 , основные карбонаты белого цвета на цинке nZn(OH)2 mZnCO3 zH2O, сульфат свинца (образуется в среде серной кислоты). Гидратированные оксиды металлов обладают проводящими свойствами и играют роль катодных участков на поверхности. Окисление происходит в порах защитной пленки. Поры закрываются в одних местах и открываются в других за счет растворения пленки под действием агрессивной среды. В том случае, когда защитный слой имеет малую пористость, металл переходит в так называемое пассивное состояние. Явление пассивации было открыто еще М.В.Ломоносовым, который установил, что концентрированные кислоты азотную и серную можно перевозить в стальной или алюминиевой таре. В первый момент соприкосновения кислот с металлами, когда поверхность металлов чистая, скорость коррозии велика, и вторичные продукты коррозии накапливаются быстро, покрывая поверхности металлов плотным слоем. Скорость окисления металлов при этом падает. Впоследствии было показано, что для каждого металла существует некоторое значение тока коррозии, при достижении которого потенциал значительно смещен в положительную сторону, и металл пассивируется. Это показано на рис 4.6. Величина IП называется током пассивации для данного металла. Если ток коррозии в первый момент I1 превысит IП, анодный процесс резко замедляется, что находит отражение в ниспадающем участке на анодной кривой. Катодная кривая будет пересекать анодную кривую в точке с координатами Ек и IК . Последняя величина и характеризует скорость коррозии в пассивном состоянии. 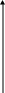 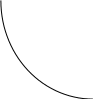 I I  I1 I1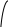 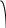  IП IП     IК IК ЕМе Ек ЕОх Е Рис.4.6. Поляризационная диаграмма при пассивировании металла 4.7. МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ Среди методов защиты металлов от коррозии можно выделить следующие: 1) Легирование металлами, легко образующими на своей поверхности естественные защитные пленки оксидов, такими как хром, титан, алюминий, никель. Эти металлы характеризуются низкими токами пассивации, например, нержавеющая сталь 12Х18Н9Т содержит 18% Cr, 9% Ni, 1% Ti. Железо вытравливается с поверхности, и на нее выходят легко пассивирующиеся металлы (поверхность стали при этом не изменяет свой внешний вид). 2) Следует по возможности применять металлы, термодинамически устойчивые в данной среде. К примеру, водопроводные трубы лучше изготавливать из сплавов меди, так как они не корродируют с водородной деполяризацией в отличие от стальных. 3) В некоторых конструкциях можно использовать металлы, образующие пленки вторичных продуктов с высокими защитными свойствами. Например, в растворах серной кислоты применяют свинец. 4) Поверхность металла изолируют от окружающей среды смазками (крепежные детали, патроны при хранении), лаками (консервные банки), красками (кузова автомобилей). Из неорганических покрытий можно выделить создание на поверхности металлов пленок нерастворимых фосфатов (фосфатирование), образование нитридов (азотирование), создание пленок оксидов металлов с высокими защитными свойствами (оксидирование) и т.д.. 5) Металлические защитные покрытия бывают катодные и анодные. Рассмотрим поведение во влажной атмосфере воздуха листов оцинкованного железа. Цинковое покрытие с внешней стороны покрыто естественной защитной пленкой основных карбонатов. Если покрытие механически повреждается, то возникает коррозионный элемент (рис 4.6). О2                     А Zn2+ Zn (E= - 0,76 B) А Zn2+ Zn (E= - 0,76 B)           К e Fe (E= - 0,44 B) Рис.4.7. Коррозия оцинкованного железа во влажной атмосфере Цинк является более активным металлом, поэтому в данной гальванической паре он будет окисляться, то есть цинк будет играть роль анода: A: Zn - 2e = Zn2+ . Поскольку ионы цинка будут уходить в среду, оставшиеся электроны начнут перетекать на железо, поверхность которого на дне царапины, будет играть роль катода, на котором будут восстанавливаться окислители: К: 2Н2О + О2 + 4е = 4ОН, 2Н2О + 2е = Н2 + 2ОН. Цинковое покрытие на стали, таким образом, является анодным. Оно защищает сталь электрохимически, поэтому может быть тонким. Никелевое покрытие (E= - 0,25 B) на стали относится к катодным покрытиям. Если его нарушить, начнет растворяться основа (железо - это анод), электроны перейдут на никель, на поверхности которого будут идти катодные реакции. Если покрытие не нарушено, оно защищает сталь, так как никель покрыт естественной оксидной пленкой с хорошими защитными свойствами. Следовательно, катодное покрытие защищает металл механически, и оно должно быть достаточно толстым, чтобы его труднее было разрушить до поверхности защищаемого металла. 6) По возможности следует удалять окислители из коррозионной среды. Например, особо ответственные металлические изделия (эталон метра, прецизионное оборудование и т.д.) хранят в вакууме. Или воду в замкнутой системе охлаждения следует предварительно прокипятить, чтобы уменьшить в ней количество растворенного кислорода. 7) К уменьшению коррозии приводит осушение среды. Например, станки перед отправкой с завода-изготовителя, упаковывают в тару с мешочками силикагеля, который хорошо поглощает воду из воздуха. 8) Иногда в коррозионную среду добавляют ингибиторы коррозии. Они бывают анодными и катодными. Анодные ингибиторы (хроматы, фосфаты) способствуют образованию пленок с высокими защитными свойствами, то есть тормозят анодный процесс. При некоторой концентрации ингибитора в среде может наступить пассивация металла (рис.4.8а). Катодные ингибиторы оказывают влияние на процесс восстановления окислителей в среде. Они либо его тормозят, адсорбируясь на поверхности и предотвращая доступ деполяризатора (рис.4.8б), либо сами являются очень активными деполяризаторами, повышая скорость катодной реакции до такой величины, при которой наступает пассивация металла. Некоторые ингибиторы имеют смешанный характер воздействия. I 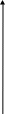 I 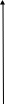  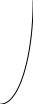 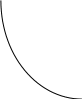  а) б) а) б)   I1 I1I1 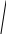 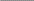 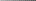 I2 I2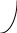 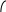 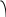  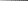 I2 I2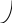 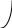   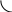  I3 I3  ЕМе Ек ЕОх Е ЕМе ЕОх Е Рис.4.8. Влияние анодных (а) и катодных (б) ингибиторов на скорость коррозии 9) Электрохимическими методами являются протекторная и катодная защиты металлов. Общим в них является то, что имеется жертвенный кусок металла, подвергающийся коррозии с целью сохранения защищаемой конструкции. В анодной или протекторной защите жертвенный металл, электродный потенциал которого должен быть более отрицателен, соединяют электрической цепью с защищаемой конструкцией. Образуется гальваническая пара, в которой протектор является анодом и окисляется, а на защищаемой конструкции локализуются катодные участки, где восстанавливаются окислители из коррозионной среды. Примером этого метода служит защита стальных днищ морских судов, на которые наваривают цинковые листы. При катодной защите в качестве жертвенного металла можно выбрать даже тот же самый металл, что и в основной конструкции. Источник постоянного тока подключают следующим образом: минус - на защищаемую конструкцию (это вызывает смещение потенциала в отрицательную сторону, а следовательно – локализацию катодных процессов); плюс - на жертвенный металл (при отклонении потенциала в положительную сторону происходит преимущественный процесс окисления). 4.8. ЭЛЕКТРОЛИЗ Электролизом называется процесс химических превращений, происходящих под действием электрического тока. Знаки электродов в гальванических элементах и в электролизерах прямо противоположны: в последних случаях катоды имеют знак минус, а аноды - плюс. Электролизом расплавов электролитов, представляющих собой ионизированные жидкости, получают активные металлы и газы. Катодные и анодные пространства в электролизерах разделены диафрагмой из стальной сетки. В расплавах процесс электролитической диссоциации происходит под воздействием высокой температуры, например:  AlF3 t C Al3+ + 3F . AlF3 t C Al3+ + 3F .Ионы алюминия в электрическом поле между электродами перемещаются к катоду и принимают от него электроны: К: Al3+ + 3е = Al . Металл получается в жидком виде и всплывает на поверхность, откуда его отбирают в сборник. Фторид-ионы перемещаются к аноду и отдают ему электроны: А: 2F - 2е = F2 . При электролизе водных растворов на электродах могут идти конкурирующие процессы, так как помимо катионов металлов и анионов кислотных остатков в водных растворах всегда присутствуют продукты диссоциации воды: Н+ и ОН . На катодах прежде всего будут восстанавливаться более сильные окислители, потенциал восстановления которых менее отрицателен, а на анодах будут окисляться более сильные восстановители, потенциал окисления которых менее положителен. Рассмотрим в качестве примера процесс электролиза водного раствора фторида алюминия с графитовыми электродами. Данная соль гидролизуется с образованием в растворе среды, близкой к нейтральной (рН7). Рассмотрим возможные процессы на электродах и оценим их потенциалы. Катодные процессы: 1) Al3+ + 3е = Al ; Е (Al3+/Al ) = - 2,36 В. 2) 2Н2О + 2е = Н2 + 2ОН ; Е (2Н+/Н2 ) = - 0,0597 = - 0,41 В. Ионы водорода являются более сильными окислителями, нежели ионы алюминия, поэтому на катоде будет выделяться водород. Анодные процессы: 1) Графитовый анод не окисляется. 2) 2F - 2е = F2 ; Е(F /F ) = + 2,87 В. 3) 2Н2О + О2 + 4е = О2 + 4Н+ ; Е(О2/ОН ) = 1,23- 0,0597 = +0,82 В. Ионы ОН являются более сильными восстановителями, чем фторид-ионы, поэтому на аноде будет выделяться кислород, а не фтор. Последний можно получить только методом электролиза расплавов солей. В некоторых случаях потенциалы конкурирующих процессов близки между собой, и тогда на электродах могут одновременно идти два и более процесса. При этом большое значение имеет поляризация каждого из них (рис.4.9). 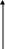  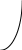 I Ii1 2 1    i2 i2 Е1 Е2 EA E Рис.4.9. Анодные поляризационные кривые двух процессов с близкими потенциалами При достижении потенциала Е1 на аноде начнется процесс 1, а при Е2 добавится процесс 2. При некотором потенциале анода EA общий анодный ток будет складываться из токов отдельных процессов: IА = i1 + i2 . При повышении потенциала анода происходит перераспределение величин токов (которые идут на каждый процесс) в пользу процесса 2, так как он характеризуется меньшей поляризацией (слабо тормозится). Количественные законы электролиза были сформулированы М.Фарадеем в 1832 г. Первый закон: массы веществ (m, г), выделившихся или израсходованных в результате электродных процессов, пропорциональны количеству пропущенного электричества (Q, Кл): m = kQ , где k - электрохимический эквивалент . Второй закон: массы веществ, образующиеся или израсходованные при пропускании одного и того же количества электричества через электроды, пропорциональны молярным массам их химических эквивалентов (МЭ, г/моль): mi / MЭ,i = const . Отсюда следует, что электрохимический эквивалент пропорционален молярной массе химических эквивалентов вещества, и для выделения 1 моля эквивалентов нужно затратить одинаковое количество электричества, равное числу Фарадея F (Кл/ моль). Объединяя два закона, получим: m = MЭ I (BT) / F, где I - общая сила тока (А); - время (с); ВТ - выход по току. Выход по току показывает, какая доля от количества пропущенного электричества пошла на данный процесс. Он равен 1, если на электроде протекает одна реакция, и меньше 1, если идут несколько процессов. Электролиз является основой многих технологий: производства неорганических и органических веществ, в частности лекарственных препаратов, получения гальванических покрытий и металлических порошков, гидроэлектрометаллургии, гальванопластики, электрохимической размерной обработки, полирования, гальванопластики. Электрохимические методы очистки сточных вод от ионов тяжелых металлов имеют большие преимущества по сравнению с реагентными методами очистки. Приложение 1 Стандартные энтальпии образования
Приложение 2 |
