|
|
Физ химия курс лекций. Лекция 1 Тема Химическая термодинамика
Величины k и А уравнения (3.5) оказываются одной размерности, т.е. А тоже константа скорости и отражает частоту столкновений частиц. Расчетная частота столкновений молекул газа обычно больше, чем А, определенное по экспериментальным данным в соответствии с (3.5). Возможное объяснение этого состоит в том, что эффективными являются не только соударения частиц с достаточной энергией, но и необходимо еще, чтобы они были соответственно сориентированы в пространстве по отношению друг к другу. Например, в реакции
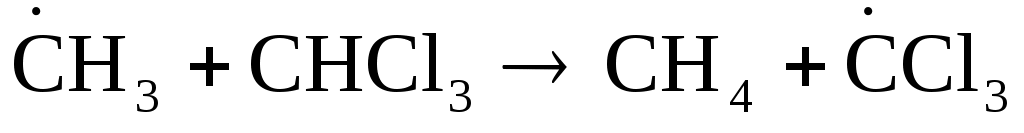
ориентация частиц (1) более благоприятна для взаимодействия, чем ориентация (2):
 Cl Cl
 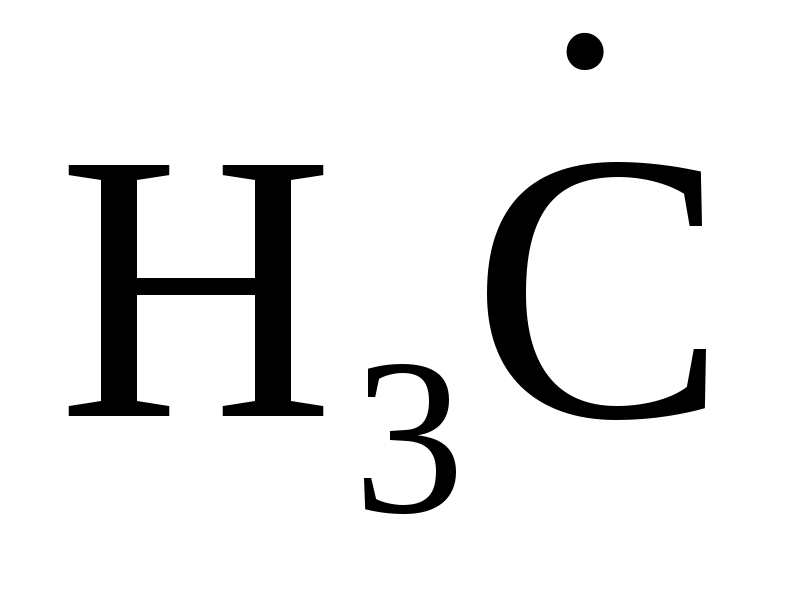 → ←H – C – Cl (1); → ←H – C – Cl (1);
Cl
 H H
 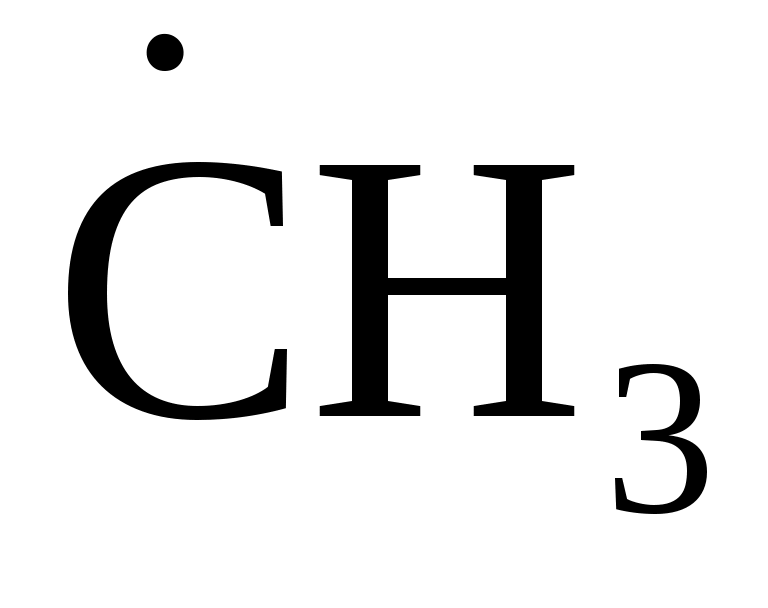 → ← Cl – C – Cl (2), → ← Cl – C – Cl (2),
Cl
(где  и и  обозначают частицы, имеющие неспаренные электроны, т.е. это радикалы). Иными словами, множитель А в (3.5) должен включать в себя наряду с Z по (3.8) стерический фактор P (имеющий значение от 0 до 1), соответствующий той части сталкивающихся частиц, которые имеют необходимую взаимную ориентацию (А=РZ). Поэтому считают, что множитель А представляет собой частоту соударений активных частиц, ориентированных определенным образом. обозначают частицы, имеющие неспаренные электроны, т.е. это радикалы). Иными словами, множитель А в (3.5) должен включать в себя наряду с Z по (3.8) стерический фактор P (имеющий значение от 0 до 1), соответствующий той части сталкивающихся частиц, которые имеют необходимую взаимную ориентацию (А=РZ). Поэтому считают, что множитель А представляет собой частоту соударений активных частиц, ориентированных определенным образом.
Теория соударений была разработана для бимолекулярных реакций (с участием в каждом столкновении двух частиц) в газовой фазе. Однако, оказалось, что ее можно использовать и для реакций в растворах. В этом случае молекулы растворителя препятствуют столкновениям частиц реагентов с такой же частотой, как в газах, но зато после неэффективного соударения частицы не расходятся далеко и могут сталкиваться повторно. Такие повторные столкновения между частицами могут оказаться эффективными. Было показано, что скорость некоторых реакций одинакова и в газовой фазе, и в растворах.
Итак, теория бинарных соударений утверждает, что для химического превращения взаимодействующие частицы должны: I. столкнуться; II. иметь благоприятную взаимную ориентацию; III. обладать достаточной энергией. В рамках этой теории уравнение Аррениуса (3.5) выведено теоретически.
Теория переходного состояния
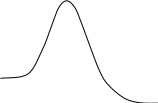
Эта теория рассматривает процесс соударения частиц в деталях. По ней в момент соударения частиц они сближаются и между их электронными облаками нарастает взаимное отталкивание. Скорость движения частиц при этом уменьшается, а кинетическая энергия переходит в потенциальную. Если кинетическая энергия частиц была недостаточной, то они остановятся раньше, чем их электронные облака перекроются, и тогда частицы, не взаимодействуя друг с другом химически, расходятся. Если сталкиваются две активные частицы (с энергией ≥Е (рис. 3.2)), то они могут преодолеть отталкивание между электронными облаками и близко подойти друг к другу. В результате перекрывания их электронных облаков создаются условия для перераспределения электронов с разрывом старых химических связей и образованием новых, т.е. условия для протекания химической реакции.
В качестве примера на рис.3.3 показано изменение потенциальной энергии одного эффективного соударения метильного радикала и молекулы хлороводорода:
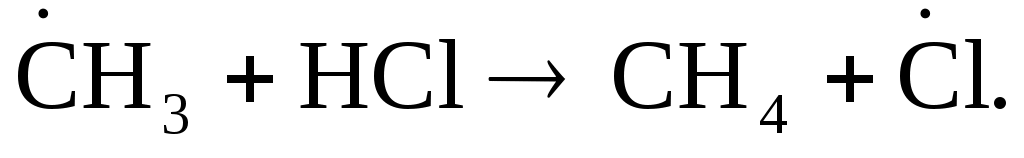 (3.9) (3.9)
Ось абсцисс диаграммы – это координата реакции r, показывающая степень развития процесса взаимодействия частиц от начального состояния до продуктов. После столкновения частиц их потенциальная энергия возрастает до максимума, которому соответствует образование, состоящее из атомных ядер и связывающих электронов и называемое активированным комплексом. В таком комплексе начинают образовываться новые связи с одновременным разрывом старых связей (т.е. перераспределяются электроны между атомами); в нем как бы объединены «полуразрушенные» частицы реагентов и «полуобразовавшиеся» частицы продуктов.
AK
H3C·······H·······Cl
П
P
E
EA
r
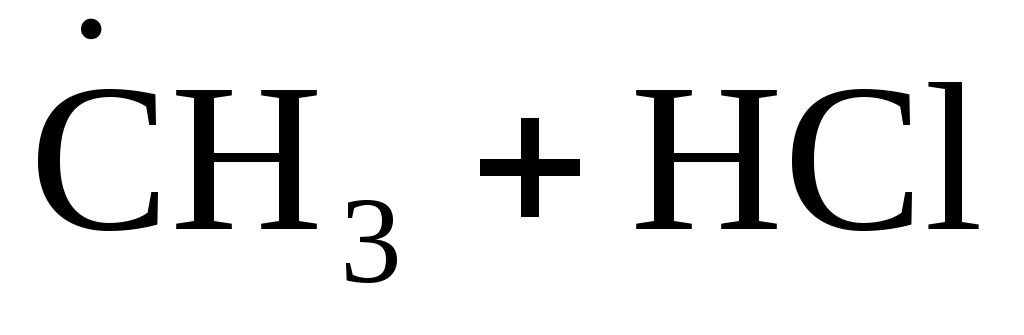 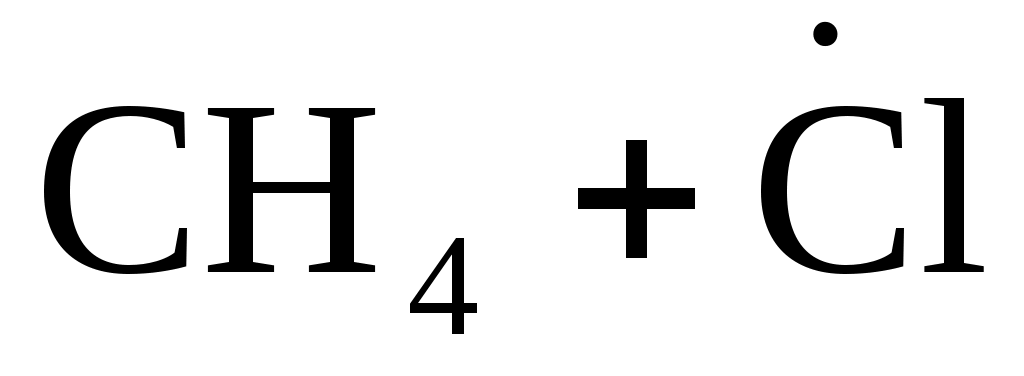

|
|
|
 Скачать 2.63 Mb.
Скачать 2.63 Mb.


 H
H