Физ химия курс лекций. Лекция 1 Тема Химическая термодинамика
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
А К Мольные доли L В А Мольные доли Вкомпонента В компонента В Рис. 2.11. Диаграммы состояния двухкомпонентной системы либо при р=const (а), либо при Т = const (б): п – пар, ж – жидкость; 2 и 5 – кривые жидкости (кипения), 3 и 4 – кривые пара (конденсации) Составы жидких и паровых фаз рассматриваемых систем подчиняются первому закону Коновалова: пар содержит больше того компонента, добавление которого к раствору понижает температуру его кипения при данном давлении или повышает общее давление пара при данной температуре (т.к. пар обогащается более летучим компонентом). Некоторые вещества при строго определенных соотношениях компонентов могут образовывать азеотропные растворы – т.е. такие растворы, при испарении которых получается пар такого же состава, что и состав раствора. Другими словами, азеотропные растворы перегоняются без изменения состава. На кривых диаграмм состояния в точках, отвечающих составам азеотропных растворов, имеются экстремумы (рис.2.12). При этом изменение внешнего давления приводит не только к изменению температуры кипения азеотропного раствора, но и его состава. Это указывает на то, что азеотропный состав компонентов не соответствует составу химического соединения. Азеотропные растворы называют нераздельнокипящими. О них можно сказать, что они испаряются как индивидуальные чистые вещества. Системы, содержащие составы азеотропных растворов, подчиняются второму закону Коновалова: точки максимума или минимума на кривых общего давления насыщенного пара (и соответственно точки минимума или максимума на кривых температур кипения) отвечают растворам, состав которых одинаков с составом их насыщенного пара. Жидкость Пар А Состав В мольные доли Пар Жидкость А Состав В мольные доли   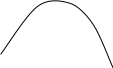 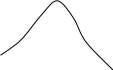 (а) (б) (а) (б)             Рис. 2.12. Диаграммы состояния системы (А+В), образующей азеотропные смеси, при постоянной температуре (а) и при постоянном давлении (б) Помимо законов Коновалова в основе теории рассматриваемых систем лежат законы Вревского. Первый закон: при фиксированном составе жидкой фазы равновесная с ней газовая (паровая) фаза обогащается с увеличением температуры (давления) тем компонентом, для которого больше мольная теплота испарения, т.е. менее летучим компонентом. Второй закон Вревского: при повышении температуры (давления) в азеотропной смеси с максимумом температуры кипения увеличивается содержание компонента, обладающего меньшей мольной теплотой испарения; в азеотропной смеси с минимумом температуры кипения с повышением температуры возрастает относительное содержание компонента с большей мольной теплотой испарения. На рассмотренных законах основано разделение жидких растворов с летучими компонентами. Соотношение между количествами жидкости и пара в равновесии определяют по правилу рычага: отрезки горизонтальной прямой, соединяющей паровую и жидкую фазу, образуемые определенной точкой (точкой определенного состава) этой прямой, обратно пропорциональны числам молей каждой из фаз. Например, для некоторой точки М в гетерогенной области диаграммы состояния рис. 2.13.(а) имеем: n ж / n п = а / в. (б)    (а)    Т Т  п п |
