Физ химия курс лекций. Лекция 1 Тема Химическая термодинамика
 Скачать 2.63 Mb. Скачать 2.63 Mb.
|
1.2.3. Применение первого закона термодинамики к термохимииОксид углерода IV, полученный по реакции (1.53), можно разложить на элементарные вещества: графит и кислород – в соответствии с первым законом термохимии, который называют также законом Лавуазье и Лапласа. Если при образовании какого-либо химического соединения из элементарных веществ выделяется определенное количество теплоты, то такое же количество теплоты требуется затратить на разложение этого химического соединения на элементарные вещества. Авторы этого закона французские ученые А. Лавуазье и П. Лаплас (1870 г.).СО2(г) = С(граф) + О2(г) . (1.59) Так как по (1.55) ∆Hºр = О + О – 1 моль · Положительное значение ∆Hºр указывает на то, что реакция (1.59) эндотермическая, а величина ∆Hºр соответствует выводу первого закона термохимии (∆Hºр (1.59) = – ∆Hºр(1.53)). В общем виде выполняется:где стрелки указывают направления прямой (→) и обратной реакций (←). Второй закон термохимии или закон Гесса имеет следующую формулировку: суммарный тепловой эффект химической реакции при постоянном давлении не зависит от ее промежуточных стадий. Этот закон можно сформулировать короче: энтальпийный эффект реакции не зависит от промежуточных стадий. Автор закона Г. И. Гесс, немец по происхождению, работавший профессором Петербургского горного института и установивший этот закон в 1840 г. Закон Гесса применяется в тех случаях, когда химические превращения могут быть осуществлены несколькими различными путями. При этом результирующее изменение энтальпии одинаково для любого пути. Например, сгорание графита до оксида углерода IV может быть осуществлено двумя путями (а) и (б). Первый путь – это реакция (а) в одну стадию, а второй путь – это процесс в две стадии (б1) и (б2): первый путь -(а) C(граф) + O2(г)=СО2(г); ∆Hºр (а), второй путь - (б1) C(граф) + 0,5O2(г) = СО(г); ∆Hºр(б1), (б2) СО(г) + 0,5О2(г) = СО2(г); ∆Hºр(б2). (1.61) Из трех реакций (1.61) экспериментально можно определить изменение энтальпии только в двух – в (а) и (б2). В третьей реакции (б1) невозможно определить ∆Hºр, потому что при ее протекании одновременно образуются два продукта – СО и СО2. Разделение полученных газов позволяет затем осуществить реакцию (б2). Затем, используя закон Гесса ( Закон Гесса позволяет производить алгебраические действия (сложения, вычитания, умножения и деления на численные множители) с уравнениями реакций, если в них включены тепловые эффекты. Так, если бы нам были известны тепловые эффекты стадий (б1) и (б2) второго пути реакции (1.61), то мы могли бы вычислить тепловой эффект этой реакции, протекающей в одну стадию по пути (а), не осуществляя этот процесс экспериментально. Для этого надо сложить термохимические уравнения реакций (б1) и (б2): C  (граф) + 0,5O2(г) = СО(г) + 110,5 кДж, (граф) + 0,5O2(г) = СО(г) + 110,5 кДж,СО(г) + 0,5О2(г) = СО2(г) + 283 кДж,  C(граф) + 0,5O2(г) + СО(г) + 0,5О2(г) = СО(г) + СО2(г) + +(110,5 +283) кДж. После сокращения одинаковых членов, подчеркнутых двумя черточками, и сложения одинаковых членов, подчеркнутых одной черточкой, суммарного уравнения получим термохимическое уравнение одностадийной реакции: C(граф) + O2(г) = СО2(г) + 393,5 кДж. Рассмотренное применение закона Гесса к двум путям получения оксида углерода IV может быть представлено в виде энтальпийной диаграммы (рис. 1.9), по которой видно, что ∆Hºр(а) = ∆Hºр(б1) + ∆Hºр(б2). Верхний уровень диаграммы называется исходным уровнем. Он соответствует энтальпиям образования элементарных веществ в их стандартных состояниях ( 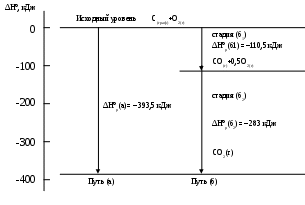 |
