Лекция 1 введение
 Скачать 0.83 Mb. Скачать 0.83 Mb.
|
Уравнение Ван-дер-ВаальсаРеальные газы с повышением давления и уменьшением температуры уже не подчиняются уравнению Менделеева-Клапейрона. Ван-дер-Ваальс предположил, что в данном уравнении необходимо ввести поправки к объему и давлению. Так как молекулы реального газа имеют собственный объем, то для свободного их перемещения будет предоставлен не весь геометрический объем, занимаемый газом, а меньший - на величину той части объема, которую занимают сами молекулы.. Далее, благодаря силам притяжения молекулы находятся как бы под действием дополнительного давления р’, которое необходимо учитывать вместе с внешним. Скорректированное Ван-дер-Ваальсом уравнение для одного моля реального газа имеет вид: 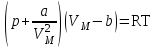 Расчет показал, что добавочное давление р’= a/VМ2, где a – коэффициент Ван-дер-Ваальса, зависящий только от химической природы газа. Коэффициент b- поправка на собственный объем молекул, равная учетверенному объему молекул, находящихся в одном моле. Жидкости Свойства и строение жидкостей Жидкое состояние занимает промежуточное положение между газами и твердыми телами. В расположении частиц жидкости наблюдается так называемый ближний порядок. Это означает, что по отношению к любой частице расположение ближайших к ней соседей является упорядоченным. Однако по мере удаления от данной частицы порядок в расположении частиц довольно быстро исчезает. М  ногие вопросы теории жидкого состояния были разработаны Я.И.Френкелем. Согласно Френкелю, тепловое движение в жидкостях имеет следующий характер: каждая молекула в течение некоторого времени (10-12–10-10с) колеблется около определенного положения равновесия, после чего она перескакивает в новое положение равновесия, отстоящее от прежнего примерно на расстояние, равное диаметру молекулы. Средняя длительность колебаний около одного и того же положения равновесия зависит от природы жидкости и убывает с повышением температуры. Жидкости, как и газы, обладают текучестью: любая неуравновешенная сила вызывает их течение. Текучестью объясняется горизонтальность поверхности жидкости, находящейся в широком сосуде. Жидкость, сохраняя свой объем, под воздействием силы тяжести принимает форму сосуда. Если же жидкость освободить от действия силы тяжести, то, как показывает опыт, она принимает форму шара. Это явление наблюдается, например, в условиях невесомости (в кабинах космических кораблей). Молекулы жидкости, в отличии от газов, интенсивно взаимодействуют между собой. Силы взаимодействия зависят от природы молекул и существенно различаются по величине для разных жидкостей. Характерным свойством жидкостей является их очень малая изотермическая сжимаемость. Так, при увеличении внешнего давления на 105 Па объем жидкости уменьшается на тысячные доли процента. Объем жидкости при температуре Т выражается формулой: V =V0(1+αT) где α – коэффициент теплового расширения жидкостей, зависящий от природы жидкости и температуры. Численное значение a находится в пределах 10-5–10-2 К-1. Кипение – это фазовый переход I рода. Кипение начинается при равенстве внешнего давления и давления насыщенного пара в пузырьках внутри жидкости. При заданном постоянном внешнем давлении кипение происходит при определенной температуре Тк, называемой температурой кипения, при этом парообразование происходит во всем объеме жидкости. Для кипения жидкости необходимы два условия: 1). наличие в ней парогазовых пузырьков; 2). повышение температуры до Тк и сообщение жидкости при этой температуре теплоты. Если жидкость полностью лишена пузырьков (зародышей газовой фазы), в ней отсутствуют полости, где могли бы накапливаться пары и поэтому кипение не происходит. В процессе кипения ее температура Тк остается неизменной, поскольку подводимая теплота полностью идет на парообразование. Чем меньше внешнее давление, тем меньше Тк. Особенности твердого состояния вещества Структура твердых тел В отличие от жидкостей твердые тела обладают упругостью формы. Если к твердому телу приложить внешнюю силу, то возможно изменение его формы. После снятия нагрузки тело примет первоначальный вид, если не перейден некоторый предельный уровень деформации. Наличие упругой деформации у твердых тел и отсутствие ее у жидкостей обусловлены различием в их молекулярном строении и характере теплового движения молекул. Твердые тела делятся на два типа, существенно отличающихся друг от друга по физическим свойствам: кристаллические и аморфные. Подавляющее большинство твердых тел в природе имеет кристаллическое строение. Они характеризуются упорядоченностью расположения составляющих их частиц, наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Частицы, из которых построены кристаллы, совершают малые колебания около положения равновесия. Структура, для которой характерно регулярное расположение частиц, с периодической повторяемостью в 3-х измерениях, называется кристаллической решеткой. Средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки. Аморфные тела всегда изотропны, для них характерен ближний порядок в расположении частиц и отсутствие кристаллической решетки. Плавление и кристаллизация Переход кристаллического тела в жидкое состояние – это фазовое превращение. Оно происходит при определенной для каждого вещества температуре и требует затраты некоторого количества тепла, называемого теплотой плавления. Если твердое тело нагревать, то его внутренняя энергия, которая складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц, возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится – кристалл плавится. По мере сообщения телу теплоты его температура повышается, а при Т=Тпл начинается переход тела из твердого состояния в жидкое. Температура Тпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться. Если жидкость охлаждать, то процесс пойдет в обратном направлении. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации – кристаллических зародышей, которыми могут служить различные примеси, пыль, сажа. Если жидкость тщательно очистить от таких частиц, ее можно охладить ниже температуры кристаллизации без образования кристалликов. Состояние такой переохлажденной жидкости является метастабильным. Обычно достаточно попасть в такую жидкость пылинке, для того, чтобы она распалась на жидкость и кристаллы, находящиеся при равновесной температуре. В некоторых случаях при больших переохлаждениях подвижность молекул жидкости оказывается столь незначительной, что метастабильное состояние может сохраняться очень долго. Жидкость в таких случаях обладает весьма малой текучестью и представляет собой аморфное твердое тело. |
