1. Бактериальная пневмония. Лекция Бактериальная пневмония
 Скачать 183.47 Kb. Скачать 183.47 Kb.
|
КлассификацияВ настоящее время наиболее важным представляется разделение пневмоний с учетом условий и времени инфицирования легочной ткани на внебольничную (домашнюю, амбулаторную) и нозокомиальную (больничную, внутригоспитальную); в последние годы стали выделять пневмонии, связанные с оказанием медицинской помощи (англ. healthcare-associated pneumonia). Выделение последней категории объясняется тем, что по условиям возникновения их следовало бы рассматривать как внебольничные, но спектр возбудителей (и их профиль антибиотикорезистентности) приближает пневмонии, связанные с оказанием медицинской помощи, к нозокомиальным (табл. 7.1). Таблица 7.1. Классификация пневмонии
Внебольничная пневмонияВнебольничная пневмония (ВП) - острое заболевание, возникшее во внебольничных условиях (вне стационара либо диагностированное в первые 48 ч от момента госпитализации, либо развившееся у пациентов, не находившихся в домах сестринского ухода/отделениях длительного медицинского наблюдения 14 сут и более) и сопровождающееся симптомами инфекции нижних отделов дыхательных путей (лихорадкой, кашлем, выделением мокроты, возможно гнойной, болью в грудной клетке, одышкой) и рентгенологическими признаками «свежих» очаговоинфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы. Эпидемиология Несмотря на доступность современных антибиотиков и эффективных вакцин, ВП остается широко распространенным и потенциально жизнеугрожающим заболеванием. Так, например, в США пневмония занимает 6-е место в перечне главных причин смерти и является лидером по числу летальных исходов в ряду инфекционных заболеваний. Заболеваемость ВП составляет 10-12 на 1000 (10-12%) населения, варьируя в зависимости от возраста, пола, расовой принадлежности и социально-экономических условий обследуемых популяций. Так, например, в США наибольшие показатели заболеваемости ВП регистрируются у детей младше 4 лет (12-18 на 1000 населения), что сравнимо с распространенностью заболевания среди старших возрастных групп (≥60 лет) в странах Европы (20%). ВП обусловливает каждую вторую смерть от инфекционных заболеваний в гериатрической популяции и 90% летальных исходов от респираторных инфекций среди лиц старше 64 лет. В США и ряде стран Европы более 80% больных ВП получают лечение в амбулаторно-поликлинических условиях (прогнозируемый уровень летальности для этой категории пациентов - <1%). Частота госпитализации больных ВП в значительной степени зависит от организации системы здравоохранения и предпочтений врача, составляя 15-42%. Общей тенденцией являются переоценка врачом риска летального исхода ВП и госпитализация пациентов с минимальным риском. В тех же случаях, когда госпитализация больного ВП оправдана с медицинских позиций, показатели ожидаемой летальности колеблются от 4 до 37% (у лиц старших возрастных групп). Согласно официальной статистике, в 2008 г. в России среди лиц в возрасте ≥18 лет было зарегистрировано 424 457 случаев ВП - 3,7%, а в 2009 г. заболеваемость составила 3,9%. Однако есть все основания считать, что эти данные не отражают истинной распространенности ВП в России, которая, согласно расчетам, достигает 14-15%, а общее число больных ежегодно превышает 1,5 млн человек. В 2006 г. в нашей стране среди людей в возрасте ≥18 лет от пневмонии умерли 38 970 человек, что составило 27,3 на 100 тыс. населения, причем наиболее высокая смертность при ВП традиционно регистрируется среди мужчин трудоспособного возраста. Патогенез Аспирация содержимого ротоглотки - главный путь инфицирования респираторных отделов легких и основной патогенетический механизм развития ВП. В нормальных условиях ряд микроорганизмов, например Strep-to coccus pneumoniae, может колонизировать ротоглотку, но нижние отделы дыхательных путей при этом остаются стерильными. Микроаспирация секрета ротоглотки - физиологический феномен, наблюдающийся практически у половины здоровых лиц, преимущественно во время сна. Однако кашлевой рефлекс, мукоцилиарный транспорт, антибактериальная активность альвеолярных макрофагов и секреторных иммуноглобулинов обеспечивают элиминацию инфицированного секрета из нижних отделов дыхательных путей и их стерильность. При повреждении механизмов «самоочищения» трахеобронхиального дерева, например при вирусной респираторной инфекции, когда нарушается функция ресничек эпителия бронхов и снижается фагоцитарная активность альвеолярных макрофагов, создаются благоприятные условия для развития ВП. В отдельных случаях самостоятельным патогенетическим фактором могут быть массивность дозы микроорганизмов или проникновение в респираторные отделы легких даже единичных высоковирулентных патогенов. Ингаляция микробного аэрозоля - менее частый путь развития ВП. Он играет основную роль при инфицировании нижних отделов дыхательных путей облигатными возбудителями, например C. pneumoniae или Legionella spp. Еще меньшее значение (по частоте встречаемости) имеет гематогенное (например, Staphylococcus spp.) и прямое распространение возбудителя из очага инфекции. С учетом описанных особенностей патогенеза ВП очевидно, что ее этиология в подавляющем большинстве случаев связана с микрофлорой верхних отделов дыхательных путей, состав которой зависит от внешней среды, возраста пациента и общего состояния здоровья. Этиология Даже используя широкий круг микробиологических исследований, установить этиологию ВП удается едва ли в половине случаев. Этот факт, с одной стороны, указывает на ограниченные возможности современной этиологической диагностики легочных инфекций, а с другой, позволяет предположить, что нам известны далеко не все потенциальные возбудители заболевания. В пользу справедливости последнего предположения свидетельствовали многочисленные находки последних лет, существенно расширившие и видоизменившие наши традиционные представления об этиологии ВП (L. pneumophila, C. pneumoniae, ТОРС-ассоциированный коронавирус, Hantavirus и др.). Современные знания пополнились и многочисленными свидетельствами едва ли не повсеместного распространения лекарственно-устойчивых штаммов основного возбудителя ВП - S. pneumoniae. Как уже говорилось выше, этиология ВП непосредственно связана с нормальной микрофлорой, колонизирующей верхние отделы дыхательных путей. Из многочисленных микроорганизмов лишь некоторые, обладающие повышенной вирулентностью, способны при попадании в нижние отделы дыхательных путей вызывать воспалительную реакцию. К числу таких возбудителей следует прежде всего отнести пневмококк (30-50% случаев заболевания). Существенное значение в этиологии ВП имеют и так называемые атипичные микроорганизмы (которые не удается идентифицировать при бактериоскопии или посеве на обычные питательные среды); на их долю в сумме приходится от 8 до 30% случаев заболевания: Chlamydophila pneumoniae; Mycoplasma pneumoniae; Legionella pneumophila. К редким (3-5%) возбудителям ВП относят: Haemophilus influenzae; Staphylococcus aureus; Klebsiella pneumoniae, еще реже - другие энтеробактерии. В очень редких случаях ВП может вызывать Pseudomonas aeruginosa (у больных муковисцидозом, при наличии бронхоэктазов). Важно подчеркнуть, что нередко у взрослых пациентов, переносящих ВП, выявляется смешанная, или коинфекция. Так, например, едва ли не у каждого второго больного с пневмококковой этиологией заболевания одновременно удается обнаружить серологические признаки активной микоплазменной или хламидийной инфекции. Для некоторых микроорганизмов нехарактерно развитие бронхолегочного воспаления, поэтому их выделение из мокроты, скорее всего, свидетельствует о контаминации материала флорой верхних отделов дыхательных путей, а не об этиологической значимости этих микробов. К таким микроорганизмам относятся Streptococcus viridans, Staphylococcus epidermidis и другие коагулазонегативные стафилококки, Enterococcus spp., Neisseria spp., Candida spp. и др. Этиологические структуры ВП могут различаться в зависимости от возраста больных, тяжести заболевания, наличия сопутствующей патологии. У пациентов, госпитализированных в терапевтическое отделение, в этиологии ВП преобладают пневмококки, на долю микоплазм и хламидий суммарно приходится около 25%. Напротив, микоплазмы и хламидии не имеют существенного значения в этиологии тяжелой ВП, требующей лечения в ОИТ, но у этой категории больных возрастает роль Legionella spp., а также S. aureus и грамотрицательных энтеробактерий. С практических позиций целесообразно выделять группы пациентов с ВП с учетом сопутствующей патологии (ХОБЛ, сахарный диабет, застойная сердечная недостаточность, цереброваскулярные заболевания, диффузные заболевания печени, почек с нарушениями их функции, хронический алкоголизм и др.), предшествующей антибактериальной терапии (прием системных антибиотиков в течение ≥2 последовательных дней за последние 3 мес) и тяжести заболевания. Между этими группами могут наблюдаться различия не только в этиологической структуре, распространенности лекарственно-устойчивых штаммов известных возбудителей, но и в прогнозе (табл. 7.2). Таблица 7.2. Группы пациентов с ВП и вероятные возбудители
Важной проблемой в настоящее время является распространение среди пневмококков штаммов со сниженной чувствительностью к пенициллину. Резистентность пневмококков к пенициллину обычно сочетается с устойчивостью к цефалоспоринам I-II поколения, тетрациклинам, ко-тримоксазолу, макролидам. В то же время сохраняют активность цефалоспорины III-IV поколений (кроме цефтазидима), респираторные фторхинолоны, ванкомицин и линезолид. Данные мониторинга резистентности клинических штаммов S. pneu moniae в РФ в рамках многоцентрового исследования ПеГАС I-III представлены в табл. 7.3. Как показывает исследование, уровень устойчивости пневмококков к пенициллину в нашей стране остается стабильным и не превышает 10%, при этом в большинстве случаев выявляются умеренно резистентные штаммы. Все пенициллинорезистентные пневмококки сохраняют чувствительность к амоксициллину и амоксициллину/клавуланату, а их резистентность к цефтриаксону/цефотаксиму составляет 2,8%. Таблица 7.3. Резистентность S. pneumoniae к различным антибактериальным препаратам (по данным исследования ПеГАС, 1999-2009 гг.), УР/Р*, %
* Умеренно резистентные штаммы/резистентные штаммы. Устойчивость S. pneumoniae к макролидам не превышает 10%, однако в динамике отмечается рост устойчивости пневмококков к клиндамицину, что может свидетельствовать о смене в РФ преобладающего фенотипа резистентности (MLS-фенотипа). Высокую активность в отношении S. pneumoniae сохраняют респираторные фторхинолоны (левофлоксацин, моксифлоксацин, гемифлоксацин), ванкомицин, эртапенем. Необходимо отметить сохраняющийся высокий уровень устой чивости пневмококков к тетрациклину и ко-тримоксазолу, несмотря на существенное сокращение их использования при респираторных инфекциях в амбулаторной практике. Диагностика Подозрение на пневмонию должно возникать при наличии у больного лихорадки в сочетании с жалобами на кашель, одышку, отделение мокроты и/или боли в грудной клетке. Больные также могут жаловаться на немотивированную слабость, утомляемость, сильное потоотделение по ночам. У пациентов пожилого и старческого возраста симптомы со стороны дыхательной системы менее демонстративны или могут отсутствовать вовсе, а на первый план в картине заболевания выходят симптомы общего характера: сонливость, спутанность сознания, беспокойство, нарушения цикла сна и бодрствования, ухудшение аппетита, тошнота, рвота, признаки обострения/декомпенсации хронических заболеваний внутренних органов. Классическими объективными признаками ВП являются укорочение (тупость) перкуторного звука над пораженным участком легкого, локально выслушиваемое бронхиальное дыхание, фокус звучных мелкопузырчатых хрипов или крепитации, усиление бронхофонии и голосового дрожания. Впрочем, у части пациентов объективные признаки ВП могут отличаться от типичных или отсутствовать вовсе (примерно у 20%). Наиболее важным диагностическим исследованием является рентгенография грудной клетки. Практически всегда для диагностики ВП требуется обнаружить очагово-инфильтративные изменения в легких в сочетании с соответствующей симптоматикой поражения органов дыхания. Ценность рентгенографии состоит не только в самом факте визуализации пневмонической инфильтрации, но и в оценке динамики патологического процесса и полноты выздоровления. Изменения на рентгенограмме (распространенность инфильтрации, наличие или отсутствие плеврального выпота, полости деструкции) соответствуют степени тяжести заболевания и могут служить «проводником» при выборе антибактериальной терапии. Однако следует иметь в виду, что рентгенография органов грудной клетки не обладает абсолютной чувствительностью в визуализации очагово-инфильтративных изменений в легких. Важно представлять те клинические ситуации, при которых назначение компьютерной томографии больному с предполагаемой пневмонией является вполне обоснованным и целесообразным: у пациента с очевидной клинической симптоматикой пневмонии изменения в легких на рентгенограмме (флюорограмме) отсутствуют; при рентгенологическом исследовании больного с предполагаемой пневмонией выявлены нетипичные для данного заболевания изменения (обтурационный ателектаз, инфаркт легкого на почве ТЭЛА, абсцесс легкого и др.); рецидивирующая пневмония, при которой инфильтративные изменения возникают в той же доле (сегменте), что и в предыдущем эпизоде заболевания, или затяжная пневмония, при которой длительность существования инфильтративных изменений в легочной ткани превышает 4 нед. Данные клинического анализа крови не позволяют высказаться о потенциальном возбудителе ВП. Однако лейкоцитоз более 10×109/л указывает на высокую вероятность бактериальной инфекции, а лейкопения ниже 3×109/л или лейкоцитоз выше 25×109/л является неблагоприятным прогностическим признаком. Биохимические анализы крови (функциональные тесты печени, почек, гликемия и др.) не дают какой-либо специфической информации, но обнаруживаемые отклонения могут указывать на поражение ряда органов/систем, что имеет прогностическое значение. У пациентов с явлениями дыхательной недостаточности, обусловленной распространенной пневмонической инфильтрацией, массивным плевральным выпотом, развитием ВП на фоне ХОБЛ, необходимо определение газов артериальной крови (при недоступности этого метода исследования приемлемой альтернативой является пульсоксиметрия с определением SaО2). Гипоксемия со снижением уровня PаО2 до уровня менее 60 мм рт.ст. (при дыхании атмосферным воздухом) является прогностически неблагоприятным признаком и указывает на необходимость помещения больного в ОИТ. Распространенная в нашей стране практика исследования газов капиллярной крови имеет относительную диагностическую ценность, плохую воспроизводимость, и ее данные зачастую не соответствуют результатам исследования артериальной крови. Результативность микробиологической диагностики во многом зависит от своевременности и правильности забора клинического материала. Наиболее часто исследуемым материалом является мокрота, получаемая при кашле. Интерпретация результатов бактериоскопии и культурального исследования мокроты должна проводиться с учетом клинических данных. Тяжелобольным пациентам следует до начала антибактериальной терапии провести посевы венозной крови (проводится взятие 2 образцов крови из двух разных вен). Необходимо отбирать не менее 10 мл крови на каждый образец, так как это приводит к существенному увеличению частоты положительных результатов гемокультуры. Несмотря на важность получения лабораторного материала (мокрота, кровь) до назначения антибиотиков, микробиологическое исследование не должно служить причиной задержки антибактериальной терапии. В первую очередь это относится к пациентам с тяжелым течением заболевания. Серологическая диагностика инфекций, вызванных M. pneumo niae, С. pneumoniae и Legionella spp., не рассматривается в ряду обязательных методов исследования. В настоящее время получили распространение иммунохроматографические тесты с определением специфичного растворимого антигена L. pneumophila (1-я серогруппа) и пневмококкового антигена в моче. При наличии плеврального выпота и условий для безопасного проведения плевральной пункции (визуализация на латерограмме свободно смещаемой жидкости с толщиной слоя более 1 см) необходимо провести исследование плевральной жидкости, которое должно включать подсчет лейкоцитов с лейкоцитарной формулой, определение рН, активности лактатдегидрогеназы, содержания белка, окрашивание мазков по Граму и на кислотоустойчивость, посев на аэробы, анаэробы и микобактерии. В последние годы у госпитализированных пациентов для определения тяжести пневмонии все большее внимание привлекает исследование сывороточного уровня С-реактивного белка прокальцитонина и других биомаркёров. Наиболее высокая концентрация С-реактивного белка отмечается у пациентов с тяжелой пневмококковой или легионеллезной пневмонией. Уровень прокальцитонина , по разным данным, также коррелирует с тяжестью состояния больных ВП и может быть предиктором развития осложнений и неблагоприятного исхода. Критерии диагноза Диагноз «внебольничная пневмония» является определенным при наличии у больного рентгенологически подтвержденной очаговой инфильтрации легочной ткани и по крайней мере двух клинических признаков из числа следующих: остро возникшей лихорадки в начале заболевания (>38,0°С); кашля с мокротой; физикальных признаков (фокус крепитации и/или мелкопузырчатые хрипы, бронхиальное дыхание, укорочение перкуторного звука); лейкоцитоза более 10×109/л и/или палочкоядерного сдвига (>10%). В связи с этим следует по возможности стремиться к клиникорентгенологическому подтверждению диагноза ВП. При этом необходимо учитывать и вероятность синдромосходных заболеваний и патологических состояний, среди которых: ТЭЛА/инфаркт легкого; застойная сердечная недостаточность; злокачественные новообразования (центральный рак легкого с обструкцией бронха, бронхиолоальвеолярный рак); ОРДС (внелегочного происхождения); лекарственные пневмопатии; лучевой пневмонит; васкулиты (системная красная волчанка, гранулематоз Вегенера); гиперчувствительный пневмонит; острая эозинофильная пневмония; облитерирующий бронхиолит с организующейся пневмонией; мукоидная закупорка бронха. Диагностика ВП, основывающаяся на результатах физикального и рентгенологического обследования, может быть приравнена лишь к синдромному диагнозу, нозологическим же он становится после определения возбудителя заболевания. Определенную помощь в прогнозировании этиологии ВП может оказать тщательное изучение эпидемиологического анамнеза (табл. 7.4). Таблица 7.4. Характерные условия возникновения ВП различной этиологии
Необходимо также учитывать и особенности клинического течения ВП в зависимости от ее этиологии. Так, для пневмококковой ВП характерны острое начало, сильная лихорадка, боли в грудной клетке; для легионеллезной - диарея, неврологическая симптоматика, тяжелое течение заболевания, нарушения функции печени; для микоплазменной - мышечные и головные боли, симптомы инфекции верхних дыхательных путей. Хотя в отдельных случаях прослеживается связь между возбудителем ВП и ее клиническими и рентгенологическими проявлениями, особенности клинико-рентгенологического течения ВП не могут считаться адекватными предикторами этиологии заболевания. При этом конкретные клинические проявления чаще связываются не с биологией возбудителя, а с факторами макроорганизма (возраст, наличие или отсутствие сопутствующих заболеваний). В связи с этим разделение ВП на типичную (вызываемую прежде всего S. pneumoniae) и «атипичную» (обусловленную M. pneu moniae, C. pneumoniae, L. pneumophila) лишено особого клинического смысла. Для установления этиологии ВП проводятся бактериоскопия окрашенного по Граму мазка и посев мокроты. Такое исследование является обязательным в стационаре и необязательным в амбулаторных условиях. Однако ввиду ограниченной чувствительности методов бактериологического исследования этиологию ВП не удается установить в 25-60% случаев. Выбор места лечения Разделение больных ВП на амбулаторных (тех, кого можно лечить в амбулаторно-поликлинических условиях) и стационарных (тех, кто в силу тяжести основного заболевания или социальных условий нуждается в госпитализации) является принципиально важным. В соответствии с этим разделением разнятся объем диагностических исследований и тактика антимикробной химиотерапии (с учетом своеобразия прогнозируемой этиологии). Примерно 30-50% пациентов, госпитализируемых по поводу ВП, характеризуются как прогностически благоприятные и с успехом могут лечиться в домашних условиях. Принятие решения о целесообразности госпитализации предполагает учет стабильности клинического состояния пациента, его психосоциального статуса, риска смерти и развития осложнений заболевания, наличия или отсутствия иных медицинских проблем. В настоящее время доступен ряд клинико-лабораторных шкал, которые на основании оценки тяжести ВП и/или прогноза дают рекомендации по выбору места лечения. Определенные перспективы при решении вопроса о месте ле чения пациентов с ВП в настоящее время связываются с использованием прогностических шкал CURB-65/CRB-65 , предполагающие оценку 5 или 4 параметров (наличие - 1 балл, отсутствие - 0) соответственно: C (Confusion) - нарушение сознания; U (Urea) - азот мочевины крови более 7 ммоль/л (не учитывается в шкале CRB-65); R (Respiratory rate) - ЧД ≥30 в мин; B (Blood pressure) - диастолическое (ДАД) <60 мм рт.ст. или систолическое (САД) давление <90 мм рт.ст.; 65 - возраст 65 лет и старше. Минимальное число баллов по данной шкале составляет 0, максимальное - 4 или 5. С практической точки зрения наибольший интерес вызывает шкала СRB-65, применение которой возможно в амбулаторных условиях, так как для этого не требуется измерения азота мочевины крови (рис. 7.1). 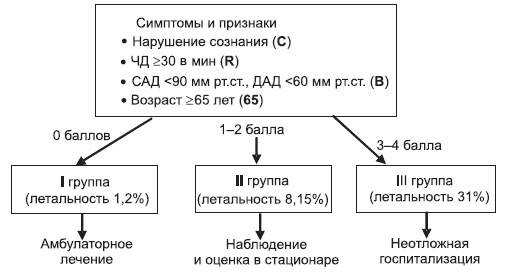 Рис. 7.1. Использование шкалы CRB-65 для выбора места лечения при ВП Однако любая из прогностических шкал является только ориентиром при выборе места лечения, и в каждом конкретном случае этот вопрос должен решаться лечащим врачом индивидуально. Ведение больных внебольничной пневмонией в амбулаторных условиях Помимо сбора анамнеза и физикального обследования, диагностический минимум должен включать исследования, позволяющие установить диагноз ВП и решить вопрос о тяжести течения и необходимости госпитализации пациента, - рентгенографию органов грудной клетки в двух проекциях и общий анализ крови. Рутинная микробиологическая диагностика ВП в амбулаторной практике недостаточно информативна и не оказывает существенного влияния на выбор антибактериального препарата. В соответствии с рекомендациями Российского респираторного общества и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (РРО/МАКМАХ, 2011 г.) среди пациентов, которые могут получать лечение в амбулаторных условиях, выделяют 2 группы, различающиеся между собой по этиологической структуре и тактике антибактериальной терапии. В первую группу включены пациенты без сопутствующих заболеваний и не принимавших за последние 3 мес системные антибиотики ≥2 дней. У этих пациентов адекватный клинический эффект может быть получен при применении пероральных препаратов. В качестве препаратов выбора рекомендуются амоксициллин или макролидные антибиотики (табл. 7.5). Во вторую группу включены пациенты с сопутствующими заболеваниями (ХОБЛ, сахарный диабет, застойная сердечная недостаточность, хроническая почечная недостаточность, цирроз печени, алкоголизм, наркомания, упадок питания) и/или принимавшие за последние 3 мес антибиотики ≥2 дней. У пациентов этой группы адекватный клинический эффект также может быть получен при назначении пероральных антибиотиков. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в том числе обладающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора рекомендуются «ингибиторзащищенные» аминопенициллины. У пациентов данной категории возможно проведение комбинированной терапии β-лактамазымами и макролидами в связи с возможной «атипичной» этиологией ВП. Еще одним направлением антимикробной химиотерапии данной категории больных может быть монотерапия респираторным фторхинолоном. Таблица 7.5. Антибактериальная терапия ВП у амбулаторных пациентов
* Cледует отдавать предпочтение макролидным антибиотикам с улучшенными фармакокинетическими свойствами (азитромицин, кларитромицин). Макролиды являются препаратами выбора при подозрении на «атипичную» этиологию ВП (C. pneumoniae, M. pneumoniae). Парентеральные антибиотики при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными. Они могут применяться лишь в единичных случаях (например, предполагаемый низкий комплаенс при приеме пероральных препаратов, невозможность своевременной госпитализации или отказ от нее; в подобных клинических ситуациях предпочтение отдают цефтриаксону, вводимому внутримышечно). Первоначальную оценку эффективности терапии следует проводить через 48-72 ч после начала лечения (повторный осмотр). Целесообразен телефонный контакт с пациентом на следующий день после начала терапии. Основными критериями эффективности в эти сроки являются снижение температуры, уменьшение симптомов интоксикации и других клинических проявлений заболевания. Если у пациента сохраняются сильная лихорадка и интоксикация или симптоматика прогрессирует, то лечение следует признать неэффективным. В этом случае необходимо пересмотреть тактику антибактериальной терапии (например, в случае отсутствия адекватного эффекта при терапии амоксициллином его следует заменить макролидом или добавить к лечению макролид) и повторно оценить целесообразность госпитализации пациента. При нетяжелой ВП антибактериальная терапия может быть завершена при стойкой нормализации температуры тела на протяжении 3-4 дней. При таком подходе длительность лечения составляет 7-10 дней. Сохранение отдельных клинических, лабораторных или рентгенологических признаков ВП не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. В подавляющем большинстве случаев их разрешение происходит самостоятельно или под влиянием симптоматической терапии. Рентгенологические проявления ВП разрешаются медленнее клинических симптомов, поэтому контрольная рентгенография грудной клетки не может служить критерием для определения длительности антибактериальной терапии. Вместе с тем при длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматике ВП необходимо провести дифференциальную диагностику с такими заболеваниями, как рак легкого, туберкулез, застойная сердечная недостаточность и др. Ведение больных внебольничной пневмонией в условиях стационара Помимо сбора анамнеза и физикального обследования, диагностический минимум должен включать в себя рентгенографию грудной клетки в двух проекциях, общий анализ крови, биохимический анализ крови (мочевина, креатинин, электролиты, печеночные ферменты), микробиологическую диагностику (микроскопию мазка, окрашенного по Граму, культураль ное исследование мокроты для выделения возбудителя и оценки его чувствительности к антибиотикам, исследование гемокультуры, обязательное при тяжелом течении заболевания). Оптимально проводить забор 2 проб венозной крови из разных вен. При тяжелой ВП также целесообразно исследовать газы артериальной крови, чтобы уточнить потребность в ИВЛ. При наличии плеврального выпота проводят плевральную пункцию и выполняют цитологическое, биохимическое и микробиологическое исследование плевральной жидкости. При ВП крайне важно быстро оценить тяжесть состояния пациента, чтобы выявить признаки тяжелой ВП, требующие неотложной терапии в условиях ОИТ (табл. 7.6). У госпитализированных пациентов подразумевается более тяжелое течение ВП, поэтому целесообразно начинать терапию с парентеральных антибиотиков. Через 3-4 дня лечения при условии нормализации температуры, уменьшения интоксикации и других симптомов заболевания возможен переход с парентерального на пероральное применение антибиотика до завершения полного курса терапии. Таблица 7.6. Критерии ВП тяжелого течения 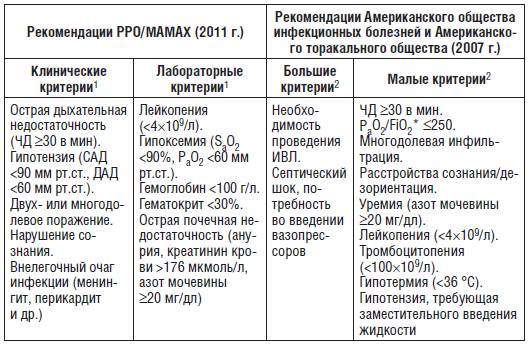 1 При наличии хотя бы одного критерия ВП расценивается как тяжелая. 2 При наличии одного большого или, по крайней мере, трех малых критериев ВП расценивается как тяжелая. * FiО2 - фракция кислорода во вдыхаемом воздухе. При нетяжелой ВП рекомендуется парентеральное применение бензилпенициллина, ампициллина, «ингибиторзащищенных» аминопенициллинов (амоксициллина/клавуланата) или цефалоспоринов II-III поколений (табл. 7.7). По данным ряда исследований, наличие в составе стартовой терапии препарата, активного в отношении «атипичных» микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациентов в стационаре, что делает оправданным применение комбинированной терапии (β-лактамазым + макролид) или монотерапии респираторным фторхинолоном (левофлоксацин, моксифлоксацин, гемифлоксацин). При тяжелой ВП назначение антибиотиков должно быть неотложным: отсрочка в их назначении на 4 ч и более существенно ухудшает прогноз. Препаратами выбора являются внутривенные цефалоспорины III поколения или ингибиторзащищенные пенициллины (амоксициллин/клавуланат) в комбинации с макролидами для внутривенного введения (эритромицин, кларитромицин, спирамицин, азитромицин). Из фторхинолонов предпочтение следует отдавать респираторным (левофлоксацину, моксифлоксацину), которые вводятся внутривенно. Имеются данные контролируемых клинических исследований о сравнимой со стандартным режимом терапии (комбинация β-лактамазымного антибиотика и макролида) эффективности монотерапии респираторными фторхинолонами при тяжелой ВП. Однако подобные исследования немногочисленны, поэтому более надежна их комбинация с цефалоспоринами III поколения (цефотаксимом, цефтриаксоном). Таблица 7.7. Антибактериальная терапия ВП у госпитализированных пациентов
1 Предпочтительна ступенчатая терапия. При стабильном состоянии пациента допускается сразу назначать препараты внутрь. 2 Следует отдавать предпочтение макролидным антибиотикам с улучшенными фармакокинетическими свойствами (азитромицин, кларитромицин). 3 При наличии факторов риска инфекции P. aeruginosa (бронхоэктазы, прием системных глюкокортикоидов, терапия антибиотиками широкого спектра действия более 7 дней в течение последнего месяца, истощение) препаратами выбора являются цефтазидим, цефепим, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, меропенем, имипенем, ципрофлоксацин. Все эти препараты можно применять в монотерапии или в комбинации с аминогликозидами II-III поколения. При подозрении на аспирацию - амоксициллин/клавуланат, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, карбапенемы (меропенем, имипенем). Первоначальная оценка эффективности антибактериальной терапии больного ВП в стационаре должна проводиться через 48 ч после начала лечения (в случаях тяжелого течения заболевания - через 24 ч). Основными критериями эффективности лечения в эти сроки являются уменьшение температуры тела, интоксикации и дыхательной недостаточности. Если у пациента сохраняются высокая лихорадка и интоксикация или прогрессируют симптомы заболевания, то лечение следует признать неэффективным и пересмотреть его тактику. При нетяжелой ВП антибактериальная терапия может быть завершена по достижении стойкой нормализации температуры тела в течение 3-4 дней. При таком подходе длительность лечения обычно составляет 7-10 дней. При тяжелой ВП неуточненной этиологии рекомендуется 10-дневный курс антибактериальной терапии. В эти же сроки обычно наблюдается исчезновение лейкоцитоза. Более длительная терапия показана при ВП стафилококковой этиологии или вызванной грамотрицательными энтеробактериями (14-21 день). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
