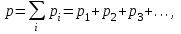Физика. Лекции. Лекция1 Предмет механики
 Скачать 1.62 Mb. Скачать 1.62 Mb.
|
§ 1. Основные понятия молекулярной физикиМолекулярная физика – это раздел физики, в котором изучаются физические свойства тел на основе рассмотрения их микроскопического, молекулярного строения.Молекула – это наименьшая устойчивая частица вещества, обладающая его основными химическими и физическими свойствами. Состоит молекула из атомов, связанных друг с другом за счет валентных электронов.Размеры молекул зависят от числа атомов в молекуле, которое составляет от двух (H2, O2, HCL) до сотен и тысяч (молекулы белков). Размеры атомов порядка 10-10 м. Несложные молекулы имеют размеры того же порядка. В атомной физике удобна внесистемная единица длины – ангстрем: 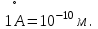 Моль – единица количества вещества в системе СИ.В одном моле вещества содержится такое число его структурных элементов (т. е. составляющих его атомов или молекул), которое равно числу атомов в 12 граммах изотопа углерода 12С. Число частиц, содержащихся в одном моле, называют числом Авогадро – NA. Численное значение числа Авогадро 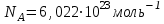 . .Относительная атомная масса, или атомная масса химического элемента – это отношение массы атома этого элемента к 1/12 массы атома 12С. Относительные атомные массы химических элементов приводятся в таблице Менделеева. Молекулярная масса вещества – это отношение массы молекулы этого вещества к 1/12 массы атома углерода 12С. Зная химическую формулу вещества, можно найти молекулярную массу как сумму атомных масс элементов, составляющих данное вещество. Молярная масса – это масса одного моля вещества, выраженная в кг на моль (система СИ). Обозначается молярная масса буквой M (или ). Из определения моля следует, что молярная масса M, выраженная в граммах, численно равна относительной молекулярной массе. Так, масса одного моля воды равна 18 г. Из определения моля следует также, что M = NAmмолекулы. Основные положения молекулярно-кинетической теории:1. Все тела состоят из мельчайших частиц – атомов и молекул. 2. Эти частицы хаотически движутся. 3. Атомы и молекулы взаимодействуют друг с другом: на малых расстояниях отталкиваются, силы отталкивания резко уменьшаются с увеличением расстояния и обращаются на каком-то расстоянии r0 в ноль; затем, при дальнейшем увеличении расстояния переходят в силы притяжения. все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них прижать плотнее друг к другому. § 3. Молекулярно-кинетическая теория идеального газаИдеальный газ – это физическая модель, в которой:а) пренебрегают собственными размерами молекул; б) пренебрегают энергией взаимодействия между молекулами; в) в процессе столкновения между собой и со стенками сосуда молекулы ведут себя как абсолютно упругие тела. Давлением p, в случае равномерного распределения сил вдоль поверхности, называется величина 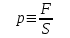 , , 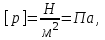 паскаль, (1.1) паскаль, (1.1)где F – сумма приложенных перпендикулярно к участку поверхности сил; S – площадь участка поверхности. Прибор для измерения давления называется манометром. За единицу абсолютной температуры T в системе СИ принят Кельвин (К). Температура в градусах Цельсия (t, C) связана с T (в К) следующим равенством: 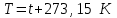 , , § 4. Уравнение состояния идеального газа – |

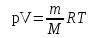 , (1.2)
, (1.2)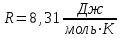 .
.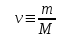 – дает число молей газа,
– дает число молей газа,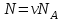 – число молекул газа;
– число молекул газа;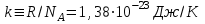 – постоянная Больцмана.
– постоянная Больцмана.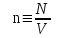 , (1.4)
, (1.4)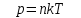 .
.